鲁科版高中化学选择性必修1第3章物质在水溶液中的行为3.4.1离子反应发生的条件课件(18张)
文档属性
| 名称 | 鲁科版高中化学选择性必修1第3章物质在水溶液中的行为3.4.1离子反应发生的条件课件(18张) |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-09 09:32:02 | ||
图片预览






文档简介
(共18张PPT)
第4节 离子反应
第1课时 离子反应发生的条件
对离子反应的概括性认识
1.概念:溶液中离子之间,以及离子与原子或分子之间发生的反应称为离子反应。
2. 条件:生成沉淀或弱电解质或气体(挥发性物质)或离子参与氧化还原反应等。
3.实质:溶液中某种或某些离子浓度降低。
4.表示方法:常用离子方程式表示。
(1)Na2S04溶液与BaCl2溶液。
(2)石灰乳[Ca(OH)2浊液]与Na2C03溶液。
(3)Na2C03溶液与盐酸。
(4)盐酸与锌粒
(5)CH3COONa溶液与盐酸
(6)KI溶液与溴水
交流·研讨
(1)SO42-+Ba2+ =BaSO4
(2)Ca(OH)2+CO32-=CaCO3 +2OH-
(3)C032-+2H+=H2O+CO2
(4)Zn+2H+=Zn2++H2
(5)CH3COO-+H+=CH3COOH
(6)2I-+Br2=2Br-+I2
有气体生成
有弱电解质生成
有氧化还原反应发生
有沉淀生成
你还学过哪些离子反应
它们各有什么特点
你认为在满足哪些条件时离子反应能够发生
为什么在这些条件下离子反应能够发生
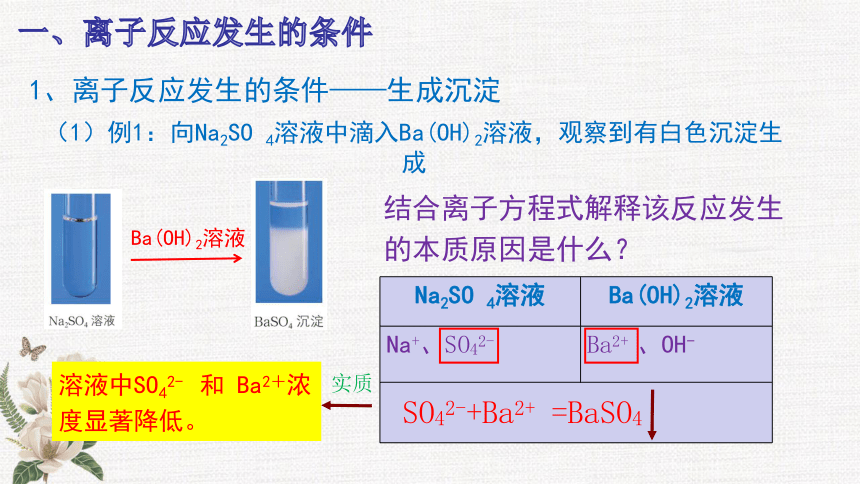
1、离子反应发生的条件——生成沉淀
(1)例1:向Na2SO 4溶液中滴入Ba(OH)2溶液,观察到有白色沉淀生成
结合离子方程式解释该反应发生的本质原因是什么?
Ba(OH)2溶液
Na2SO 4溶液 Ba(OH)2溶液
Na+、SO42- Ba2+ 、OH-
SO42-+Ba2+ =BaSO4
溶液中SO42- 和 Ba2+浓度显著降低。
实质
例1:向Na2SO4溶液中滴入Ba(OH)2溶液,观察到有白色沉淀生成
SO4 + Ba2+ = BaSO4↓
Ksp=1×10-10 mol2·L-2
K =1/Ksp=1×1010 mol-2·L2
BaSO4(s) Ba2+(aq)+SO4 (aq)
1.离子反应发生的条件——生成沉淀
2-
化学平衡常数K 的意义:K 值越大,反应正向进行的程度越大;一般来说,K >105 时,该反应就进行得基本完全了;K <10-5 时,反应进行的程度就很小,则认为这个反应很难进行。
1.离子反应发生的条件——生成沉淀
2-
例2:向MgCO3悬浊液中加入NaOH溶液,会生成Mg(OH)2沉淀。写出该反应的离子方程式,并解释该离子反应发生的本质。
MgCO3在水中电离出Mg2+,与OH-结合生成了更难溶的Mg(OH)2沉淀,从而使Mg2+浓度降低,促进MgCO3继续溶解,转化为新的沉淀Mg(OH)2 。
难溶电解质
难溶电解质
降低
2、离子反应发生的条件——生成弱电解质
弱电解质包括水、弱酸和弱碱,它们的电离程度都很小。
如:aOH + HCl的反应离子方程式为:
CH3COONa与盐酸反应的离子方程式为:
NH4Cl与NaOH溶液反应的离子方程式为:
H++OH-=H2O,离子浓度迅速降低。
CH3COO-+H+=CH3COOH,CH3COO- 、H+离子浓度均降低,强酸变成弱酸。
NH4++OH-=NH3·H2O,离子浓度降低,强碱变弱碱。
3、离子反应发生的条件——生成气体(或挥发性物质)
2-
H+与CO3 能反应的本质原因是:二者结合生成了弱电解质H2CO3,H2CO3不稳定,分解产生CO2气体脱离溶液,使溶液中H+、CO3 的浓度降低。
2-
2-
例2:将pH=12的NaOH溶液与0.01 mol/L的NH4Cl溶液等体积混合,测得溶液pH明显降低。微热,能闻到刺激性气味。用化学用语解释上述实验现象。
OH- + NH4+ = NH3·H2O
pH明显降低:
微热,有刺激性气味:
NH3·H2O NH3↑ + H2O
当反应物的浓度较大(如NaOH浓溶液)时,反应生成的NH3·H2O看方式如下反应:
NH3·H2O = NH3 ↑+ H2O
生成气体的离子反应与生成弱电解质的离子反应实质上相同的,它们都生成了弱电解质,只是由于某些弱电解质不稳定进一步分解生成气体或者某些弱电解质因溶解度较小从溶液中逸出,从而发生有关的离子反应
(1)非原电池、电解池的反应 在溶液中,具有 性和 性的离子相遇时,二者能发生氧化还原反应而使离子浓度 ,从而发生了 。
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
氧化
还原
降低
离子反应
如酸性条件下,KMnO4溶液和FeSO4溶液混合:
(2)离子型氧化还原反应发生的途径,既可以如图a,在同一容器中进行,氧化剂与还原剂直接接触,同一区域发生氧化反应和还原反应;也可以如图b,借助于原电池装置,可以使氧化剂与还原剂在不直接接触的情况下,分别在两极发生还原反应和氧化反应。
4、离子反应发生的条件——发生氧化还原反应
装置a、b中,总反应均为:
Zn + Cu2+ = Zn2+ + Cu
Zn-2e=Zn2+
Zn+Cu2+=Zn2++Cu
Cu2++2e=Cu
总的离子方程式 :
负极:
正极:
例如,电解饱和食盐水时
阴极反应式:2H+ + 2e- = H2↑
阳极反应式:2Cl- - 2e- = Cl2↑
(3)在电解、电镀过程中,在电流作用下发生的氧化还原反应往往也是离子反应。
最强
最强
I-
氧化还原反应的先后顺序
①向同浓度的NaBr和NaI混合溶液中
通入少量氯气:
通入过量氯气:
②若将少量的Cl2通入FeBr2溶液中,其离子方程式为
2Fe2+ + 4Br- + 3Cl2 2Fe3+ + 2Br2 + 6Cl-
Cl2 + 2Fe2+ 2Fe3+ + 2Cl-
2I- + Cl2 = I2 + 2Cl-
2I- + Cl2 = I2 + 2Cl-
2Br - + Cl2 = Br2 + 2Cl-
{
Cl2先氧化Fe2+再氧化Br-,Cl2不足时,只能氧化Fe2+,Cl2过量时,才能将Br-氧化
若将过量的Cl2通入过量FeBr2溶液中,其离子方程式
根据离子反应发生的条件,举例说明哪些常见离子在溶液中不能大量共存。
离子不能共存
离子反应发生
生成沉淀
生成弱电解质
生成气体
发生氧化还原反应
Ag+与Cl-生成AgCl沉淀不能大量共存
H+与ClO-生成HClO分子不能大量共存
H+与S2-生成H2S气体不能大量共存
Fe3+与I-生成Fe2+和I2不能大量共存
【归纳 小结】
以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下:将FeSO4溶液与稍过量的 NH4HCO3溶液混合,得到含FeCO3的浊液,过滤,得到 FeCO3 固体,煅烧得到 Fe O 固体。写出生成 FeCO3的离子方程式。
Fe2+ + 2HCO3- FeCO3 + H2O + CO2↑
分析:先关注微粒的种类和来源,再分析微粒的去向即反应
1.下列有关离子反应概念的理解正确的是( )
A.离子反应一定发生在离子与离子之间
B.在离子反应发生过程中,溶液中某种离子的浓度可能增大
C.离子反应的反应物均是离子
D.可逆反应不可能是离子反应
2.下列物质混合后不能发生离子反应的是( )
A.FeCl3溶液中加入KSCN溶液 B.SO2通入氯水中
C.Cu粉投入FeCl3溶液 D.稀硫酸与NaCl溶液
B
D
C
C
3.下列各组离子中,能在强酸溶液里大量共存,并且溶液呈无色透明的是( )
A.MnO4、K+、Na+、SO4 B.Na+、K+、HCO3、Cl-
C.Mg2+、NH4、Cl-、NO3 D.Ba2+、K+、S2-、SO4
4.下列离子组中,因发生氧化还原反应而不能大量共存的是( )
A.Fe3+、NH4、CH3COO-、Cl- B.Ba2+、Na+、SO4、Cl-
C.H+、NO3、SO3、Na+ D.HCO3、OH-、Cl-、Ca2+
-
2-
2-
+
-
2-
+
2-
-
2-
-
B
第4节 离子反应
第1课时 离子反应发生的条件
对离子反应的概括性认识
1.概念:溶液中离子之间,以及离子与原子或分子之间发生的反应称为离子反应。
2. 条件:生成沉淀或弱电解质或气体(挥发性物质)或离子参与氧化还原反应等。
3.实质:溶液中某种或某些离子浓度降低。
4.表示方法:常用离子方程式表示。
(1)Na2S04溶液与BaCl2溶液。
(2)石灰乳[Ca(OH)2浊液]与Na2C03溶液。
(3)Na2C03溶液与盐酸。
(4)盐酸与锌粒
(5)CH3COONa溶液与盐酸
(6)KI溶液与溴水
交流·研讨
(1)SO42-+Ba2+ =BaSO4
(2)Ca(OH)2+CO32-=CaCO3 +2OH-
(3)C032-+2H+=H2O+CO2
(4)Zn+2H+=Zn2++H2
(5)CH3COO-+H+=CH3COOH
(6)2I-+Br2=2Br-+I2
有气体生成
有弱电解质生成
有氧化还原反应发生
有沉淀生成
你还学过哪些离子反应
它们各有什么特点
你认为在满足哪些条件时离子反应能够发生
为什么在这些条件下离子反应能够发生
1、离子反应发生的条件——生成沉淀
(1)例1:向Na2SO 4溶液中滴入Ba(OH)2溶液,观察到有白色沉淀生成
结合离子方程式解释该反应发生的本质原因是什么?
Ba(OH)2溶液
Na2SO 4溶液 Ba(OH)2溶液
Na+、SO42- Ba2+ 、OH-
SO42-+Ba2+ =BaSO4
溶液中SO42- 和 Ba2+浓度显著降低。
实质
例1:向Na2SO4溶液中滴入Ba(OH)2溶液,观察到有白色沉淀生成
SO4 + Ba2+ = BaSO4↓
Ksp=1×10-10 mol2·L-2
K =1/Ksp=1×1010 mol-2·L2
BaSO4(s) Ba2+(aq)+SO4 (aq)
1.离子反应发生的条件——生成沉淀
2-
化学平衡常数K 的意义:K 值越大,反应正向进行的程度越大;一般来说,K >105 时,该反应就进行得基本完全了;K <10-5 时,反应进行的程度就很小,则认为这个反应很难进行。
1.离子反应发生的条件——生成沉淀
2-
例2:向MgCO3悬浊液中加入NaOH溶液,会生成Mg(OH)2沉淀。写出该反应的离子方程式,并解释该离子反应发生的本质。
MgCO3在水中电离出Mg2+,与OH-结合生成了更难溶的Mg(OH)2沉淀,从而使Mg2+浓度降低,促进MgCO3继续溶解,转化为新的沉淀Mg(OH)2 。
难溶电解质
难溶电解质
降低
2、离子反应发生的条件——生成弱电解质
弱电解质包括水、弱酸和弱碱,它们的电离程度都很小。
如:aOH + HCl的反应离子方程式为:
CH3COONa与盐酸反应的离子方程式为:
NH4Cl与NaOH溶液反应的离子方程式为:
H++OH-=H2O,离子浓度迅速降低。
CH3COO-+H+=CH3COOH,CH3COO- 、H+离子浓度均降低,强酸变成弱酸。
NH4++OH-=NH3·H2O,离子浓度降低,强碱变弱碱。
3、离子反应发生的条件——生成气体(或挥发性物质)
2-
H+与CO3 能反应的本质原因是:二者结合生成了弱电解质H2CO3,H2CO3不稳定,分解产生CO2气体脱离溶液,使溶液中H+、CO3 的浓度降低。
2-
2-
例2:将pH=12的NaOH溶液与0.01 mol/L的NH4Cl溶液等体积混合,测得溶液pH明显降低。微热,能闻到刺激性气味。用化学用语解释上述实验现象。
OH- + NH4+ = NH3·H2O
pH明显降低:
微热,有刺激性气味:
NH3·H2O NH3↑ + H2O
当反应物的浓度较大(如NaOH浓溶液)时,反应生成的NH3·H2O看方式如下反应:
NH3·H2O = NH3 ↑+ H2O
生成气体的离子反应与生成弱电解质的离子反应实质上相同的,它们都生成了弱电解质,只是由于某些弱电解质不稳定进一步分解生成气体或者某些弱电解质因溶解度较小从溶液中逸出,从而发生有关的离子反应
(1)非原电池、电解池的反应 在溶液中,具有 性和 性的离子相遇时,二者能发生氧化还原反应而使离子浓度 ,从而发生了 。
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
氧化
还原
降低
离子反应
如酸性条件下,KMnO4溶液和FeSO4溶液混合:
(2)离子型氧化还原反应发生的途径,既可以如图a,在同一容器中进行,氧化剂与还原剂直接接触,同一区域发生氧化反应和还原反应;也可以如图b,借助于原电池装置,可以使氧化剂与还原剂在不直接接触的情况下,分别在两极发生还原反应和氧化反应。
4、离子反应发生的条件——发生氧化还原反应
装置a、b中,总反应均为:
Zn + Cu2+ = Zn2+ + Cu
Zn-2e=Zn2+
Zn+Cu2+=Zn2++Cu
Cu2++2e=Cu
总的离子方程式 :
负极:
正极:
例如,电解饱和食盐水时
阴极反应式:2H+ + 2e- = H2↑
阳极反应式:2Cl- - 2e- = Cl2↑
(3)在电解、电镀过程中,在电流作用下发生的氧化还原反应往往也是离子反应。
最强
最强
I-
氧化还原反应的先后顺序
①向同浓度的NaBr和NaI混合溶液中
通入少量氯气:
通入过量氯气:
②若将少量的Cl2通入FeBr2溶液中,其离子方程式为
2Fe2+ + 4Br- + 3Cl2 2Fe3+ + 2Br2 + 6Cl-
Cl2 + 2Fe2+ 2Fe3+ + 2Cl-
2I- + Cl2 = I2 + 2Cl-
2I- + Cl2 = I2 + 2Cl-
2Br - + Cl2 = Br2 + 2Cl-
{
Cl2先氧化Fe2+再氧化Br-,Cl2不足时,只能氧化Fe2+,Cl2过量时,才能将Br-氧化
若将过量的Cl2通入过量FeBr2溶液中,其离子方程式
根据离子反应发生的条件,举例说明哪些常见离子在溶液中不能大量共存。
离子不能共存
离子反应发生
生成沉淀
生成弱电解质
生成气体
发生氧化还原反应
Ag+与Cl-生成AgCl沉淀不能大量共存
H+与ClO-生成HClO分子不能大量共存
H+与S2-生成H2S气体不能大量共存
Fe3+与I-生成Fe2+和I2不能大量共存
【归纳 小结】
以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下:将FeSO4溶液与稍过量的 NH4HCO3溶液混合,得到含FeCO3的浊液,过滤,得到 FeCO3 固体,煅烧得到 Fe O 固体。写出生成 FeCO3的离子方程式。
Fe2+ + 2HCO3- FeCO3 + H2O + CO2↑
分析:先关注微粒的种类和来源,再分析微粒的去向即反应
1.下列有关离子反应概念的理解正确的是( )
A.离子反应一定发生在离子与离子之间
B.在离子反应发生过程中,溶液中某种离子的浓度可能增大
C.离子反应的反应物均是离子
D.可逆反应不可能是离子反应
2.下列物质混合后不能发生离子反应的是( )
A.FeCl3溶液中加入KSCN溶液 B.SO2通入氯水中
C.Cu粉投入FeCl3溶液 D.稀硫酸与NaCl溶液
B
D
C
C
3.下列各组离子中,能在强酸溶液里大量共存,并且溶液呈无色透明的是( )
A.MnO4、K+、Na+、SO4 B.Na+、K+、HCO3、Cl-
C.Mg2+、NH4、Cl-、NO3 D.Ba2+、K+、S2-、SO4
4.下列离子组中,因发生氧化还原反应而不能大量共存的是( )
A.Fe3+、NH4、CH3COO-、Cl- B.Ba2+、Na+、SO4、Cl-
C.H+、NO3、SO3、Na+ D.HCO3、OH-、Cl-、Ca2+
-
2-
2-
+
-
2-
+
2-
-
2-
-
B
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
