鲁科版高中化学选择性必修1第3章物质在水溶液中的行为3.4.2离子反应的应用酸碱中和滴定课件(34张)
文档属性
| 名称 | 鲁科版高中化学选择性必修1第3章物质在水溶液中的行为3.4.2离子反应的应用酸碱中和滴定课件(34张) |

|
|
| 格式 | ppt | ||
| 文件大小 | 4.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-09 09:24:58 | ||
图片预览










文档简介
(共34张PPT)
第4节 离子反应
第2课时 离子反应的应用 酸碱中和滴定
离子反应
的应用
物质的检验(定性)
物质含量的测定(定量)
物质的纯化
物质的制备
解释生产生活中的某些现象
……
【应用1】现有已知浓度的NaOH溶液,如何测定盐酸中H+浓度呢?
二、离子反应的应用
1、酸碱中和滴定的定义:
用已知物质的量浓度的酸或碱(标准溶液)来测定未知物质的量浓度的碱或酸(待测溶液或未知溶液)的方法叫做酸碱中和滴定。
(一)物质的含量测定
酸碱中和滴定
已知浓度的溶液——标准液
未知浓度的溶液——待测液
2、酸碱中和滴定的原理:
以酸碱中和反应为基础 ( H++ OH- = H2O) , 在滴定达到终点 (即酸碱恰好反应)时,有 n(H+) =n(OH-) 即:C酸(H+) V酸= C碱(H+) V碱
C碱 V碱
V酸
C酸=
C酸 V酸
V碱
C碱=
量取一定体积的待测液,用已知浓度的标准液来滴定,并记录所消耗标准液的体积,就可以计算出待测液的浓度。
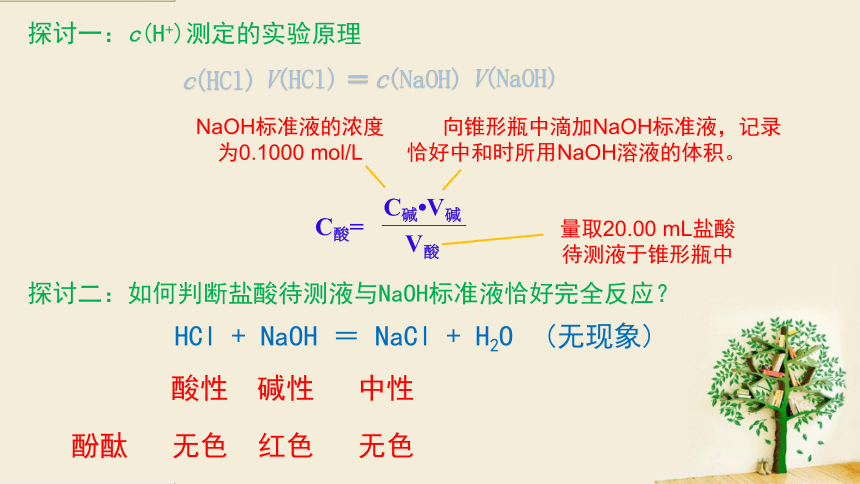
探讨一:c(H+)测定的实验原理
c(NaOH)
c(HCl)
V(NaOH)
V(HCl)
=
所求?
已知
已知
实验测量数据
探讨一:c(H+)测定的实验原理
量取20.00 mL盐酸 待测液于锥形瓶中
NaOH标准液的浓度为0.1000 mol/L
向锥形瓶中滴加NaOH标准液,记录恰好中和时所用NaOH溶液的体积。
C碱 V碱
V酸
C酸=
探讨二:如何判断盐酸待测液与NaOH标准液恰好完全反应?
HCl + NaOH = NaCl + H2O (无现象)
酸性 碱性 中性
酚酞 无色 红色 无色
探讨三:酸碱中和滴定的关键:
⑴准确量取(测定)参加反应的酸溶液和碱溶液的体积。
⑵ 准确判断中和反应的恰好进行(判断滴定终点)。
使用酸碱指示剂来确定滴定终点。
酸碱指示剂:酚酞、甲基橙、石蕊等。
使用酸式和碱式滴定管量取溶液体积。(或使用移液管)
甲基橙
——— 3.1 ——— 4.4 ———
酸性 中间色 碱性
红色 橙色
——— 5.0 ——— 8.0 ———
——— 8.2 ——— 10.0 ———
红色 紫色 蓝色
粉红色
无色
红色
黄色
常用指示剂
的变色范围
石 蕊
酚 酞
强酸强碱相互滴定,可选择酚酞作指示剂。
3、实验仪器
烧杯
锥形瓶
铁架台
酸式滴定管
碱式滴定管
滴定管夹
移液管
滴定管主要用来精确地量取(转移)一定体积的液体。 移液管是用来准确转移固定体积的液体。
滴定管是内径均匀、带有刻度的细长玻璃管,下端有控制液体流量的玻璃活塞(或由橡胶管和玻璃球组成的阀)。
滴定管有“0”刻度,且小刻度在上,由上及下增大。
最小刻度0.1 ml,精确度0.01mL。
① 查漏:活塞处是否漏水。
② 洗涤:先用蒸馏水洗,再用待盛溶液润洗2~3次。
③ 装液:注入待盛溶液,使液面位于“0”刻度线以上2~ 3 cm处,再把滴定管固定在滴定管夹上。
④排气:在滴定管下方放一个烧杯,调节活塞使滴定管的尖嘴部分充满溶液,不留气泡。
⑤调零:调节液面处在“0”或“0”以下某刻度处。
⑥读数:记下液面准确读数
a.视线与凹液面最低处保持水平
b.估读到小数点后第二位
注意事项:
左手控制滴定管活塞,右手振荡锥形瓶(向同一方向做圆周运动);眼睛注视锥形瓶内溶液的颜色变化,至指示剂变色半分钟不褪色即为终点。
滴加速度先快后慢,直至指示剂颜色突变。
等到滴入最后一滴标准液,指示剂变色,且在半分钟内不恢复原来的颜色,视为滴定终点并记录标准液的体积。
1.滴定管操作方法
2.终点判断
5.数据获得与处理
按上述中和滴定操作重复二至三次,记录每次氢氧化钠标准液的消耗体积,取平均值,代入下列公式进行计算。
若上述酸碱中和滴定的实验数据如下表所示,试通过计算确定盐酸的物质的量浓度。
实验
编号 NaOH标准液的浓度(mol/L) 滴定完成时消耗 NaOH的体积(mL) 盐酸待测液的体积(mL)
1 0.1000 23.52 25.00
2 0.1000 23.50 25.00
3 0.1000 22.48 25.00
=
0.1000 mol/L×23.50 mL
25.00 mL
= 0.0940 mol/L
PH
12
10
8
6
4
2
10
20
30
40
反应终点
0
pH
突变范围
V(NaOH)/mL
酚酞变色点
甲基橙变色点
10
8
指示剂的变色范围和接近滴定终点时的PH突变范围的关系
用NaOH溶液滴定HCl溶液
中和滴定曲线
6、中和滴定误差分析
误差的大小要根据计算式分析。
一般来说,实验中造成的误差对c待测的影响,均可以转化为:c标准、V待测均为定值,实验中最终所使用的V标准的数值的大小。
V标准多,c待测偏大,V标准少,c待测偏小
产生误差的操作 NaOH标准液的体积用量 H+浓度的计算结果
1.盛盐酸待测液锥形瓶用蒸馏水洗后又用待测液洗
2.盛标准液的滴定管用蒸馏水洗后未用标准液润洗
偏高
偏高
偏高
偏高
俯视图
仰视图
正确视线
仰视视线
正确读数
仰视读数
读数偏大
正确视线
俯视视线
正确读数
俯视读数
读数偏小
俯、仰视对读数的影响
例题:用标准盐酸滴定未知浓度的氢氧化钠溶液(氢氧化钠放于锥形瓶中)下列操作(其它操作均正确),对氢氧化钠溶液浓度有什么影响?
⑴未用标准液(HCl)润洗酸式滴定管
⑵滴定管内壁不干净,滴定后,酸式滴定管内壁挂水珠
⑶滴定管尖嘴处有气泡,滴定后气泡消失
⑷滴定操作时,有少量盐酸滴于锥形瓶外
⑸锥形瓶内用蒸馏水洗涤后,再用待测氢氧化钠润洗2-3次,将润洗液倒掉,再装NaOH溶液
⑹锥形瓶用蒸馏水洗后未倒尽即装NaOH溶液
偏高
偏高
偏高
偏高
c标准×V标准
V待测
=
c待测
偏高
无影响
酸碱中和滴定方法的拓展应用
滴定法测 离子浓度
原理:
类型
利用离子反应的定比关系,用已知准确浓度的溶液,来滴定未知浓度的溶液。
酸碱中和滴定
氧化还原滴定
沉淀法滴定
……
例:用含MnO4 的标准液滴定待测液中Fe2+的浓度。
-
原理:MnO4 +5Fe2+ +8H+ = 5Fe3+ +Mn2++4H2O
指示剂:酸性KMnO4溶液本身呈紫色,不用另外选择指示剂,当滴入最后一滴含MnO4 的标准液后,溶液由无色变紫红色,且半分钟内紫红色不褪去,说明到达滴定终点。
-
-
C
C
3.准确移取20.00 mL某待测HCl溶液于锥形瓶中,用0.100 0 mol·L-1NaOH溶液滴定,下列说法正确的是( )
A.滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定
B.随着NaOH溶液滴入,锥形瓶中溶液pH由小变大
C.用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定
D.滴定达终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小
B
4.用1.0 mol·L-1 NaOH溶液中和某浓度硫酸溶液时,其pH和所加NaOH溶液的体积V关系如图所示。原硫酸溶液的物质的量浓度和反应后溶液的总体积是( )
A.1 mol·L-1 60 mL B.0.5 mol·L-1 80 mL
C.0.5 mol·L-1 60 mL D.1 mol·L-1 80 mL
B
A
二、离子反应的应用
(二)物质的检验
1.离子检验的类型(1)生成沉淀;(2)生成气体;(3)显示特殊颜色。
(二)离子检验
二、离子反应的应用
方法 离子 试剂 现象 注意
沉淀法 Cl-、Br-、I- AgNO3溶液和稀硝酸 AgCl(白色)、AgBr(淡黄色)、AgI(黄色) —
SO42- 稀盐酸和BaCl2溶液 白色沉淀 先用稀盐酸酸化
Fe2+ NaOH溶液 白色沉淀→灰绿色沉淀→红褐色沉淀 —
Fe3+ NaOH溶液 红褐色沉淀 —
Al3+ NaOH溶液 白色沉淀→溶解 —
2.检验方法
气
体
法 NH4+ 浓NaOH溶液和湿润的红色石蕊试纸 产生有刺激性气味的气体,且气体能使湿润的红色石蕊试纸变蓝 要加热
CO32- 稀盐酸和澄清石灰水 澄清石灰水变浑浊 SO32-、HCO3-、HSO3-有干扰
SO32- 稀硫酸和品红溶液 产生有刺激性气味的气体,且气体能使品红溶液褪色 —
显
色
法 I- 氯水(少量),CCl4 下层为紫色 —
Fe2+
Fe3+ KSCN溶液 红色 —
焰色反应法 Na+、K+ Pt(Fe)丝和稀盐酸 火焰分别呈黄色、紫色 K+要透过蓝色钴玻璃片观察焰色
KSCN溶液和氯水
先是无变化,滴加氯水后变红色
先加KSCN溶液,无变化,再加氯水
铁氰化钾溶液
蓝色
—
1.物质的制备
(1)氯碱工业: 。
(2)实验室制取CO2:
2.物质的纯化
(1)制高纯度的氯化钠:除去其中少量的 ,
需要引入的试剂离子分别为: 。
(2)除去污水中的重金属离子,用 将其转化为 而除去,达到净水的目的。
CaCO3+2H+= Ca2++H2O+CO2↑
Ca2+、Mg2+、SO42-
CO32-、OH-、Ba2+
沉淀剂
沉淀
(三) 物质制备与纯化
通电
1.胃酸过多的治疗
(1)服用小苏打片:离子方程式为
。
由于小苏打在治疗胃酸过多的时候产生CO2气体,如果病人同时患有胃溃疡,容易造成胃穿孔。
(2)服用胃舒平:离子方程式为
。
HCO3-+H+===H2O+CO2↑
Al(OH)3+3H+===Al3++3H2O
(四)生活中常见的离子反应
2.硬水的形成及软化
(1)硬水
①含义:含有 较多的水;
②暂时硬水:含有 较多的水。
(2)形成(暂时硬水)
离子方程式为 ;
。
(3)软化方法
①加热法软化暂时硬水: 。
②加沉淀剂法:在硬水中加入 等沉淀剂的离子方程式为:
Ca2+、Mg2+
Ca(HCO3)2、Mg(HCO3)2
CaCO3+CO2+H2O = Ca2++2HCO3-
MgCO3+CO2+H2O = Mg2++2HCO3-
Ca2++2HCO3-= CaCO3↓+
CO2↑+H2O;Mg2++2HCO3-= MgCO3↓+CO2↑+H2O
Ca2++CO32-= CaCO3↓;Mg2++CO32-= MgCO3↓
。
Na2CO3
【课堂小结】
离子反应
的应用
物质的检验
物质的测定
物质的纯化
物质的制备
解释生产生活中的某些现象
……
(利用某离子的特征反应检验该离子)
(利用离子反应定比关系进行定量测定及换算)
(利用离子反应将离子转化为沉淀或气体除去)
(将离子转化为目标物质进行物质的制备)
(用离子反应揭示变化的本质)
1.在无色透明的未知溶液中加入BaCl2溶液生成不溶于稀硝酸的白色沉淀,则未知溶液中( )
A.一定存在Ag+ B. 一定存在SO42-
C.可能存在Ag+或SO42- D.一定含Ag+和SO42-
2.下列能发生的反应中,离子方程式正确的是( )
A.硫酸与Ba(OH)2溶液混合:Ba2++OH-+H++SO42-=H2O+BaSO4↓
B.碳酸钙和盐酸混合:CO32-+2H+=CO2↑+H2O
C.足量的氯气通入FeBr2溶液中:2Fe2++4Br-+Cl2=2Fe3++2Br2+6Cl-
D.MgCl2溶液中通入二氧化碳:Mg2++CO2+H2O=MgCO3↓+2H+
C
C
3.重金属离子有毒。实验室有甲、乙两种废液,均有一定毒性。甲废液经化验呈碱性,主要的有毒离子为Ba2+。如将甲、乙两废液按一定比例混合,毒性明显降低。乙废液中可能含有的离子是( )
A.Cu2+和SO42- B. Cu2+和Cl- C.K+和SO42- D.Ag+和NO3-
A
4.某同学为检验溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作,其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得到的正确结论是( )。
A.原溶液中一定含有SO42-
B.原溶液中一定含有NH4+
C.原溶液中一定含有Cl-
D.原溶液中一定含有Fe3+
B
5、某强酸性溶液X中可能含有Fe2+、Al3+、NH4+、CO32-、SO32-、SO42- 、Cl-中的若干种,现取X溶液进行连续实验,实验过程及产物如下:
B
6、25 ℃时,将pH均为2的盐酸与HX溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。下列说法不正确的是( )
A.a、b两点:c平(X-)>c平(Cl-)
B.溶液的导电性:a>b
C.稀释前,c平(HX)>0.01 mol·L-1
D.溶液体积稀释到原来的10倍,HX溶
液的pH<3
B
第4节 离子反应
第2课时 离子反应的应用 酸碱中和滴定
离子反应
的应用
物质的检验(定性)
物质含量的测定(定量)
物质的纯化
物质的制备
解释生产生活中的某些现象
……
【应用1】现有已知浓度的NaOH溶液,如何测定盐酸中H+浓度呢?
二、离子反应的应用
1、酸碱中和滴定的定义:
用已知物质的量浓度的酸或碱(标准溶液)来测定未知物质的量浓度的碱或酸(待测溶液或未知溶液)的方法叫做酸碱中和滴定。
(一)物质的含量测定
酸碱中和滴定
已知浓度的溶液——标准液
未知浓度的溶液——待测液
2、酸碱中和滴定的原理:
以酸碱中和反应为基础 ( H++ OH- = H2O) , 在滴定达到终点 (即酸碱恰好反应)时,有 n(H+) =n(OH-) 即:C酸(H+) V酸= C碱(H+) V碱
C碱 V碱
V酸
C酸=
C酸 V酸
V碱
C碱=
量取一定体积的待测液,用已知浓度的标准液来滴定,并记录所消耗标准液的体积,就可以计算出待测液的浓度。
探讨一:c(H+)测定的实验原理
c(NaOH)
c(HCl)
V(NaOH)
V(HCl)
=
所求?
已知
已知
实验测量数据
探讨一:c(H+)测定的实验原理
量取20.00 mL盐酸 待测液于锥形瓶中
NaOH标准液的浓度为0.1000 mol/L
向锥形瓶中滴加NaOH标准液,记录恰好中和时所用NaOH溶液的体积。
C碱 V碱
V酸
C酸=
探讨二:如何判断盐酸待测液与NaOH标准液恰好完全反应?
HCl + NaOH = NaCl + H2O (无现象)
酸性 碱性 中性
酚酞 无色 红色 无色
探讨三:酸碱中和滴定的关键:
⑴准确量取(测定)参加反应的酸溶液和碱溶液的体积。
⑵ 准确判断中和反应的恰好进行(判断滴定终点)。
使用酸碱指示剂来确定滴定终点。
酸碱指示剂:酚酞、甲基橙、石蕊等。
使用酸式和碱式滴定管量取溶液体积。(或使用移液管)
甲基橙
——— 3.1 ——— 4.4 ———
酸性 中间色 碱性
红色 橙色
——— 5.0 ——— 8.0 ———
——— 8.2 ——— 10.0 ———
红色 紫色 蓝色
粉红色
无色
红色
黄色
常用指示剂
的变色范围
石 蕊
酚 酞
强酸强碱相互滴定,可选择酚酞作指示剂。
3、实验仪器
烧杯
锥形瓶
铁架台
酸式滴定管
碱式滴定管
滴定管夹
移液管
滴定管主要用来精确地量取(转移)一定体积的液体。 移液管是用来准确转移固定体积的液体。
滴定管是内径均匀、带有刻度的细长玻璃管,下端有控制液体流量的玻璃活塞(或由橡胶管和玻璃球组成的阀)。
滴定管有“0”刻度,且小刻度在上,由上及下增大。
最小刻度0.1 ml,精确度0.01mL。
① 查漏:活塞处是否漏水。
② 洗涤:先用蒸馏水洗,再用待盛溶液润洗2~3次。
③ 装液:注入待盛溶液,使液面位于“0”刻度线以上2~ 3 cm处,再把滴定管固定在滴定管夹上。
④排气:在滴定管下方放一个烧杯,调节活塞使滴定管的尖嘴部分充满溶液,不留气泡。
⑤调零:调节液面处在“0”或“0”以下某刻度处。
⑥读数:记下液面准确读数
a.视线与凹液面最低处保持水平
b.估读到小数点后第二位
注意事项:
左手控制滴定管活塞,右手振荡锥形瓶(向同一方向做圆周运动);眼睛注视锥形瓶内溶液的颜色变化,至指示剂变色半分钟不褪色即为终点。
滴加速度先快后慢,直至指示剂颜色突变。
等到滴入最后一滴标准液,指示剂变色,且在半分钟内不恢复原来的颜色,视为滴定终点并记录标准液的体积。
1.滴定管操作方法
2.终点判断
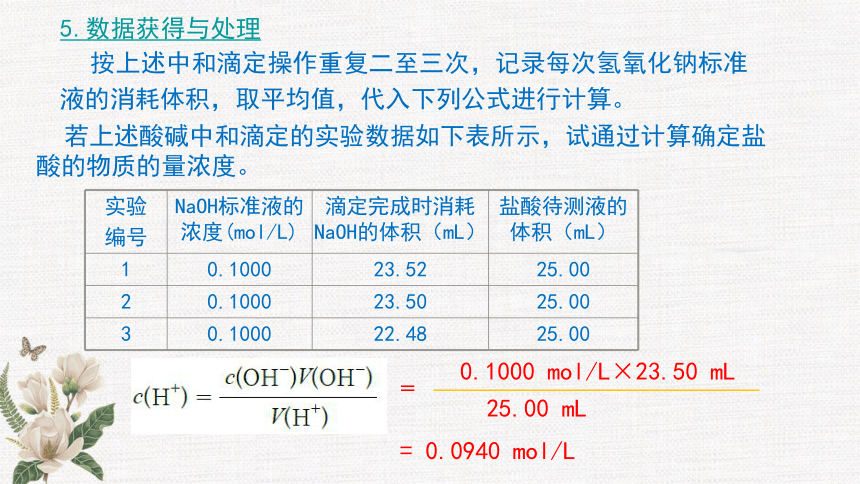
5.数据获得与处理
按上述中和滴定操作重复二至三次,记录每次氢氧化钠标准液的消耗体积,取平均值,代入下列公式进行计算。
若上述酸碱中和滴定的实验数据如下表所示,试通过计算确定盐酸的物质的量浓度。
实验
编号 NaOH标准液的浓度(mol/L) 滴定完成时消耗 NaOH的体积(mL) 盐酸待测液的体积(mL)
1 0.1000 23.52 25.00
2 0.1000 23.50 25.00
3 0.1000 22.48 25.00
=
0.1000 mol/L×23.50 mL
25.00 mL
= 0.0940 mol/L
PH
12
10
8
6
4
2
10
20
30
40
反应终点
0
pH
突变范围
V(NaOH)/mL
酚酞变色点
甲基橙变色点
10
8
指示剂的变色范围和接近滴定终点时的PH突变范围的关系
用NaOH溶液滴定HCl溶液
中和滴定曲线
6、中和滴定误差分析
误差的大小要根据计算式分析。
一般来说,实验中造成的误差对c待测的影响,均可以转化为:c标准、V待测均为定值,实验中最终所使用的V标准的数值的大小。
V标准多,c待测偏大,V标准少,c待测偏小
产生误差的操作 NaOH标准液的体积用量 H+浓度的计算结果
1.盛盐酸待测液锥形瓶用蒸馏水洗后又用待测液洗
2.盛标准液的滴定管用蒸馏水洗后未用标准液润洗
偏高
偏高
偏高
偏高
俯视图
仰视图
正确视线
仰视视线
正确读数
仰视读数
读数偏大
正确视线
俯视视线
正确读数
俯视读数
读数偏小
俯、仰视对读数的影响
例题:用标准盐酸滴定未知浓度的氢氧化钠溶液(氢氧化钠放于锥形瓶中)下列操作(其它操作均正确),对氢氧化钠溶液浓度有什么影响?
⑴未用标准液(HCl)润洗酸式滴定管
⑵滴定管内壁不干净,滴定后,酸式滴定管内壁挂水珠
⑶滴定管尖嘴处有气泡,滴定后气泡消失
⑷滴定操作时,有少量盐酸滴于锥形瓶外
⑸锥形瓶内用蒸馏水洗涤后,再用待测氢氧化钠润洗2-3次,将润洗液倒掉,再装NaOH溶液
⑹锥形瓶用蒸馏水洗后未倒尽即装NaOH溶液
偏高
偏高
偏高
偏高
c标准×V标准
V待测
=
c待测
偏高
无影响
酸碱中和滴定方法的拓展应用
滴定法测 离子浓度
原理:
类型
利用离子反应的定比关系,用已知准确浓度的溶液,来滴定未知浓度的溶液。
酸碱中和滴定
氧化还原滴定
沉淀法滴定
……
例:用含MnO4 的标准液滴定待测液中Fe2+的浓度。
-
原理:MnO4 +5Fe2+ +8H+ = 5Fe3+ +Mn2++4H2O
指示剂:酸性KMnO4溶液本身呈紫色,不用另外选择指示剂,当滴入最后一滴含MnO4 的标准液后,溶液由无色变紫红色,且半分钟内紫红色不褪去,说明到达滴定终点。
-
-
C
C
3.准确移取20.00 mL某待测HCl溶液于锥形瓶中,用0.100 0 mol·L-1NaOH溶液滴定,下列说法正确的是( )
A.滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定
B.随着NaOH溶液滴入,锥形瓶中溶液pH由小变大
C.用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定
D.滴定达终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小
B
4.用1.0 mol·L-1 NaOH溶液中和某浓度硫酸溶液时,其pH和所加NaOH溶液的体积V关系如图所示。原硫酸溶液的物质的量浓度和反应后溶液的总体积是( )
A.1 mol·L-1 60 mL B.0.5 mol·L-1 80 mL
C.0.5 mol·L-1 60 mL D.1 mol·L-1 80 mL
B
A
二、离子反应的应用
(二)物质的检验
1.离子检验的类型(1)生成沉淀;(2)生成气体;(3)显示特殊颜色。
(二)离子检验
二、离子反应的应用
方法 离子 试剂 现象 注意
沉淀法 Cl-、Br-、I- AgNO3溶液和稀硝酸 AgCl(白色)、AgBr(淡黄色)、AgI(黄色) —
SO42- 稀盐酸和BaCl2溶液 白色沉淀 先用稀盐酸酸化
Fe2+ NaOH溶液 白色沉淀→灰绿色沉淀→红褐色沉淀 —
Fe3+ NaOH溶液 红褐色沉淀 —
Al3+ NaOH溶液 白色沉淀→溶解 —
2.检验方法
气
体
法 NH4+ 浓NaOH溶液和湿润的红色石蕊试纸 产生有刺激性气味的气体,且气体能使湿润的红色石蕊试纸变蓝 要加热
CO32- 稀盐酸和澄清石灰水 澄清石灰水变浑浊 SO32-、HCO3-、HSO3-有干扰
SO32- 稀硫酸和品红溶液 产生有刺激性气味的气体,且气体能使品红溶液褪色 —
显
色
法 I- 氯水(少量),CCl4 下层为紫色 —
Fe2+
Fe3+ KSCN溶液 红色 —
焰色反应法 Na+、K+ Pt(Fe)丝和稀盐酸 火焰分别呈黄色、紫色 K+要透过蓝色钴玻璃片观察焰色
KSCN溶液和氯水
先是无变化,滴加氯水后变红色
先加KSCN溶液,无变化,再加氯水
铁氰化钾溶液
蓝色
—
1.物质的制备
(1)氯碱工业: 。
(2)实验室制取CO2:
2.物质的纯化
(1)制高纯度的氯化钠:除去其中少量的 ,
需要引入的试剂离子分别为: 。
(2)除去污水中的重金属离子,用 将其转化为 而除去,达到净水的目的。
CaCO3+2H+= Ca2++H2O+CO2↑
Ca2+、Mg2+、SO42-
CO32-、OH-、Ba2+
沉淀剂
沉淀
(三) 物质制备与纯化
通电
1.胃酸过多的治疗
(1)服用小苏打片:离子方程式为
。
由于小苏打在治疗胃酸过多的时候产生CO2气体,如果病人同时患有胃溃疡,容易造成胃穿孔。
(2)服用胃舒平:离子方程式为
。
HCO3-+H+===H2O+CO2↑
Al(OH)3+3H+===Al3++3H2O
(四)生活中常见的离子反应
2.硬水的形成及软化
(1)硬水
①含义:含有 较多的水;
②暂时硬水:含有 较多的水。
(2)形成(暂时硬水)
离子方程式为 ;
。
(3)软化方法
①加热法软化暂时硬水: 。
②加沉淀剂法:在硬水中加入 等沉淀剂的离子方程式为:
Ca2+、Mg2+
Ca(HCO3)2、Mg(HCO3)2
CaCO3+CO2+H2O = Ca2++2HCO3-
MgCO3+CO2+H2O = Mg2++2HCO3-
Ca2++2HCO3-= CaCO3↓+
CO2↑+H2O;Mg2++2HCO3-= MgCO3↓+CO2↑+H2O
Ca2++CO32-= CaCO3↓;Mg2++CO32-= MgCO3↓
。
Na2CO3
【课堂小结】
离子反应
的应用
物质的检验
物质的测定
物质的纯化
物质的制备
解释生产生活中的某些现象
……
(利用某离子的特征反应检验该离子)
(利用离子反应定比关系进行定量测定及换算)
(利用离子反应将离子转化为沉淀或气体除去)
(将离子转化为目标物质进行物质的制备)
(用离子反应揭示变化的本质)
1.在无色透明的未知溶液中加入BaCl2溶液生成不溶于稀硝酸的白色沉淀,则未知溶液中( )
A.一定存在Ag+ B. 一定存在SO42-
C.可能存在Ag+或SO42- D.一定含Ag+和SO42-
2.下列能发生的反应中,离子方程式正确的是( )
A.硫酸与Ba(OH)2溶液混合:Ba2++OH-+H++SO42-=H2O+BaSO4↓
B.碳酸钙和盐酸混合:CO32-+2H+=CO2↑+H2O
C.足量的氯气通入FeBr2溶液中:2Fe2++4Br-+Cl2=2Fe3++2Br2+6Cl-
D.MgCl2溶液中通入二氧化碳:Mg2++CO2+H2O=MgCO3↓+2H+
C
C
3.重金属离子有毒。实验室有甲、乙两种废液,均有一定毒性。甲废液经化验呈碱性,主要的有毒离子为Ba2+。如将甲、乙两废液按一定比例混合,毒性明显降低。乙废液中可能含有的离子是( )
A.Cu2+和SO42- B. Cu2+和Cl- C.K+和SO42- D.Ag+和NO3-
A
4.某同学为检验溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作,其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得到的正确结论是( )。
A.原溶液中一定含有SO42-
B.原溶液中一定含有NH4+
C.原溶液中一定含有Cl-
D.原溶液中一定含有Fe3+
B
5、某强酸性溶液X中可能含有Fe2+、Al3+、NH4+、CO32-、SO32-、SO42- 、Cl-中的若干种,现取X溶液进行连续实验,实验过程及产物如下:
B
6、25 ℃时,将pH均为2的盐酸与HX溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。下列说法不正确的是( )
A.a、b两点:c平(X-)>c平(Cl-)
B.溶液的导电性:a>b
C.稀释前,c平(HX)>0.01 mol·L-1
D.溶液体积稀释到原来的10倍,HX溶
液的pH<3
B
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
