陕西省安康市2024-2025学年高一下学期期末联考化学试卷(含解析)
文档属性
| 名称 | 陕西省安康市2024-2025学年高一下学期期末联考化学试卷(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-09 00:34:40 | ||
图片预览




文档简介
安康市2024—2025学年第二学期高一期末联考化学试题
本试卷共8页,18题。全卷满分100分。考试用时75分钟。
可能用到的相对原子质量:H 1 Li 7 C 12 N 14 O 16 S 32 Cl 35.5
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.下列过程中涉及化学能转化为电能的是
A.使用燃料电池驱动新能源汽车 B.晶体硅太阳能电池提供“绿电” C.天然气作为家用燃气蒸煮食品 D.用电烤箱烘焙面包
2.糖类、油脂、蛋白质是重要的营养物质。下列说法错误的是
A.油脂属于酯类物质 B.醋酸铅溶液可使蛋白质变性
C.纤维素和淀粉互为同分异构体 D.多糖、油脂、蛋白质均可水解
3.下列事实能说明的氧化性比S的氧化性强的是
A.通常情况下硫为淡黄色固体,而氯气为黄绿色气体
B.硫难溶于水,而氯气能溶于水
C.与金属反应时,硫被还原为-2价而氯被还原为-1价
D.与同一种变价金属(如Fe)反应时,金属被硫氧化成低价态,被氯气氧化成高价态
4.设为阿伏加德罗常数的值。下列说法错误的是
A.的NaCl溶液中,的数目为
B.1mol重水()与1mol水中含有质子的数目均为
C.若的值变为规定的两倍,则32g氧气的物质的量变为0.5mol
D.标准状况下,22.4L 中含有中子的数目为
5.下列物质间的转化关系中,能一步实现的是
A.
B.
C.
D.
6.用如图所示的装置(夹持装置已略去)进行的制备及收集实验。下列说法正确的是
A.装置甲中制备利用了的分解反应
B.装置乙中的集气瓶内a导管长、b导管短
C.装置丙能防止倒吸
D.向收集好的中通入少量,不能观察到白烟
7.N、As元素位于元素周期表同一主族。下列说法错误的是
A.原子半径: B.非金属性:
C.热稳定性: D.酸性:
8.下列说法正确的是
A.物质中化学键的键能越大,其能量就一定越高
B.的反应热可以直接测定,同理,的反应热也可以直接测定
C.HCl和NaOH发生中和反应的反应热,则稀溶液中和反应的反应热
D.若,则的燃烧热
9.有些专家提出硅是“21世纪的能源”。下列说法错误的是
A.可溶于强碱溶液,也可溶于HF的水溶液
B.常温下Si的化学性质稳定,但在自然界中硅以化合态存在
C.水玻璃长期露置在空气中会变浑浊
D.在反应中,Si为氧化剂,为氧化产物
10.A、B、C均为短周期元素,在元素周期表中所处的位置如图所示。A、C两元素原子的核外电子数之和等于B原子的质子数。下列说法正确的是
A.简单离子半径:
B.A元素的原子序数为7
C.B元素在元素周期表中的位置是第二周期第ⅥA族
D.C元素的最高正价为+7,最低负价为-1
11.计算机模拟催化剂表面水煤气产氢反应[],反应过程与能量变化如图所示,初始时反应物均为气体,忽略催化剂吸附时的能量变化。下列说法错误的是
A.过程Ⅰ、Ⅱ均表示断键的吸收能量过程
B.由图可知,比CO稳定
C.过程Ⅲ既有共价键断裂,又有共价键形成
D.该反应为放热反应
12.元素的“价-类”二维图是我们学习元素及其化合物相关知识的重要模型和工具。铁元素的“价-类”二维图如图所示,其中箭头表示部分物质间的转化关系。下列说法错误的是
A.物质A在空气中受热可以转化为
B.可以与反应生成物质B
C.可能发生反应:
D.的俗称是铁红,可以用于外墙涂料
13.锂锰电池是最常见的一次性3V锂电池,电池的总反应为.工作原理如图所示。下列说法正确的是
A.电解质可用硫酸锂的水溶液代替
B.电路中转移0.1mol电子时,理论上b极质量增重0.7g
C.电池放电时,移向a极
D.a极发生还原反应,电极反应式为
14.某小组为了探究影响溶液与溶液在酸性条件下反应速率的因素,设计如表所示的实验方案。下列说法错误的是
实验序号 褪色时间t/min
1 3.0 2.0 1.0 0 2.0 8
2 3.0 2.0 2.0 0 a 6
3 4.0 2.0 2.0 0 0 4
4 3.0 2.0 1.0 0.5 b 3
A.,
B.溶液的酸碱性会影响该反应的化学反应速率
C.该反应的离子方程式为
D.上表数据可证明对该反应有催化作用
二、非选择题:本题包括4小题,共58分。
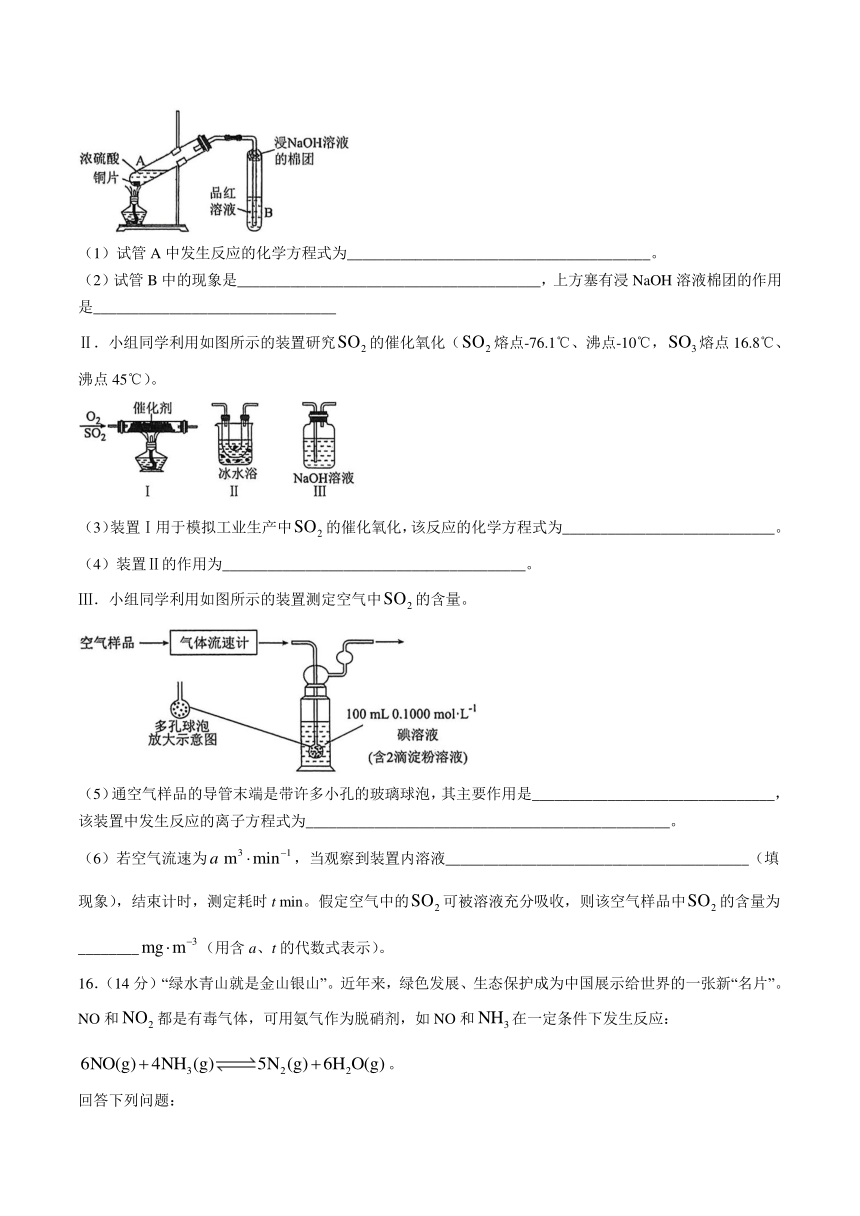
15.(15分)是硫元素的一种重要化合物,在生产生活中有重要用途。
回答下列问题:
Ⅰ.小组同学利用如图所示的装置制备并验证其性质。
(1)试管A中发生反应的化学方程式为________________________________________。
(2)试管B中的现象是________________________________________,上方塞有浸NaOH溶液棉团的作用是________________________________
Ⅱ.小组同学利用如图所示的装置研究的催化氧化(熔点-76.1℃、沸点-10℃,熔点16.8℃、沸点45℃)。
(3)装置Ⅰ用于模拟工业生产中的催化氧化,该反应的化学方程式为____________________________。
(4)装置Ⅱ的作用为________________________________________。
Ⅲ.小组同学利用如图所示的装置测定空气中的含量。
(5)通空气样品的导管末端是带许多小孔的玻璃球泡,其主要作用是________________________________,该装置中发生反应的离子方程式为________________________________________________。
(6)若空气流速为,当观察到装置内溶液________________________________________(填现象),结束计时,测定耗时t min。假定空气中的可被溶液充分吸收,则该空气样品中的含量为________(用含a、t的代数式表示)。
16.(14分)“绿水青山就是金山银山”。近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。NO和都是有毒气体,可用氨气作为脱硝剂,如NO和在一定条件下发生反应:。
回答下列问题:
(1)在恒温恒容的条件下,下列事实能说明上述反应已达到平衡状态的是________(填选项字母)。
a.
b.容器内压强不再随时间的变化而变化
c.容器内的物质的量分数不再随时间的变化而变化
d.容器内
e.有12mol N—H键断裂的同时生成5mol
f.混合气体的密度不随时间的变化而变化
(2)利用的原理,设计原电池如图所示,除掉NO的同时还可以提供电能。
M电极为________________极,N电极上发生的电极反应为________________________。
(3)已知断开1mol H—H键、1mol 键、1mol N—H键需要的能量依次为436kJ、946kJ、391kJ,则氮气与氢气合成氨气的热化学方程式为________________________________________。
(4)一定条件下,在2L的恒容密闭容器中发生反应,该反应中随时间的变化如表所示:
时间/s 0 1 2 3 4 5
0.040 0.0140 0.008 0.005 0.005 0.005
①用的浓度变化表示0~2s内该反应的平均速率________________;在第5s时,的转化率为________________(转化率指某一反应物转化量占其初始量的百分比)。
②由上表可以看出,随着反应的进行,反应速率逐渐减小,其原因是________________________________________________________________________________。
17.(14分)海洋是一个远未完全开发的巨大化学资源宝库,从海水中可获得Mg、Cl、Br、I等重要资源。
回答下列问题:
(1)实验室模拟蒸馏法淡化海水的实验装置如图所示,其中碎瓷片的作用是________;若实验中发现忘加碎瓷片,操作为________________________________________;冷凝管的进水口为________(填“a”或“b”)。
(2)从海水制得的粗盐中含有较多的、、等,要除去这些离子,下列加入药品顺序正确的是________________(填选项字母)。
A.NaOH溶液→溶液→溶液
B.溶液→NaOH溶液→溶液
C.NaOH溶液→溶液→溶液
D.溶液→NaOH溶液→溶液
(3)结合如表所示的数据分析,说明冶炼镁时选择氯化镁,而冶炼铝时却选择氧化铝的原因:________________________________________________________________________________
物质 MgO
熔点 2852 2054 714 190
(4)镁和卤素单质()反应的相对能量变化如图所示:
①所得生成物的稳定性由大到小的顺序为________________________。
②
(5)已知某溶液中、、的物质的量之比为,现欲使溶液中的、、的物质的量之比为变为,设、、均不与水反应,那么通入的物质的量是原溶液中的物质的量的________________。
18.(15分)乙烯是重要化工原料。由乙烯合成不同化学产品的路线如图所示:
回答下列问题:
(1)B的官能团名称为________________________。
(2)反应④的化学方程式为________________________________________________
(3)F是一种高分子物质,可用于制作食品塑料袋等,F的结构简式为____________。
(4)E的分子式是,能使紫色石蕊试液变红;G是一种油状有香味的物质,实验室用D和E通过反应⑥制取G,实验装置如图所示,部分条件省略。
①试管甲中反应的化学方程式为________________________________________________________,反应类型为________________;分离出试管乙中油状液体用到的主要仪器为________________________。
②下列说法正确的是________________________(填选项字母)。
A.实验开始时,先在试管内添加浓硫酸再缓慢加入D和E
B.该实验中浓硫酸只起催化剂作用
C.饱和碳酸钠溶液可以除去G的杂质,也可以降低G在水中的溶解度
D.等物质的量的D和乙烯完全燃烧耗氧量相同
③用4.6g D和3.0g E在催化剂条件下发生上述反应,充分反应后,若实际产率为60%,则实际得到G的质量为________________________g(已知:实际产率)。
(5)X是乙烯的同系物,其相对分子质量比乙烯大42,分子中含有3个的X的结构简式为_____________________,其中共平面的碳原子最多有_____________个。
化学参考答案及解析
一、选择题
1.A 【解析】使用燃料电池驱动新能源汽车,化学能转化为电能,电能再转化为机械能,A项符合题意;晶体硅太阳能电池提供“绿电”,属于太阳能转化为电能。B项不符合题意;天然气作为家用燃气蒸煮食品,属于化学能转化为热能,C项不符合题意;用电烤箱烘烙面包,属于电能转化为热能,D项不符合题意。
2.C 【解析】油脂的官能团为酯基,属于酯类物质,A项正确;醋酸铅为重金属盐,能使蛋白质变性,B项正确;纤维素和淀粉的相对分子质量不同,不是同分异构体,C项错误;多糖可水解为二糖和单糖,油脂中含酯基,可以水解,蛋白质中含肽键,可以水解,D项正确。
3.D 【解析】物质的颜色为物理性质,与化学性质无关,不能用来比较氧化性强弱,A项不符合题意;物质的溶解性与氧化性无关,B项不符合题意;与金属反应时,非金属元素的最低负价取决于最外层电子数目的多少,与氧化性强弱无关,C项不符合题意;与同一种金属反应时,金属被硫氧化成低价态,被氯气氧化成高价态,说明Cl得电子能力较强,氯气的氧化性强,D项符合题意。
4.A 【解析】题目未给溶液体积,无法计算离子数目,A项错误;1个重水分子和1个水分子中都含有10个质子,则1mol重水与1mol水中含有质子的数目均为,B项正确;若的值变为规定的两倍,则1mol氧气分子的质量为64g,即摩尔质量为,32g氧气的物质的量变为,C项正确;1个分子的中子数为,则标准状况下22.4L的中含有中子的数目为,D项正确。
5.D 【解析】二氧化硫和水反应生成亚硫酸,不能一步实现,A项不符合题意;次氯酸在光照条件下生成盐酸和氧气,不能一步实现,B项不符合题意;铁和盐酸反应生成氧化亚铁和氢气,溶液不能一步实现,C项不符合题意;钠和氧气加热生成过氧化钠,过氧化钠和二氧化碳反应生成碳酸钠和氧气,各转化均能一步实现,D项符合题意。
6.A 【解析】碱石灰溶于水放热可使氨水中的氨气逸出,则装置甲中制备利用了的分解反应,A项正确;用向下排空气法收集氨气,装置乙中的集气瓶内a导管短、b导管长,B项错误;氨气极易溶于水,装置丙中导气管直接伸入水中,不能防止倒吸,C项错误;向收集好的中通入少量,发生反应:,能观察到白烟,D项错误。
7.B 【解析】同主族元素从上到下原子半径逐渐增大,则原子半径:,A项正确;同主族元素从上到下非金属性逐渐减弱,则非金属性:,B项错误;元素的非金属性越强,简单气态氢化物的热稳定性越强,则热稳定性:,C项正确;元素的非金属性越强,最高价氧化物对应水化物的酸性越强,非金属性:,则酸性:,D项正确。
8.D 【解析】物质中化学键的键能越大,分子越稳定,能量越低,A项错误;的反应热无法直接测定,B项错误;生成水的同时又生成微溶于水的,故,C项错误;的燃烧热为1mol 完全燃烧生成二氧化碳和液态水放出的热量,D项正确。
9.D 【解析】可溶于强碱溶液,也可溶于HF溶液,A项正确;硅的化学性质不活泼,但硅属于亲氧元素,在自然界中以化合态存在,广泛存在于矿物和岩石中,不能以游离态存在,B项正确;水玻璃长期露置在空气中会和空气中的二氧化碳反应生成硅酸沉淀,溶液变浑浊,C项正确;硅由0价变为+4价,是还原剂,氢被还原成,是还原产物,D项错误。
10.B 【解析】A、B、C均为短周期元素,由图可知,A、C位于第二周期,B位于第三周期,第二,三周期上下相邻元素的原子序数相差8,结合A,C两元素的原子核外电子数之和等于B原子的质子数,可得B是16号硫,则A、C分别是氮、氟。离子结构相同时,核电荷数小的元素离子半径大,则半径:,A项错误;A为N元素,原子序数为7,B项正确;B为S元素,在元素周期表中的位置是第三周期第ⅥA族,C项错误;氟元素在化合物中只有-1价,D项错误。
11.B 【解析】根据图示,过程Ⅰ、Ⅱ均为O—H键断裂过程,故均需要吸收能量。A项正确;根据图示数据。不能判断、CO稳定性强弱,B项错误;过程Ⅲ中既有O—H键断裂,又有键、O—H键、H—H键形成,C项正确;生成物总能量低于反应物总能量,则总反应为放热反应,D项正确。
12.B 【解析】物质A是FeO,在空气中受热可以转化为,A项正确;不与反应,B项错误;可能是发生铝热反应:,C项正确;的俗称是铁红。C是红棕色固体,可以用作外墙涂料,D项正确。
13.B 【解析】金属锂会和水发生反应生成氢氧化锂和氢气,所以电解质不能用硫酸锂的水溶液代替,A项错误;由总反应和电子移动方向可知,a极为电池的负极,锂在负极失去电子发生氧化反应生成锂离子,电极反应式为,b极为正极,锂离子作用下二氧化锰在正极得到电子发生还原反应生成,电极反应式为,则电路中转移0.1mol电子时,b极质量增重,B项正确,D项错误;电池放电时,阳离子向正极b极移动,C项错误。
14.C 【解析】探究实验方案两两之间应保持单一变量,则四组实验的溶液总体积相等,利用混合溶液褪色时间判断变量对反应速率的影响,则,,A项正确;由实验1,2可知,变量是混合后硫酸的浓度,褪色时间不一致,即反应速率不一致,故酸的浓度(溶液的酸性)会影响该反应的化学反应速率,B项正确;是弱酸的酸式酸根离子,不能拆写,该反应的离子方程式为,C项错误;由实验1、4可知,溶液是该反应的催化剂,由于原溶液含有,则是该反应的催化剂,D项正确。
二、非选择题
15.(15分)Ⅰ.(2分)
(2)品红溶液褪色(1分) 吸收多余的,防止污染空气(1分)
Ⅱ.(3)(2分)
(4)使冷凝为固体与分离(2分)
Ⅲ.(5)增大与碘溶液的接触面积,使被充分吸收(2分) (2分)
(6)蓝色恰好褪去(1分) (2分)
【解析】Ⅰ.(1)铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫和水,化学方程式为.
(2)具有漂白性,能使品红溶液褪色,所以试管B中的现象是品红溶液褪色;是有毒气体,浸NaOH溶液的棉团可吸收多余的,防止污染空气。
Ⅱ.(3)装置Ⅰ模拟工业生产中的催化氧化,与在催化剂、加热条件下反应生成,化学方程式为。
(4)由、的熔、沸点可知,装置Ⅱ中冰水浴可使冷凝为固体与分离。
Ⅲ.(5)通空气样品的导管末端有带许多小孔的玻璃球泡,其可增大与碘溶液的接触面积,使被充分吸收;该装置中与、反应生成和HI,离子方程式为。
(6)若空气流速为,当观察到装置内容液蓝色恰好褪去,说明将碘完全反应,结束计时,通入空气t min时,空气体积,参与反应的二氧化硫和碘单质的物质的量相等,均为,则该空气样品中的含量。
16.(14分)(1)bc(2分)
(2)负(1分) (2分)
(3)(3分)
(4)①(2分) 87.5%(2分)
②随着反应进行,反应物浓度逐渐减小(2分)
【解析】(1)时不能判断正、逆反应进行方向,无法判断反应是否达到平衡状态,a项不符合题意;该反应前后化学计量数不等,容器内压强不再随时间的变化而变化时,反应达到平衡状态,b项符合题意;容器内的物质的量分数不再随时间的变化而变化时,说明其浓度不变,反应达到平衡状态,c项符合题意;容器内各物质的物质的量之比等于化学计量数之比时,不能判断反应达到平衡状态,d项不符合题意;断裂12mol N—H键的同时生成5mol 键,均表示正反应速率,不能判断反应达到平衡状态,e项不符合题意;混合气体的密度为定值,密度不随时间的变化而变化,不能判断反应达到平衡状态,f项不符合题意。
(2)M电极氨气转化为氮气,氮元素化合价升高,失去电子,为负极,N电极NO转化为氮气,化合价降低,得到电子,为正极,N电极上发生的电极反应为。
(3)氮气和氢气反应生成氨气的反应为可逆反应,计算可得,热化学方程式为。
(4)①用的浓度变化表示0~2s内该反应的平均速率:;在第5s时,的转化率为。
②由表可知,随着反应的进行,反应物浓度逐渐减小,反应速率逐渐减小。
17.(14分)(1)防止液体暴沸(1分) 立即停止加热,待液体冷却后打开瓶塞,加入碎瓷片后再加热(2分,答案合理即可) a(1分)
(2)BC(2分)
(3)氧化镁熔点比氯化镁熔点高,为减少成本,一般用熔融氯化镁冶炼镁;氯化铝是共价化合物,熔融状态下不导电,所以冶炼铝用熔融氧化铝(2分,答案合理即可)
(4)①(2分) ②-117(2分) (5)(2分)
【解析】(1)实验室制取蒸馏水时,在烧瓶中加入沸石的目的是防止液体暴沸;若实验中发现忘记加碎瓷片,应立即停止加热,待液体冷却后打开瓶塞,加入碎瓷片后再加热;冷凝管中应“下进上出”,则进水口为a。
(2)要除去、、,则用氢氧化钠溶液除去镁离子、用氯化钡溶液除去硫酸根离子,用碳酸钠溶液除去钙离子和剩余的钡离子,要先除硫酸根,然后再除钙离子,如果加反了,过量的钡离子就无法除去,加入氢氧化钠溶液的顺序可不受限制,因为过量的氢氧化钠加盐酸可除去,所以A、D项中剩余的氯化钡无法除去,故选BC项。
(3)氧化镁熔点比氯化镁熔点高,为减少成本,一般用熔融氯化镁冶炼镁;氯化铝是共价化合物,熔融状态下不导电,所以冶炼铝用熔融氧化铝。
(4)①物质的能量越低越稳定,根据图像数据分析,化合物的稳定性由强到弱的顺序为。
②Ⅰ.,Ⅱ.,由Ⅰ—Ⅱ得。
(5)已知还原性:,反应后有剩余。说明没有消耗,通入的只与发生反应,设原溶液中含有2mol ,3mol 、4mol ,通入后它们的物质的量之比变为,则各离子的物质的量分别为4mol 、3mol 、2mol ,增加了2mol,则需1mol ,通入的物质的量是原溶液中物质的量的。
18.(15分)(1)羟基(1分)
(2)(2分)
(3)(1分)
(4)①(2分) 酯化反应或取代反应(1分) 分液漏斗(1分,答案合理即可)
②CD(2分) ③2.64(2分)
(5)(2分) 5(1分)
【解析】(1)B是乙二醇,其官能团是羟基(—OH)。
(2)反应④为乙醇的催化氧化反应,其化学方程式为。
(3)F是一种高分子物质,可用于制作食品塑料袋等,即F为聚乙烯,结构简式为。
(4)①试管甲中发生制备乙酸乙酯的反应,其化学方程式为,该反应属于酯化反应,也属于取代反应:分离两种互不相溶的液体,常用分液的方法,主要仪器是分液漏斗。
②实验开始时,先在试管内添加乙醇,再缓慢加入浓硫酸,最后加乙酸,防止浓硫酸在稀释过程中放出大量热导致液体飞溅造成事故,A项错误;该实验中浓硫酸起催化剂、吸水剂的作用,B项错误;饱和碳酸钠溶液可以溶解乙醇、中和乙酸、降低乙酸乙酯在水中的溶解度,C项正确;等物质的量的乙醇()和乙烯()完全燃烧耗氧量相同,D项正确。
③4.6g 的物质的量是0.1mol,3.0g 的物质的量是0.05mol,则理论上生成的物质的量为0.05mol,由于实际产率为60%,则实际得到乙酸乙酯的质量为。
(5)X是乙烯的同系物,其相对分子质量比乙烯大42,则X的分子式是,含3个的X结构简式为,其中共平面的碳原子最多有5个。
本试卷共8页,18题。全卷满分100分。考试用时75分钟。
可能用到的相对原子质量:H 1 Li 7 C 12 N 14 O 16 S 32 Cl 35.5
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.下列过程中涉及化学能转化为电能的是
A.使用燃料电池驱动新能源汽车 B.晶体硅太阳能电池提供“绿电” C.天然气作为家用燃气蒸煮食品 D.用电烤箱烘焙面包
2.糖类、油脂、蛋白质是重要的营养物质。下列说法错误的是
A.油脂属于酯类物质 B.醋酸铅溶液可使蛋白质变性
C.纤维素和淀粉互为同分异构体 D.多糖、油脂、蛋白质均可水解
3.下列事实能说明的氧化性比S的氧化性强的是
A.通常情况下硫为淡黄色固体,而氯气为黄绿色气体
B.硫难溶于水,而氯气能溶于水
C.与金属反应时,硫被还原为-2价而氯被还原为-1价
D.与同一种变价金属(如Fe)反应时,金属被硫氧化成低价态,被氯气氧化成高价态
4.设为阿伏加德罗常数的值。下列说法错误的是
A.的NaCl溶液中,的数目为
B.1mol重水()与1mol水中含有质子的数目均为
C.若的值变为规定的两倍,则32g氧气的物质的量变为0.5mol
D.标准状况下,22.4L 中含有中子的数目为
5.下列物质间的转化关系中,能一步实现的是
A.
B.
C.
D.
6.用如图所示的装置(夹持装置已略去)进行的制备及收集实验。下列说法正确的是
A.装置甲中制备利用了的分解反应
B.装置乙中的集气瓶内a导管长、b导管短
C.装置丙能防止倒吸
D.向收集好的中通入少量,不能观察到白烟
7.N、As元素位于元素周期表同一主族。下列说法错误的是
A.原子半径: B.非金属性:
C.热稳定性: D.酸性:
8.下列说法正确的是
A.物质中化学键的键能越大,其能量就一定越高
B.的反应热可以直接测定,同理,的反应热也可以直接测定
C.HCl和NaOH发生中和反应的反应热,则稀溶液中和反应的反应热
D.若,则的燃烧热
9.有些专家提出硅是“21世纪的能源”。下列说法错误的是
A.可溶于强碱溶液,也可溶于HF的水溶液
B.常温下Si的化学性质稳定,但在自然界中硅以化合态存在
C.水玻璃长期露置在空气中会变浑浊
D.在反应中,Si为氧化剂,为氧化产物
10.A、B、C均为短周期元素,在元素周期表中所处的位置如图所示。A、C两元素原子的核外电子数之和等于B原子的质子数。下列说法正确的是
A.简单离子半径:
B.A元素的原子序数为7
C.B元素在元素周期表中的位置是第二周期第ⅥA族
D.C元素的最高正价为+7,最低负价为-1
11.计算机模拟催化剂表面水煤气产氢反应[],反应过程与能量变化如图所示,初始时反应物均为气体,忽略催化剂吸附时的能量变化。下列说法错误的是
A.过程Ⅰ、Ⅱ均表示断键的吸收能量过程
B.由图可知,比CO稳定
C.过程Ⅲ既有共价键断裂,又有共价键形成
D.该反应为放热反应
12.元素的“价-类”二维图是我们学习元素及其化合物相关知识的重要模型和工具。铁元素的“价-类”二维图如图所示,其中箭头表示部分物质间的转化关系。下列说法错误的是
A.物质A在空气中受热可以转化为
B.可以与反应生成物质B
C.可能发生反应:
D.的俗称是铁红,可以用于外墙涂料
13.锂锰电池是最常见的一次性3V锂电池,电池的总反应为.工作原理如图所示。下列说法正确的是
A.电解质可用硫酸锂的水溶液代替
B.电路中转移0.1mol电子时,理论上b极质量增重0.7g
C.电池放电时,移向a极
D.a极发生还原反应,电极反应式为
14.某小组为了探究影响溶液与溶液在酸性条件下反应速率的因素,设计如表所示的实验方案。下列说法错误的是
实验序号 褪色时间t/min
1 3.0 2.0 1.0 0 2.0 8
2 3.0 2.0 2.0 0 a 6
3 4.0 2.0 2.0 0 0 4
4 3.0 2.0 1.0 0.5 b 3
A.,
B.溶液的酸碱性会影响该反应的化学反应速率
C.该反应的离子方程式为
D.上表数据可证明对该反应有催化作用
二、非选择题:本题包括4小题,共58分。
15.(15分)是硫元素的一种重要化合物,在生产生活中有重要用途。
回答下列问题:
Ⅰ.小组同学利用如图所示的装置制备并验证其性质。
(1)试管A中发生反应的化学方程式为________________________________________。
(2)试管B中的现象是________________________________________,上方塞有浸NaOH溶液棉团的作用是________________________________
Ⅱ.小组同学利用如图所示的装置研究的催化氧化(熔点-76.1℃、沸点-10℃,熔点16.8℃、沸点45℃)。
(3)装置Ⅰ用于模拟工业生产中的催化氧化,该反应的化学方程式为____________________________。
(4)装置Ⅱ的作用为________________________________________。
Ⅲ.小组同学利用如图所示的装置测定空气中的含量。
(5)通空气样品的导管末端是带许多小孔的玻璃球泡,其主要作用是________________________________,该装置中发生反应的离子方程式为________________________________________________。
(6)若空气流速为,当观察到装置内溶液________________________________________(填现象),结束计时,测定耗时t min。假定空气中的可被溶液充分吸收,则该空气样品中的含量为________(用含a、t的代数式表示)。
16.(14分)“绿水青山就是金山银山”。近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。NO和都是有毒气体,可用氨气作为脱硝剂,如NO和在一定条件下发生反应:。
回答下列问题:
(1)在恒温恒容的条件下,下列事实能说明上述反应已达到平衡状态的是________(填选项字母)。
a.
b.容器内压强不再随时间的变化而变化
c.容器内的物质的量分数不再随时间的变化而变化
d.容器内
e.有12mol N—H键断裂的同时生成5mol
f.混合气体的密度不随时间的变化而变化
(2)利用的原理,设计原电池如图所示,除掉NO的同时还可以提供电能。
M电极为________________极,N电极上发生的电极反应为________________________。
(3)已知断开1mol H—H键、1mol 键、1mol N—H键需要的能量依次为436kJ、946kJ、391kJ,则氮气与氢气合成氨气的热化学方程式为________________________________________。
(4)一定条件下,在2L的恒容密闭容器中发生反应,该反应中随时间的变化如表所示:
时间/s 0 1 2 3 4 5
0.040 0.0140 0.008 0.005 0.005 0.005
①用的浓度变化表示0~2s内该反应的平均速率________________;在第5s时,的转化率为________________(转化率指某一反应物转化量占其初始量的百分比)。
②由上表可以看出,随着反应的进行,反应速率逐渐减小,其原因是________________________________________________________________________________。
17.(14分)海洋是一个远未完全开发的巨大化学资源宝库,从海水中可获得Mg、Cl、Br、I等重要资源。
回答下列问题:
(1)实验室模拟蒸馏法淡化海水的实验装置如图所示,其中碎瓷片的作用是________;若实验中发现忘加碎瓷片,操作为________________________________________;冷凝管的进水口为________(填“a”或“b”)。
(2)从海水制得的粗盐中含有较多的、、等,要除去这些离子,下列加入药品顺序正确的是________________(填选项字母)。
A.NaOH溶液→溶液→溶液
B.溶液→NaOH溶液→溶液
C.NaOH溶液→溶液→溶液
D.溶液→NaOH溶液→溶液
(3)结合如表所示的数据分析,说明冶炼镁时选择氯化镁,而冶炼铝时却选择氧化铝的原因:________________________________________________________________________________
物质 MgO
熔点 2852 2054 714 190
(4)镁和卤素单质()反应的相对能量变化如图所示:
①所得生成物的稳定性由大到小的顺序为________________________。
②
(5)已知某溶液中、、的物质的量之比为,现欲使溶液中的、、的物质的量之比为变为,设、、均不与水反应,那么通入的物质的量是原溶液中的物质的量的________________。
18.(15分)乙烯是重要化工原料。由乙烯合成不同化学产品的路线如图所示:
回答下列问题:
(1)B的官能团名称为________________________。
(2)反应④的化学方程式为________________________________________________
(3)F是一种高分子物质,可用于制作食品塑料袋等,F的结构简式为____________。
(4)E的分子式是,能使紫色石蕊试液变红;G是一种油状有香味的物质,实验室用D和E通过反应⑥制取G,实验装置如图所示,部分条件省略。
①试管甲中反应的化学方程式为________________________________________________________,反应类型为________________;分离出试管乙中油状液体用到的主要仪器为________________________。
②下列说法正确的是________________________(填选项字母)。
A.实验开始时,先在试管内添加浓硫酸再缓慢加入D和E
B.该实验中浓硫酸只起催化剂作用
C.饱和碳酸钠溶液可以除去G的杂质,也可以降低G在水中的溶解度
D.等物质的量的D和乙烯完全燃烧耗氧量相同
③用4.6g D和3.0g E在催化剂条件下发生上述反应,充分反应后,若实际产率为60%,则实际得到G的质量为________________________g(已知:实际产率)。
(5)X是乙烯的同系物,其相对分子质量比乙烯大42,分子中含有3个的X的结构简式为_____________________,其中共平面的碳原子最多有_____________个。
化学参考答案及解析
一、选择题
1.A 【解析】使用燃料电池驱动新能源汽车,化学能转化为电能,电能再转化为机械能,A项符合题意;晶体硅太阳能电池提供“绿电”,属于太阳能转化为电能。B项不符合题意;天然气作为家用燃气蒸煮食品,属于化学能转化为热能,C项不符合题意;用电烤箱烘烙面包,属于电能转化为热能,D项不符合题意。
2.C 【解析】油脂的官能团为酯基,属于酯类物质,A项正确;醋酸铅为重金属盐,能使蛋白质变性,B项正确;纤维素和淀粉的相对分子质量不同,不是同分异构体,C项错误;多糖可水解为二糖和单糖,油脂中含酯基,可以水解,蛋白质中含肽键,可以水解,D项正确。
3.D 【解析】物质的颜色为物理性质,与化学性质无关,不能用来比较氧化性强弱,A项不符合题意;物质的溶解性与氧化性无关,B项不符合题意;与金属反应时,非金属元素的最低负价取决于最外层电子数目的多少,与氧化性强弱无关,C项不符合题意;与同一种金属反应时,金属被硫氧化成低价态,被氯气氧化成高价态,说明Cl得电子能力较强,氯气的氧化性强,D项符合题意。
4.A 【解析】题目未给溶液体积,无法计算离子数目,A项错误;1个重水分子和1个水分子中都含有10个质子,则1mol重水与1mol水中含有质子的数目均为,B项正确;若的值变为规定的两倍,则1mol氧气分子的质量为64g,即摩尔质量为,32g氧气的物质的量变为,C项正确;1个分子的中子数为,则标准状况下22.4L的中含有中子的数目为,D项正确。
5.D 【解析】二氧化硫和水反应生成亚硫酸,不能一步实现,A项不符合题意;次氯酸在光照条件下生成盐酸和氧气,不能一步实现,B项不符合题意;铁和盐酸反应生成氧化亚铁和氢气,溶液不能一步实现,C项不符合题意;钠和氧气加热生成过氧化钠,过氧化钠和二氧化碳反应生成碳酸钠和氧气,各转化均能一步实现,D项符合题意。
6.A 【解析】碱石灰溶于水放热可使氨水中的氨气逸出,则装置甲中制备利用了的分解反应,A项正确;用向下排空气法收集氨气,装置乙中的集气瓶内a导管短、b导管长,B项错误;氨气极易溶于水,装置丙中导气管直接伸入水中,不能防止倒吸,C项错误;向收集好的中通入少量,发生反应:,能观察到白烟,D项错误。
7.B 【解析】同主族元素从上到下原子半径逐渐增大,则原子半径:,A项正确;同主族元素从上到下非金属性逐渐减弱,则非金属性:,B项错误;元素的非金属性越强,简单气态氢化物的热稳定性越强,则热稳定性:,C项正确;元素的非金属性越强,最高价氧化物对应水化物的酸性越强,非金属性:,则酸性:,D项正确。
8.D 【解析】物质中化学键的键能越大,分子越稳定,能量越低,A项错误;的反应热无法直接测定,B项错误;生成水的同时又生成微溶于水的,故,C项错误;的燃烧热为1mol 完全燃烧生成二氧化碳和液态水放出的热量,D项正确。
9.D 【解析】可溶于强碱溶液,也可溶于HF溶液,A项正确;硅的化学性质不活泼,但硅属于亲氧元素,在自然界中以化合态存在,广泛存在于矿物和岩石中,不能以游离态存在,B项正确;水玻璃长期露置在空气中会和空气中的二氧化碳反应生成硅酸沉淀,溶液变浑浊,C项正确;硅由0价变为+4价,是还原剂,氢被还原成,是还原产物,D项错误。
10.B 【解析】A、B、C均为短周期元素,由图可知,A、C位于第二周期,B位于第三周期,第二,三周期上下相邻元素的原子序数相差8,结合A,C两元素的原子核外电子数之和等于B原子的质子数,可得B是16号硫,则A、C分别是氮、氟。离子结构相同时,核电荷数小的元素离子半径大,则半径:,A项错误;A为N元素,原子序数为7,B项正确;B为S元素,在元素周期表中的位置是第三周期第ⅥA族,C项错误;氟元素在化合物中只有-1价,D项错误。
11.B 【解析】根据图示,过程Ⅰ、Ⅱ均为O—H键断裂过程,故均需要吸收能量。A项正确;根据图示数据。不能判断、CO稳定性强弱,B项错误;过程Ⅲ中既有O—H键断裂,又有键、O—H键、H—H键形成,C项正确;生成物总能量低于反应物总能量,则总反应为放热反应,D项正确。
12.B 【解析】物质A是FeO,在空气中受热可以转化为,A项正确;不与反应,B项错误;可能是发生铝热反应:,C项正确;的俗称是铁红。C是红棕色固体,可以用作外墙涂料,D项正确。
13.B 【解析】金属锂会和水发生反应生成氢氧化锂和氢气,所以电解质不能用硫酸锂的水溶液代替,A项错误;由总反应和电子移动方向可知,a极为电池的负极,锂在负极失去电子发生氧化反应生成锂离子,电极反应式为,b极为正极,锂离子作用下二氧化锰在正极得到电子发生还原反应生成,电极反应式为,则电路中转移0.1mol电子时,b极质量增重,B项正确,D项错误;电池放电时,阳离子向正极b极移动,C项错误。
14.C 【解析】探究实验方案两两之间应保持单一变量,则四组实验的溶液总体积相等,利用混合溶液褪色时间判断变量对反应速率的影响,则,,A项正确;由实验1,2可知,变量是混合后硫酸的浓度,褪色时间不一致,即反应速率不一致,故酸的浓度(溶液的酸性)会影响该反应的化学反应速率,B项正确;是弱酸的酸式酸根离子,不能拆写,该反应的离子方程式为,C项错误;由实验1、4可知,溶液是该反应的催化剂,由于原溶液含有,则是该反应的催化剂,D项正确。
二、非选择题
15.(15分)Ⅰ.(2分)
(2)品红溶液褪色(1分) 吸收多余的,防止污染空气(1分)
Ⅱ.(3)(2分)
(4)使冷凝为固体与分离(2分)
Ⅲ.(5)增大与碘溶液的接触面积,使被充分吸收(2分) (2分)
(6)蓝色恰好褪去(1分) (2分)
【解析】Ⅰ.(1)铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫和水,化学方程式为.
(2)具有漂白性,能使品红溶液褪色,所以试管B中的现象是品红溶液褪色;是有毒气体,浸NaOH溶液的棉团可吸收多余的,防止污染空气。
Ⅱ.(3)装置Ⅰ模拟工业生产中的催化氧化,与在催化剂、加热条件下反应生成,化学方程式为。
(4)由、的熔、沸点可知,装置Ⅱ中冰水浴可使冷凝为固体与分离。
Ⅲ.(5)通空气样品的导管末端有带许多小孔的玻璃球泡,其可增大与碘溶液的接触面积,使被充分吸收;该装置中与、反应生成和HI,离子方程式为。
(6)若空气流速为,当观察到装置内容液蓝色恰好褪去,说明将碘完全反应,结束计时,通入空气t min时,空气体积,参与反应的二氧化硫和碘单质的物质的量相等,均为,则该空气样品中的含量。
16.(14分)(1)bc(2分)
(2)负(1分) (2分)
(3)(3分)
(4)①(2分) 87.5%(2分)
②随着反应进行,反应物浓度逐渐减小(2分)
【解析】(1)时不能判断正、逆反应进行方向,无法判断反应是否达到平衡状态,a项不符合题意;该反应前后化学计量数不等,容器内压强不再随时间的变化而变化时,反应达到平衡状态,b项符合题意;容器内的物质的量分数不再随时间的变化而变化时,说明其浓度不变,反应达到平衡状态,c项符合题意;容器内各物质的物质的量之比等于化学计量数之比时,不能判断反应达到平衡状态,d项不符合题意;断裂12mol N—H键的同时生成5mol 键,均表示正反应速率,不能判断反应达到平衡状态,e项不符合题意;混合气体的密度为定值,密度不随时间的变化而变化,不能判断反应达到平衡状态,f项不符合题意。
(2)M电极氨气转化为氮气,氮元素化合价升高,失去电子,为负极,N电极NO转化为氮气,化合价降低,得到电子,为正极,N电极上发生的电极反应为。
(3)氮气和氢气反应生成氨气的反应为可逆反应,计算可得,热化学方程式为。
(4)①用的浓度变化表示0~2s内该反应的平均速率:;在第5s时,的转化率为。
②由表可知,随着反应的进行,反应物浓度逐渐减小,反应速率逐渐减小。
17.(14分)(1)防止液体暴沸(1分) 立即停止加热,待液体冷却后打开瓶塞,加入碎瓷片后再加热(2分,答案合理即可) a(1分)
(2)BC(2分)
(3)氧化镁熔点比氯化镁熔点高,为减少成本,一般用熔融氯化镁冶炼镁;氯化铝是共价化合物,熔融状态下不导电,所以冶炼铝用熔融氧化铝(2分,答案合理即可)
(4)①(2分) ②-117(2分) (5)(2分)
【解析】(1)实验室制取蒸馏水时,在烧瓶中加入沸石的目的是防止液体暴沸;若实验中发现忘记加碎瓷片,应立即停止加热,待液体冷却后打开瓶塞,加入碎瓷片后再加热;冷凝管中应“下进上出”,则进水口为a。
(2)要除去、、,则用氢氧化钠溶液除去镁离子、用氯化钡溶液除去硫酸根离子,用碳酸钠溶液除去钙离子和剩余的钡离子,要先除硫酸根,然后再除钙离子,如果加反了,过量的钡离子就无法除去,加入氢氧化钠溶液的顺序可不受限制,因为过量的氢氧化钠加盐酸可除去,所以A、D项中剩余的氯化钡无法除去,故选BC项。
(3)氧化镁熔点比氯化镁熔点高,为减少成本,一般用熔融氯化镁冶炼镁;氯化铝是共价化合物,熔融状态下不导电,所以冶炼铝用熔融氧化铝。
(4)①物质的能量越低越稳定,根据图像数据分析,化合物的稳定性由强到弱的顺序为。
②Ⅰ.,Ⅱ.,由Ⅰ—Ⅱ得。
(5)已知还原性:,反应后有剩余。说明没有消耗,通入的只与发生反应,设原溶液中含有2mol ,3mol 、4mol ,通入后它们的物质的量之比变为,则各离子的物质的量分别为4mol 、3mol 、2mol ,增加了2mol,则需1mol ,通入的物质的量是原溶液中物质的量的。
18.(15分)(1)羟基(1分)
(2)(2分)
(3)(1分)
(4)①(2分) 酯化反应或取代反应(1分) 分液漏斗(1分,答案合理即可)
②CD(2分) ③2.64(2分)
(5)(2分) 5(1分)
【解析】(1)B是乙二醇,其官能团是羟基(—OH)。
(2)反应④为乙醇的催化氧化反应,其化学方程式为。
(3)F是一种高分子物质,可用于制作食品塑料袋等,即F为聚乙烯,结构简式为。
(4)①试管甲中发生制备乙酸乙酯的反应,其化学方程式为,该反应属于酯化反应,也属于取代反应:分离两种互不相溶的液体,常用分液的方法,主要仪器是分液漏斗。
②实验开始时,先在试管内添加乙醇,再缓慢加入浓硫酸,最后加乙酸,防止浓硫酸在稀释过程中放出大量热导致液体飞溅造成事故,A项错误;该实验中浓硫酸起催化剂、吸水剂的作用,B项错误;饱和碳酸钠溶液可以溶解乙醇、中和乙酸、降低乙酸乙酯在水中的溶解度,C项正确;等物质的量的乙醇()和乙烯()完全燃烧耗氧量相同,D项正确。
③4.6g 的物质的量是0.1mol,3.0g 的物质的量是0.05mol,则理论上生成的物质的量为0.05mol,由于实际产率为60%,则实际得到乙酸乙酯的质量为。
(5)X是乙烯的同系物,其相对分子质量比乙烯大42,则X的分子式是,含3个的X结构简式为,其中共平面的碳原子最多有5个。
同课章节目录
