内蒙古赤峰市2024-2025学年高一下学期期末联考化学试卷(含答案)
文档属性
| 名称 | 内蒙古赤峰市2024-2025学年高一下学期期末联考化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-09 00:36:41 | ||
图片预览



文档简介
内蒙古赤峰市2024-2025学年高一下学期期末联考化学试题
一、单选题
1.下列不属于天然有机高分子材料的是
A.棉花 B.羊毛 C.油脂 D.天然橡胶
2.中国是文明古国,传统文化富载化学知识。下列说法正确的是
A.潮州木雕历史悠久,制作木雕的材料主要成分是纤维素
B.指南针的发明可以追溯到战国时期,制造指南针的磁性物质是
C.贾湖遗址出土了大量炭化稻米,可利用测定炭化稻米年代
D.“釉里红梅瓶”为陶瓷制品,其主要成分是二氧化硅
3.下列化学用语表达正确的是
A.的电子式: B.的结构示图:
C.乙烯的结构简式: D.乙烷的空间填充模型:
4.图a~c分别为氯化钠在固体、熔融状态、溶于水三种状态下的导电实验(X、Y均表示石墨电极)的微观示意图。下列说法错误的是
A.图a中的黑球“”代表的离子是
B.图a表示的是干燥的NaCl固体不导电
C.由图b可知,NaCl在通电条件下才能发生电离
D.图c表示NaCl在水溶液中的导电情况,表示水合氯离子
5.下列离子方程式书写正确的是
A.溶液中通入:
B.氯气溶于水:
C.过氧化钠和水反应:
D.将Cu片放入稀中:
6.表示阿伏加德罗常数的值,下列说法正确的是
A.1mol甲基()含有的电子数为10
B.17.6g丙烷()含有的极性共价键的数目为4.8
C.标准状况下,2.24L 含有的氢原子数目为1.4
D.30g甲醛(HCHO)和乙酸()的混合物中,氧原子数目为
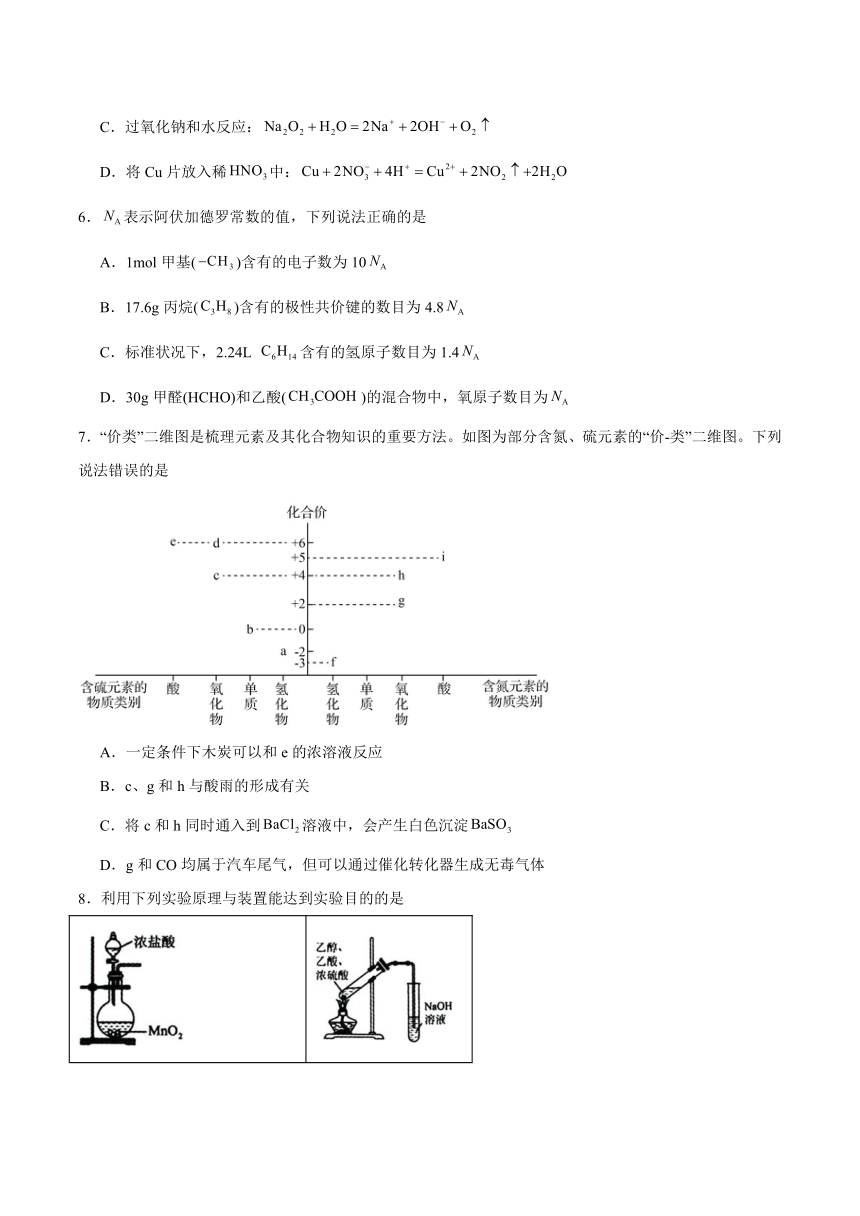
7.“价类”二维图是梳理元素及其化合物知识的重要方法。如图为部分含氮、硫元素的“价-类”二维图。下列说法错误的是
A.一定条件下木炭可以和e的浓溶液反应
B.c、g和h与酸雨的形成有关
C.将c和h同时通入到溶液中,会产生白色沉淀
D.g和CO均属于汽车尾气,但可以通过催化转化器生成无毒气体
8.利用下列实验原理与装置能达到实验目的的是
A.制备 B.制备乙酸乙酯
C.配制0.10 NaOH溶液 D.验证非金属性Cl>I
A.A B.B C.C D.D
9.反应A→C过程中能量变化曲线如图,下列叙述正确的是
A.A与C的能量差为
B.升高温度,使得A→B、B→C的反应速率都加快
C.两步反应均为吸热反应
D.A、B、C三种化合物中B能量最高,所以最稳定
10.阿司匹林是家庭常备药品,一种合成方法如图。下列说法正确的是
A.阿司匹林中有3种官能团 B.阿司匹林的分子式为
C.乙酸酐与乙酸互为同系物 D.水杨酸能发生加成、氧化、水解、酯化反应
11.某学生根据纸电池的结构示意图,制作了一个简易电池。下列说法正确的是
A.该电池加几滴水就可以激活
B.铜箔发生氧化反应
C.电子从Al箔经滤纸流向铜箔
D.负极电极反应式:
12.短周期主族元素W、X、Y的原子序数依次增大,X原子半径是短周期主族元素中最大的,Y的最外层电子数是次外层电子数的一半,由W、X、Y三种元素组成的化合物M的结构如图所示。下列叙述正确的是
A.X与W所形成的二元化合物溶于水时一定只破坏离子键
B.Y的最高价氧化物用于制造计算机芯片
C.简单离子半径大小:X>W
D.化合物M中所有W都满足8电子稳定结构
13.HI受热发生反应:2HI(g)H2(g)+I2(g)。一定温度时,向1L恒容密闭容器中充入1mol HI,体系中与反应时间t的关系如图所示。下列说法正确的是
A.20min时,HI的转化率为18%
B.120min时,
C.加入高效催化剂,达到平衡时t>120min
D.0~40min内,
14.根据实验操作、现象,能得出相应结论的是
操作 现象 结论
A 将稀硫酸加入到滴有KSCN溶液的Fe(NO3)2溶液中 溶液由浅绿色变为红色 稀硫酸将Fe2+氧化
B 将浓硫酸滴到蔗糖表面 固体变黑膨胀 浓硫酸只表现脱水性
C 某溶液中加盐酸,将产生的气体通入澄清石灰水中 澄清石灰水变浑浊 原溶液中一定存在
D 向盛有淀粉溶液的试管中加入适量稀硫酸,水浴加热。冷却至室温后加入NaOH溶液调至碱性,再加入新制,加热 试管中出现砖红色沉淀 淀粉发生了水解
A.A B.B C.C D.D
15.脱硝(除去和)是废水处理的重要环节,一种利用还原铁粉和微生物进行脱硝的过程如图所示。下列说法错误的是
A.反应②中是还原产物
B.反应①的离子方程式为
C.充足的氧气有利于废水脱硝
D.反应③中氧化产物与还原产物的质量比为1∶1
二、未知
16.金属钛用途广泛。一种从海水中提取Mg和,并联合使用金红石(主要成分)冶炼金属钛的工艺流程如下。
回答下列问题:
(1)加入试剂①后,能够分离得到沉淀的操作是 (填操作名称)。
(2)沉淀中混有少量,可选用试剂 (填字母)除去。
a.NaOH溶液 b.溶液 c.溶液
(3)试剂②为 。
(4)反应①除生成外还生成一种可燃性气体,该反应的化学方程式为 。
(5)反应②需要在稀有气体氛围中进行的原因是 。
(6)不同温度下,反应②中钛提取率随时间变化曲线如图,综合考虑成本和效益选择最适宜的温度和为 ℃、 min。
17.焦亚硫酸钠()是常用的食品抗氧化剂之一,可由脱水制得。实验室用下图装置制备。
已知:与反应生成沉淀,与盐酸反应生成。
C装置中发生如下反应:、。
(1)A中产生的化学方程式是 。
(2)B的作用之一是观察的生成速率。试剂X最好选择 (填字母)。
a.蒸馏水 b.饱和溶液 c.饱和溶液 d.饱和NaOH溶液
(3)D装置的作用是 、 。
(4)在保存过程中易变质生成。检验是否变质的实验步骤如下:
①取少量样品于试管中,加适量蒸馏水配成溶液;
②先加足量 (填试剂名称),再加溶液;
③若 (填实验现象),说明样品已变质。
(5)测定样品中的含量。取1.00g 样品溶于水配成500mL溶液,取25mL该溶液,与10mL 0.05碘水恰好完全反应。样品中的质量分数为 (已知,假设杂质不反应)。
18.能量、速率与限度是认识和研究化学反应的重要视角。请回答下列问题:
I.
(1)已知,断开1mol化学键吸收的能量数据如下:
化学键 H-H O=O H-O
断开1mol化学键吸收的能量/kJ 436 496 463
2mol (g)完全分解需 (填“放出”或“吸收”)能量 kJ。
(2)某课外小组自制的氢氧燃料电池如图所示,a、b均为惰性电极。
①a极是 (填“正”或“负”)极。
②b极的电极反应式是 。
II.某温度时,在一个2L的密闭容器中,A、B、C三种气体的浓度随时间的变化曲线如图所示:
(3)该反应的化学方程式为 。
(4)反应达平衡时体系的压强是开始时的 倍。
(5)下列叙述能说明该反应已达到化学平衡状态的是 (填字母)。
a.A、B、C的物质的量之比为3∶3∶1
b.相同时间内消耗3mol A,同时生成1mol C
c.相同时间内消耗3n mol A,同时消耗3n mol B
d.混合气体的总质量不随时间的变化而变化
e.B的体积分数不再发生变化
(6)下列措施能使该反应速率减小的是 (填字母)。
a.加催化剂 b.降低温度 c.体积不变,充入A d.体积不变,从容器中分离出A
19.A是一种重要的化工原料,对果实有催熟作用。与A有关的物质转化关系如图所示。请回答下列问题。
(1)丙烯酸中含氧官能团名称为 。
(2)反应①的反应类型为 。
(3)反应②的化学方程式为 。久置的丙烯酸乙酯自身会发生加聚反应,所得加聚物有良好的弹性,写出该加聚物的结构简式: 。
(4)写出所有含4个碳原子的D的同系物的结构简式: 、 。
(5)下列说法正确的是 (填字母)。
a.有机物C与丙烯酸互为同系物
b.有机物B能被酸性高锰酸钾还原成有机物C
c.1mol有机物C与足量溶液反应可产生22.4L气体(标准状况下)
d.相同物质的量的有机物A和B在足量的氧气中充分燃烧后,耗氧量相同
(6)若1mol有机物B和3mol 制得52.8g乙酸乙酯,乙酸乙酯的产率为 。
题号 1 2 3 4 5 6 7 8 9 10
答案 C A B C A D C D B B
题号 11 12 13 14 15
答案 A D D D C
16.(1)过滤
(2)C
(3)盐酸/HCl/氯化氢
(4)
(5)防止Mg、Ti被空气氧化
(6) 1000 30
17.(1)
(2)c
(3) 防倒吸 尾气处理,防止环境污染
(4) (稀)盐酸 产生白色沉淀
(5)95%
18.(1) 吸收 484
(2) 负
(3)
(4)
(5)ce
(6)bd
19.(1)羧基
(2)氧化反应
(3)
(4)
(5)cd
(6)60%
一、单选题
1.下列不属于天然有机高分子材料的是
A.棉花 B.羊毛 C.油脂 D.天然橡胶
2.中国是文明古国,传统文化富载化学知识。下列说法正确的是
A.潮州木雕历史悠久,制作木雕的材料主要成分是纤维素
B.指南针的发明可以追溯到战国时期,制造指南针的磁性物质是
C.贾湖遗址出土了大量炭化稻米,可利用测定炭化稻米年代
D.“釉里红梅瓶”为陶瓷制品,其主要成分是二氧化硅
3.下列化学用语表达正确的是
A.的电子式: B.的结构示图:
C.乙烯的结构简式: D.乙烷的空间填充模型:
4.图a~c分别为氯化钠在固体、熔融状态、溶于水三种状态下的导电实验(X、Y均表示石墨电极)的微观示意图。下列说法错误的是
A.图a中的黑球“”代表的离子是
B.图a表示的是干燥的NaCl固体不导电
C.由图b可知,NaCl在通电条件下才能发生电离
D.图c表示NaCl在水溶液中的导电情况,表示水合氯离子
5.下列离子方程式书写正确的是
A.溶液中通入:
B.氯气溶于水:
C.过氧化钠和水反应:
D.将Cu片放入稀中:
6.表示阿伏加德罗常数的值,下列说法正确的是
A.1mol甲基()含有的电子数为10
B.17.6g丙烷()含有的极性共价键的数目为4.8
C.标准状况下,2.24L 含有的氢原子数目为1.4
D.30g甲醛(HCHO)和乙酸()的混合物中,氧原子数目为
7.“价类”二维图是梳理元素及其化合物知识的重要方法。如图为部分含氮、硫元素的“价-类”二维图。下列说法错误的是
A.一定条件下木炭可以和e的浓溶液反应
B.c、g和h与酸雨的形成有关
C.将c和h同时通入到溶液中,会产生白色沉淀
D.g和CO均属于汽车尾气,但可以通过催化转化器生成无毒气体
8.利用下列实验原理与装置能达到实验目的的是
A.制备 B.制备乙酸乙酯
C.配制0.10 NaOH溶液 D.验证非金属性Cl>I
A.A B.B C.C D.D
9.反应A→C过程中能量变化曲线如图,下列叙述正确的是
A.A与C的能量差为
B.升高温度,使得A→B、B→C的反应速率都加快
C.两步反应均为吸热反应
D.A、B、C三种化合物中B能量最高,所以最稳定
10.阿司匹林是家庭常备药品,一种合成方法如图。下列说法正确的是
A.阿司匹林中有3种官能团 B.阿司匹林的分子式为
C.乙酸酐与乙酸互为同系物 D.水杨酸能发生加成、氧化、水解、酯化反应
11.某学生根据纸电池的结构示意图,制作了一个简易电池。下列说法正确的是
A.该电池加几滴水就可以激活
B.铜箔发生氧化反应
C.电子从Al箔经滤纸流向铜箔
D.负极电极反应式:
12.短周期主族元素W、X、Y的原子序数依次增大,X原子半径是短周期主族元素中最大的,Y的最外层电子数是次外层电子数的一半,由W、X、Y三种元素组成的化合物M的结构如图所示。下列叙述正确的是
A.X与W所形成的二元化合物溶于水时一定只破坏离子键
B.Y的最高价氧化物用于制造计算机芯片
C.简单离子半径大小:X>W
D.化合物M中所有W都满足8电子稳定结构
13.HI受热发生反应:2HI(g)H2(g)+I2(g)。一定温度时,向1L恒容密闭容器中充入1mol HI,体系中与反应时间t的关系如图所示。下列说法正确的是
A.20min时,HI的转化率为18%
B.120min时,
C.加入高效催化剂,达到平衡时t>120min
D.0~40min内,
14.根据实验操作、现象,能得出相应结论的是
操作 现象 结论
A 将稀硫酸加入到滴有KSCN溶液的Fe(NO3)2溶液中 溶液由浅绿色变为红色 稀硫酸将Fe2+氧化
B 将浓硫酸滴到蔗糖表面 固体变黑膨胀 浓硫酸只表现脱水性
C 某溶液中加盐酸,将产生的气体通入澄清石灰水中 澄清石灰水变浑浊 原溶液中一定存在
D 向盛有淀粉溶液的试管中加入适量稀硫酸,水浴加热。冷却至室温后加入NaOH溶液调至碱性,再加入新制,加热 试管中出现砖红色沉淀 淀粉发生了水解
A.A B.B C.C D.D
15.脱硝(除去和)是废水处理的重要环节,一种利用还原铁粉和微生物进行脱硝的过程如图所示。下列说法错误的是
A.反应②中是还原产物
B.反应①的离子方程式为
C.充足的氧气有利于废水脱硝
D.反应③中氧化产物与还原产物的质量比为1∶1
二、未知
16.金属钛用途广泛。一种从海水中提取Mg和,并联合使用金红石(主要成分)冶炼金属钛的工艺流程如下。
回答下列问题:
(1)加入试剂①后,能够分离得到沉淀的操作是 (填操作名称)。
(2)沉淀中混有少量,可选用试剂 (填字母)除去。
a.NaOH溶液 b.溶液 c.溶液
(3)试剂②为 。
(4)反应①除生成外还生成一种可燃性气体,该反应的化学方程式为 。
(5)反应②需要在稀有气体氛围中进行的原因是 。
(6)不同温度下,反应②中钛提取率随时间变化曲线如图,综合考虑成本和效益选择最适宜的温度和为 ℃、 min。
17.焦亚硫酸钠()是常用的食品抗氧化剂之一,可由脱水制得。实验室用下图装置制备。
已知:与反应生成沉淀,与盐酸反应生成。
C装置中发生如下反应:、。
(1)A中产生的化学方程式是 。
(2)B的作用之一是观察的生成速率。试剂X最好选择 (填字母)。
a.蒸馏水 b.饱和溶液 c.饱和溶液 d.饱和NaOH溶液
(3)D装置的作用是 、 。
(4)在保存过程中易变质生成。检验是否变质的实验步骤如下:
①取少量样品于试管中,加适量蒸馏水配成溶液;
②先加足量 (填试剂名称),再加溶液;
③若 (填实验现象),说明样品已变质。
(5)测定样品中的含量。取1.00g 样品溶于水配成500mL溶液,取25mL该溶液,与10mL 0.05碘水恰好完全反应。样品中的质量分数为 (已知,假设杂质不反应)。
18.能量、速率与限度是认识和研究化学反应的重要视角。请回答下列问题:
I.
(1)已知,断开1mol化学键吸收的能量数据如下:
化学键 H-H O=O H-O
断开1mol化学键吸收的能量/kJ 436 496 463
2mol (g)完全分解需 (填“放出”或“吸收”)能量 kJ。
(2)某课外小组自制的氢氧燃料电池如图所示,a、b均为惰性电极。
①a极是 (填“正”或“负”)极。
②b极的电极反应式是 。
II.某温度时,在一个2L的密闭容器中,A、B、C三种气体的浓度随时间的变化曲线如图所示:
(3)该反应的化学方程式为 。
(4)反应达平衡时体系的压强是开始时的 倍。
(5)下列叙述能说明该反应已达到化学平衡状态的是 (填字母)。
a.A、B、C的物质的量之比为3∶3∶1
b.相同时间内消耗3mol A,同时生成1mol C
c.相同时间内消耗3n mol A,同时消耗3n mol B
d.混合气体的总质量不随时间的变化而变化
e.B的体积分数不再发生变化
(6)下列措施能使该反应速率减小的是 (填字母)。
a.加催化剂 b.降低温度 c.体积不变,充入A d.体积不变,从容器中分离出A
19.A是一种重要的化工原料,对果实有催熟作用。与A有关的物质转化关系如图所示。请回答下列问题。
(1)丙烯酸中含氧官能团名称为 。
(2)反应①的反应类型为 。
(3)反应②的化学方程式为 。久置的丙烯酸乙酯自身会发生加聚反应,所得加聚物有良好的弹性,写出该加聚物的结构简式: 。
(4)写出所有含4个碳原子的D的同系物的结构简式: 、 。
(5)下列说法正确的是 (填字母)。
a.有机物C与丙烯酸互为同系物
b.有机物B能被酸性高锰酸钾还原成有机物C
c.1mol有机物C与足量溶液反应可产生22.4L气体(标准状况下)
d.相同物质的量的有机物A和B在足量的氧气中充分燃烧后,耗氧量相同
(6)若1mol有机物B和3mol 制得52.8g乙酸乙酯,乙酸乙酯的产率为 。
题号 1 2 3 4 5 6 7 8 9 10
答案 C A B C A D C D B B
题号 11 12 13 14 15
答案 A D D D C
16.(1)过滤
(2)C
(3)盐酸/HCl/氯化氢
(4)
(5)防止Mg、Ti被空气氧化
(6) 1000 30
17.(1)
(2)c
(3) 防倒吸 尾气处理,防止环境污染
(4) (稀)盐酸 产生白色沉淀
(5)95%
18.(1) 吸收 484
(2) 负
(3)
(4)
(5)ce
(6)bd
19.(1)羧基
(2)氧化反应
(3)
(4)
(5)cd
(6)60%
同课章节目录
