鲁科版高中化学选择性必修1第1章化学反应与能量转化1.3.1电解的原理教学课件(共21张PPT)
文档属性
| 名称 | 鲁科版高中化学选择性必修1第1章化学反应与能量转化1.3.1电解的原理教学课件(共21张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 393.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-09 00:00:00 | ||
图片预览






文档简介
(共21张PPT)
第3节 电能转化为化学能—电解
第1课时 电解的原理
第1章 化学反应与能量转化
学习目标
1、能通过对电解熔融氯化钠的探究,了解电解池的构成、工作原理。
2、能分析电解池的两极,能正确书写电极反应式、电解反应式。
3、通过对常见物质的电解产物的分析,归纳出电极放电顺序。
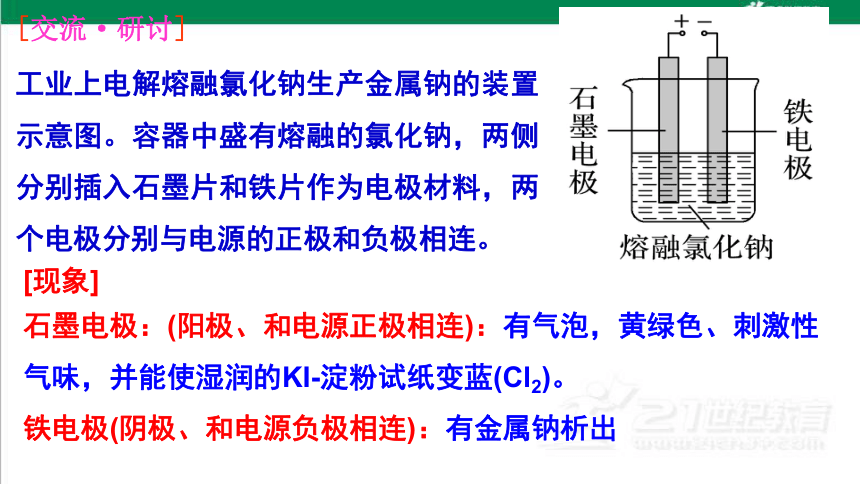
[交流·研讨]
工业上电解熔融氯化钠生产金属钠的装置示意图。容器中盛有熔融的氯化钠,两侧分别插入石墨片和铁片作为电极材料,两个电极分别与电源的正极和负极相连。
[现象]
石墨电极:(阳极、和电源正极相连):有气泡,黄绿色、刺激性气味,并能使湿润的KI-淀粉试纸变蓝(Cl2)。
铁电极(阴极、和电源负极相连):有金属钠析出
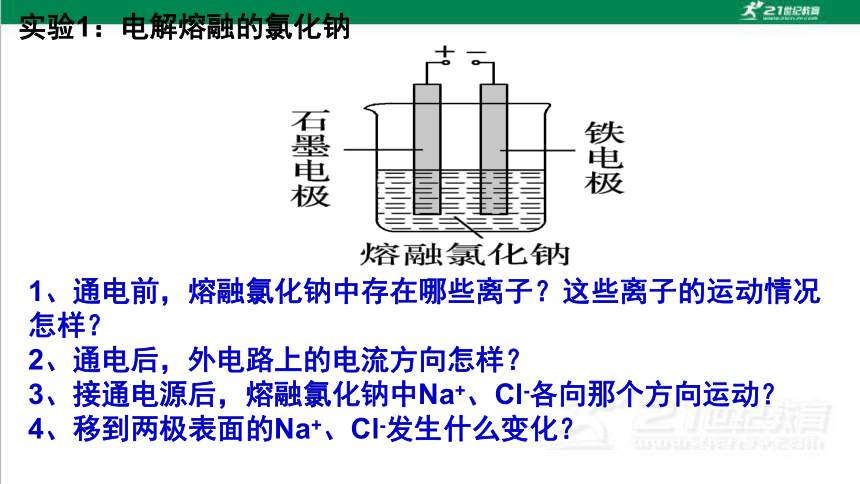
实验1:电解熔融的氯化钠
1、通电前,熔融氯化钠中存在哪些离子?这些离子的运动情况怎样?
2、通电后,外电路上的电流方向怎样?
3、接通电源后,熔融氯化钠中Na+、Cl-各向那个方向运动?
4、移到两极表面的Na+、Cl-发生什么变化?
通电前:分析熔融电解质中的离子情况
通电后:(必须通直流电)
Na+移向与电源负极相连的电极(Fe),得到电子变成Na,发生还原反应。 Na+ + e-=Na
Cl-移向与电源正极相连的电极(C),失去电子变成Cl,结合生成Cl2,发生氧化反应。 2Cl- - 2e-=Cl2↑
【实验分析】
做无规则运动
阳离子:Na+
阴离子:Cl-
2NaCl 2Na+Cl2↑
通电
总反应式:
一、电解原理
1、电解
使电流通过熔融的电解质或电解质溶液,在两个电极上分别发生氧化反应和还原反应的过程。
2、电解池
利用氧化还原反应,把电能转化为化学能的装置。
3、电解池构成条件
(1)外加直流电源
(2)与电源相连的两个电极
(3)电解质溶液或熔化的电解质
(4)用导线连接形成闭合回路
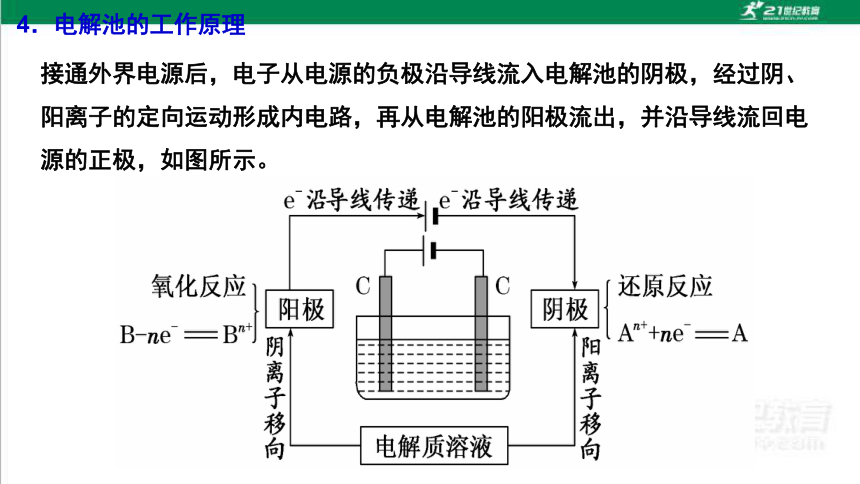
4.电解池的工作原理
接通外界电源后,电子从电源的负极沿导线流入电解池的阴极,经过阴、阳离子的定向运动形成内电路,再从电解池的阳极流出,并沿导线流回电源的正极,如图所示。
5、电解池的两极
⑴根据连接方式和电极反应性质
阳极:与电源正极相连,发生氧化反应
阴极:与电源负极相连,发生还原反应
⑵根据电极的活泼性
惰性电极:一般不参与电极反应(石墨、金、铂)
活性电极:除金、铂以外的金属作阳极时,发生氧化反应。
6、电极产物的判断,电极反应的书写
电极反应:电极上进行的半反应。
阳极:还原剂-ne- = 氧化产物 氧化反应
阴极:氧化剂+ne-=还原产物 还原反应
阳极:2Cl- - 2e-=Cl2↑ 氧化反应
阴极:2Na+ + 2e-=2Na 还原反应
2NaCl 2Na+Cl2↑
通电
总反应式:
注意:书写电极反应式一定要遵守电子守恒
示例:
电解熔融的氯化钠的电极反应和总反应
实验2:用惰性(石墨)电极电解氯化铜溶液
【实验分析】
通电前:分析氯化铜溶液中的离子情况
通电后:(必须通直流电)
分析:Cu2+ 、H+移向阴极,在阴极上 Cu2+得到电子变成Cu,发生还原反应。
Cl- 、OH-移向阳极, 在阳极上Cl-失去电子变成Cl,Cl结合成Cl2,发生氧化反应。
现象:左侧石墨电极(阴极)上有红色物质生成,
右侧石墨电极(阳极)上有黄绿色气体刺激性气味的生成,能使湿润的KI-淀粉试纸变蓝(Cl2)。
做无规则运动
阳离子:Cu2+ 、H+
阴离子:Cl- 、OH-
电解的电极反应式:
阳极:2Cl- -2e-=Cl2↑ 氧化反应
阴极:Cu2+ +2e-=Cu 还原反应
CuCl2 Cu+Cl2↑
通电
电解的总反应式:
2、如何才能正确判断出电解过程中阴阳两极的电极产物?
3、电解过程中,电解质溶液中阴、阳离子得、失电子能力的相对强弱顺序?
思考:
1、阅读课本栏目【交流·研讨】,并分析完成课本问题
7、离子的放电顺序
阳离子得电子顺序 ,
与金属活动顺序相反。即
Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+>(H+)>Al3+>Mg2+>Na+>Ca2+>K+。
阴离子 失电子顺序:
活性电极﹥阴离子。即:
Cu > Hg > Ag (金属)>S2->I->Br ->Cl->OH-> NO3 ->SO4 2- (含氧酸根离子)。
H2O
H2O
1、分析下图,属于电解池的有
√
√
×
×
×
×
×
×
练习
2.下列说法正确的是( )
①电解是把电能转变成化学能;
②电解是化学能转变成电能;
③电解质溶液导电的过程,就是发生是化学变化的过程;
④任何电解过程,必将导致氧化还原反应的发生。
①③④
练习
3.下图所示是电解CuCl2溶液的装置,
其中c、d为石墨电极。则下列判断正
确的是( )
A.a为负极、b为正极
B.a为阳极、b为阴极
C.电解过程中,d电极质量增加
D.电解过程中,氯离子浓度不变
C
练习
4.用石墨棒做阳极、铁棒做阴极电解熔融的氯化钠,下列说法中正确的是( )
A.石墨周围有大量的Na+
B.铁棒质量增加
C.电子通过电解质溶液由石墨棒流向铁棒
D.铁棒电极发生氧化反应
B
练习
5.电解熔融的氧化铝可制得金属铝.试写出
电极反应和总的反应方程式。(提示:氧化铝在熔融状态下以O2-和Al3+的形式存在)
阳极 6O2- - 12e- =3O2↑
阴极 4Al3+ + 12e-=4Al
电极总反应 2Al2O3 4Al+3O2↑
=
通电
练习
6.以石墨作电极分别电解下列溶液,在阴极不能得到氢气的是( )
A. Na2SO4 B. AgNO3 C. NaCl D. NaOH
B
练习
7.下列各组中,每种电解质溶液电解时只生成氢气和氧气的是( )
A. HCl、CuCl2、Ba(OH)2
B. NaOH、CuSO4、H2SO4
C. NaOH、H2SO4、Ba(OH)2
D. NaBr、H2SO4、Ba(OH)2
C
8.右图所示为直流电源电解稀Na2SO4水溶液的
装置。通电后在石墨电极a和b附近分别滴加一
滴石蕊溶液。下列实验现象中正确的是( )
A.逸出气体的体积,a电极小于b电极
B.一电极逸出无味气体,另一电极逸出刺激性气味气体
C.a电极附近呈红色,b电极附近呈蓝色
D.a电极附近呈蓝色,b电极附近呈红色
D
练习
9.某同学为了使反应2HCl+2Ag===2AgCl+H2↑能进行,设计了如图所示的四个实验,你认为可行的方案是( )
C
练习
1、写出以惰性(石墨)电极电解下列溶液的电极反应式和电解方程式。
⑴氯化铜溶液(CuCl2) ⑵氯化氢溶液(HCl)
⑶氯化钠溶液(NaCl) ⑷硫酸铜溶液(CuSO4)
⑸硝酸银溶液(AgNO3) ⑹氢氧化钠溶液(NaOH)
⑺稀硫酸(H2SO4) ⑻硫酸钠溶液(Na2SO4)
2、完成课本第28页1、2。
课下练习
第3节 电能转化为化学能—电解
第1课时 电解的原理
第1章 化学反应与能量转化
学习目标
1、能通过对电解熔融氯化钠的探究,了解电解池的构成、工作原理。
2、能分析电解池的两极,能正确书写电极反应式、电解反应式。
3、通过对常见物质的电解产物的分析,归纳出电极放电顺序。
[交流·研讨]
工业上电解熔融氯化钠生产金属钠的装置示意图。容器中盛有熔融的氯化钠,两侧分别插入石墨片和铁片作为电极材料,两个电极分别与电源的正极和负极相连。
[现象]
石墨电极:(阳极、和电源正极相连):有气泡,黄绿色、刺激性气味,并能使湿润的KI-淀粉试纸变蓝(Cl2)。
铁电极(阴极、和电源负极相连):有金属钠析出
实验1:电解熔融的氯化钠
1、通电前,熔融氯化钠中存在哪些离子?这些离子的运动情况怎样?
2、通电后,外电路上的电流方向怎样?
3、接通电源后,熔融氯化钠中Na+、Cl-各向那个方向运动?
4、移到两极表面的Na+、Cl-发生什么变化?
通电前:分析熔融电解质中的离子情况
通电后:(必须通直流电)
Na+移向与电源负极相连的电极(Fe),得到电子变成Na,发生还原反应。 Na+ + e-=Na
Cl-移向与电源正极相连的电极(C),失去电子变成Cl,结合生成Cl2,发生氧化反应。 2Cl- - 2e-=Cl2↑
【实验分析】
做无规则运动
阳离子:Na+
阴离子:Cl-
2NaCl 2Na+Cl2↑
通电
总反应式:
一、电解原理
1、电解
使电流通过熔融的电解质或电解质溶液,在两个电极上分别发生氧化反应和还原反应的过程。
2、电解池
利用氧化还原反应,把电能转化为化学能的装置。
3、电解池构成条件
(1)外加直流电源
(2)与电源相连的两个电极
(3)电解质溶液或熔化的电解质
(4)用导线连接形成闭合回路
4.电解池的工作原理
接通外界电源后,电子从电源的负极沿导线流入电解池的阴极,经过阴、阳离子的定向运动形成内电路,再从电解池的阳极流出,并沿导线流回电源的正极,如图所示。
5、电解池的两极
⑴根据连接方式和电极反应性质
阳极:与电源正极相连,发生氧化反应
阴极:与电源负极相连,发生还原反应
⑵根据电极的活泼性
惰性电极:一般不参与电极反应(石墨、金、铂)
活性电极:除金、铂以外的金属作阳极时,发生氧化反应。
6、电极产物的判断,电极反应的书写
电极反应:电极上进行的半反应。
阳极:还原剂-ne- = 氧化产物 氧化反应
阴极:氧化剂+ne-=还原产物 还原反应
阳极:2Cl- - 2e-=Cl2↑ 氧化反应
阴极:2Na+ + 2e-=2Na 还原反应
2NaCl 2Na+Cl2↑
通电
总反应式:
注意:书写电极反应式一定要遵守电子守恒
示例:
电解熔融的氯化钠的电极反应和总反应
实验2:用惰性(石墨)电极电解氯化铜溶液
【实验分析】
通电前:分析氯化铜溶液中的离子情况
通电后:(必须通直流电)
分析:Cu2+ 、H+移向阴极,在阴极上 Cu2+得到电子变成Cu,发生还原反应。
Cl- 、OH-移向阳极, 在阳极上Cl-失去电子变成Cl,Cl结合成Cl2,发生氧化反应。
现象:左侧石墨电极(阴极)上有红色物质生成,
右侧石墨电极(阳极)上有黄绿色气体刺激性气味的生成,能使湿润的KI-淀粉试纸变蓝(Cl2)。
做无规则运动
阳离子:Cu2+ 、H+
阴离子:Cl- 、OH-
电解的电极反应式:
阳极:2Cl- -2e-=Cl2↑ 氧化反应
阴极:Cu2+ +2e-=Cu 还原反应
CuCl2 Cu+Cl2↑
通电
电解的总反应式:
2、如何才能正确判断出电解过程中阴阳两极的电极产物?
3、电解过程中,电解质溶液中阴、阳离子得、失电子能力的相对强弱顺序?
思考:
1、阅读课本栏目【交流·研讨】,并分析完成课本问题
7、离子的放电顺序
阳离子得电子顺序 ,
与金属活动顺序相反。即
Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+>(H+)>Al3+>Mg2+>Na+>Ca2+>K+。
阴离子 失电子顺序:
活性电极﹥阴离子。即:
Cu > Hg > Ag (金属)>S2->I->Br ->Cl->OH-> NO3 ->SO4 2- (含氧酸根离子)。
H2O
H2O
1、分析下图,属于电解池的有
√
√
×
×
×
×
×
×
练习
2.下列说法正确的是( )
①电解是把电能转变成化学能;
②电解是化学能转变成电能;
③电解质溶液导电的过程,就是发生是化学变化的过程;
④任何电解过程,必将导致氧化还原反应的发生。
①③④
练习
3.下图所示是电解CuCl2溶液的装置,
其中c、d为石墨电极。则下列判断正
确的是( )
A.a为负极、b为正极
B.a为阳极、b为阴极
C.电解过程中,d电极质量增加
D.电解过程中,氯离子浓度不变
C
练习
4.用石墨棒做阳极、铁棒做阴极电解熔融的氯化钠,下列说法中正确的是( )
A.石墨周围有大量的Na+
B.铁棒质量增加
C.电子通过电解质溶液由石墨棒流向铁棒
D.铁棒电极发生氧化反应
B
练习
5.电解熔融的氧化铝可制得金属铝.试写出
电极反应和总的反应方程式。(提示:氧化铝在熔融状态下以O2-和Al3+的形式存在)
阳极 6O2- - 12e- =3O2↑
阴极 4Al3+ + 12e-=4Al
电极总反应 2Al2O3 4Al+3O2↑
=
通电
练习
6.以石墨作电极分别电解下列溶液,在阴极不能得到氢气的是( )
A. Na2SO4 B. AgNO3 C. NaCl D. NaOH
B
练习
7.下列各组中,每种电解质溶液电解时只生成氢气和氧气的是( )
A. HCl、CuCl2、Ba(OH)2
B. NaOH、CuSO4、H2SO4
C. NaOH、H2SO4、Ba(OH)2
D. NaBr、H2SO4、Ba(OH)2
C
8.右图所示为直流电源电解稀Na2SO4水溶液的
装置。通电后在石墨电极a和b附近分别滴加一
滴石蕊溶液。下列实验现象中正确的是( )
A.逸出气体的体积,a电极小于b电极
B.一电极逸出无味气体,另一电极逸出刺激性气味气体
C.a电极附近呈红色,b电极附近呈蓝色
D.a电极附近呈蓝色,b电极附近呈红色
D
练习
9.某同学为了使反应2HCl+2Ag===2AgCl+H2↑能进行,设计了如图所示的四个实验,你认为可行的方案是( )
C
练习
1、写出以惰性(石墨)电极电解下列溶液的电极反应式和电解方程式。
⑴氯化铜溶液(CuCl2) ⑵氯化氢溶液(HCl)
⑶氯化钠溶液(NaCl) ⑷硫酸铜溶液(CuSO4)
⑸硝酸银溶液(AgNO3) ⑹氢氧化钠溶液(NaOH)
⑺稀硫酸(H2SO4) ⑻硫酸钠溶液(Na2SO4)
2、完成课本第28页1、2。
课下练习
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
