鲁科版高中化学选择性必修1第1章化学反应与能量转化1.3.2电解原理的应用教学课件(共24张PPT)
文档属性
| 名称 | 鲁科版高中化学选择性必修1第1章化学反应与能量转化1.3.2电解原理的应用教学课件(共24张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 451.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-09 00:00:00 | ||
图片预览








文档简介
(共24张PPT)
第3节 电能转化为化学能—电解
第2课时 电解原理的应用
第1章 化学反应与能量转化
学习目标
1、通过对常见物质的电解产物的分析,归纳电解规律。
2、通过对电解饱和食盐水、电解精炼铜、电镀等电解实例的认知,认识电解在实现物质转化和储存能量中的重要作用。3、通过讨论电镀工业对环境造成的影响,提升学生的环保意识和社会责任。
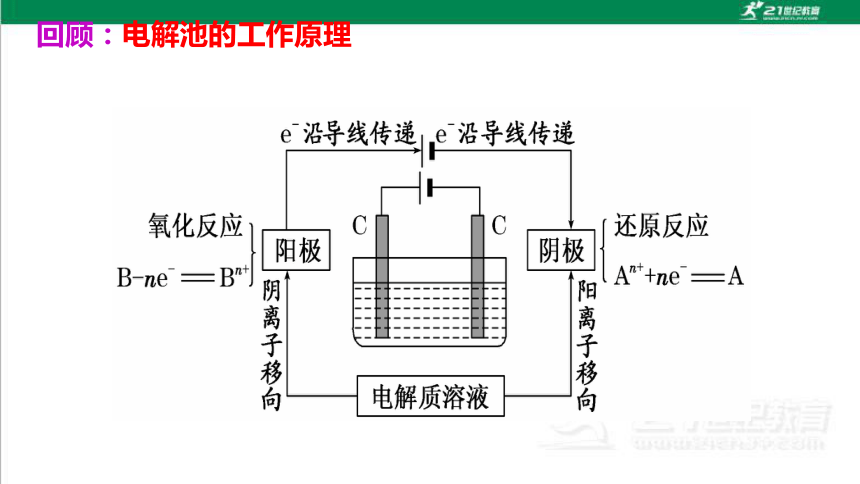
回顾:电解池的工作原理
离子的放电顺序
(1)阴极:惰性电极、活性电极都不参与反应,溶液中的阳离子放电顺序:
Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+>(H+)
>Al3+>Mg2+>Na+>Ca2+>K+。
(2)阳极:活性电极被氧化或溶液中还原性强的阴离子失去电子被氧化。其放电顺序:
金属阳极>S2->I->Br ->Cl->OH->含氧酸根离子。
OH-
H2O
H2O
(H+)
方法导引:分析电解反应的一般思路:
2、确定电极性质和材料。活性、惰性电极
3、分析明确溶液中存在阴阳离子。
1、确定装置的性质。电解池
4、根据放电顺序,分析阴阳两极极区离子移动方向放电情况。
5、根据溶液性质,确定电极产物,并写出电极反应。
6、写出电解总反应方程式。
课下练习汇报:以惰性(石墨)电极电解下列溶液。
⑴氯化铜溶液(CuCl2) ⑵氯化氢溶液(HCl) ⑶氯化钠溶液(NaCl)
⑷硫酸铜溶液(CuSO4) ⑸硝酸银溶液(AgNO3) ⑹氢氧化钠溶液(NaOH)
⑺稀硫酸(H2SO4) ⑻硫酸钠溶液(Na2SO4)
电解无氧酸溶液(氢氟酸除外)、不活泼金属的无氧酸盐溶液时,实质上是电解质本身被电解。如电解盐酸、CuCl2溶液等
阳极: 2Cl-- 2e-=Cl2↑
阴极: Cu2+ + 2e-=Cu
总反应:CuCl2 == Cl2↑+ Cu
通电
⑵氯化氢溶液
⑴氯化铜溶液
阳极: 2Cl-- 2e-=Cl2↑
阴极: 2H+ + 2e-=H2↑
总反应:2HCl == Cl2↑+ H2↑
通电
1、电解质本身被电解
电解液复原:若要恢复需加入一定量的溶质
一、用惰性电极进行电解时的电解规律总结
电解活泼金属的无氧酸盐溶液时,电解质和水都有一部分被电解,如电解NaCl溶液等。
电解液复原:若要恢复需通入一定量的HCl。
2、电解电解质和水(放氢生碱型)
⑶电解NaCl溶液
阳极(C):2Cl--2e- = Cl2↑
阴极(C):2H+ +2e-= H2↑
总反应:2NaCl+2H2O == 2NaOH + Cl2↑+ H2↑
通电
电解不活泼金属的含氧酸盐时,电解质和水都有一部分被电解,如电解CuSO4溶液、AgNO3溶等。
阳极 :4OH- - 4e- = 2H2O + O2↑
阴极:2Cu2+ + 4e-= 2Cu
总反应:2CuSO4 + 2H2O == 2Cu +O2↑+ 2H2SO4
通电
电解液复原:若要恢复需加入一定量金属氧化物。
⑷CuSO4溶液
3、电解电解质和水(放氧生酸型)
⑸硝酸银溶液
阳极 :4OH- - 4e-= 2H2O + O2↑
阴极:4Ag+ + 4e-= 4Ag
总反应:4AgNO3+ 2H2O == 4Ag +O2↑+4HNO3
通电
电解含氧酸、强碱溶液、活泼金属的含氧酸盐溶液时,实质上是电解水。如电解H2SO4、HNO3、NaOH、Na2SO4等溶液
阳极:4OH- - 4e- = 2H2O + O2↑
阴极:4H+ + 4e- = 2H2↑
总反应:2H2O == O2↑ + 2H2↑
通电
电解液复原:若要恢复,只需加入一定量的水。
4、电解水型(阴极生成氢气,阳极生成氧气)
⑹氢氧化钠溶液
⑺稀硫酸
⑻硫酸钠溶液
阳极:放出有刺激性气味的气体,能是湿润的淀粉碘化钾试纸变蓝
阴极:放出无色无味的气体,阴极区酚酞变红
二、电解规律的应用
电极反应式
阴极:2H+ + 2e- = H2↑
阳极:2Cl- - 2e- = Cl2↑
总式:2NaCl+2H2O === 2NaOH + H2↑+ Cl2↑
通电
阴极产物
阳极产物
1、电解饱和食盐水
+
-
纯铜
粗铜
电解液(CuSO4溶液)
阴极:Cu2+ + 2e-= Cu (还原反应)
阳极:Cu - 2e-= Cu2+ (氧化反应、主反应)
Zn-2e-=Zn2+ Fe-2e-=Fe2+
Ni-2e-=Ni2+ (次要反应)
纯铜作阴极,粗铜作阳极,阳极还包含Zn、Fe、Ni失电子,且比Cu先失电子
阳极主要金属与电解质中的阳离子相同
2、电解精炼铜
电解液CuSO4的浓度略变小,有杂质离子Zn2+、Fe2+、Ni2+
Ag、Au不失电子,沉积在阳极下方的阳极泥中
+
-
铁片
铜片
电镀液(CuSO4溶液)
电极反应
阴极:Cu2+ + 2e- = Cu (还原反应)
阳极:Cu - 2e- = Cu2+ (氧化反应)
电镀液CuSO4的浓度基本不变
3、电镀
电镀是应用电解原理,在某些金属表面镀上一薄层其他金属或合金的过程。电镀时,镀层金属作阳极,镀件(待镀金属)作阴极,含镀层金属阳离子的电解质溶液作电镀液,用直流电源。
(1)电镀铜
+
-
铁片
锌片
电镀液(ZnCl2溶液)
说明:因Zn2+离子浓度远大于H+离子浓度 [Zn2+] [H+],则Zn2+放电
(2)电镀锌
电极反应
阴极:Zn2+ + 2e- = Zn (还原反应)
阳极:Zn -2e-= Zn2+ (氧化反应)
电镀时,镀层金属锌作阳极,镀件(待镀金属)作阴极,含Zn2+的电解质溶液作电镀液。
金属 电极反应式 总反应式
钠 阳极:2Cl--2e-=Cl2↑
阴极:2Na++2e-=2Na 2NaCl(熔融) = 2Na+Cl2↑
铝 阳极:6O2--12e-=3O2↑
阴极:4Al3++12e-=4Al 2Al2O3(熔融) = 4Al+3O2↑
镁 阳极:2Cl--2e-=Cl2↑
阴极:Mg2++2e-=Mg MgCl2(熔融) = Mg+Cl2↑
4、常见活泼金属的电冶法
通电
通电
通电
5、二次电池的充电过程
⑴铅蓄电池的充电
铅蓄电池是二次电池,能放电又能充电。 放电是原电池原理, 充电是电解原理,充电时是电解池。铅蓄电池的正极连接外接电源的正极作为电解池的阳极,铅蓄电池的负极连接外接电源的负极作为电解池的阴极。
其电极反应式为:
阳极:PbSO4 + 2H2O - 2e- = PbO2 + 4H+ + SO42-
阴极:PbSO4 + 2e- = Pb + SO42-
正接正、负接负
通电
1、以石墨作电极分别电解下列溶液,电解质和水的量都发生变化的是( )
A. Na2SO4 B. AgNO3 C. NaCl D. NaOH
2、以石墨作电极电解水时,溶液pH值变大的是( )
A. Na2SO4 B. AgNO3 C. NaCl D. NaOH
BC
CD
练习
3、串联电解熔融KCl、MgCl2、Al2O3一段时间后,析出K、Mg、Al的物质的量之是 。
d
a
b
c
KI淀粉试纸
4、c作为笔在左边纸上写字,字迹变蓝,则b是 极,c上发生的反应为:
,
d的总化学反应方程式为:
。
6:3:2
正
2I--2e- =I2
2KI+2H2O == H2↑+I2↑+2KOH
电解
练习
5.火法炼铜得到的粗铜中含多种杂质(如锌、金和银等),其性能远不能达到电气工业的要求,工业上常用电解精炼法将粗铜提纯。在电解精炼时( )
A.精炼时粗铜接电源负极
B.精炼时纯铜作阴极
C.杂质都将以单质形式沉积到池底
D.纯铜片增重2.56g,电路中通过电子为0.04mol
B
练习
6、惰性电极电解下列物质的水溶液时,在阴极无金属析出( )
A.AgNO3 B.CuCl2 C.NaOH D.CaCl2
7、用惰性电极电解下列物质的水溶液时,在两极都能放出气体,且溶液的pH值增大的是( )
A.HCl B.CuSO4 C.Na2SO4 D. NaOH
8、用惰性电极电解下列物质的水溶液,一段时间后,再加入一定质量的另一种物质(中括号内),溶液能与原来完全一样的是( )
A. CuCl2〔CuO〕 B. NaOH 〔NaOH 〕
C. NaCl〔HCl〕 D. CuSO4〔Cu(OH)2〕
CD
AD
C
练习
9、某电动汽车配载一种可充放电的锂离子电池。放电时电池的总反应为:Li1-xCoO2+LixC6=LiCoO2+ C6(x<1)。下列关于该电池的说法不正确的是( )
A.放电时,Li+在电解质中由负极向正极迁移
B.放电时,负极的电极反应式为LixC6-xe-= xLi++ C6
C.充电时,若转移1mole-,石墨C6电极将增重7xg
D.充电时,阳极的电极反应式为LiCoO2-xe-=Li1-xCoO2+Li+
分析:放电时,阳离子向正极移动,A正确;放电时,负极失去电子,B正确;充电时,若转移1mol电子,则石墨电极上溶解1/xmol C6,电极质量减少,C错误;充电时阳极失去电子,为原电池的正极的逆反应,D正确。
C
课后练习:完成课本第29页3、4、5。
第3节 电能转化为化学能—电解
第2课时 电解原理的应用
第1章 化学反应与能量转化
学习目标
1、通过对常见物质的电解产物的分析,归纳电解规律。
2、通过对电解饱和食盐水、电解精炼铜、电镀等电解实例的认知,认识电解在实现物质转化和储存能量中的重要作用。3、通过讨论电镀工业对环境造成的影响,提升学生的环保意识和社会责任。
回顾:电解池的工作原理
离子的放电顺序
(1)阴极:惰性电极、活性电极都不参与反应,溶液中的阳离子放电顺序:
Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+>(H+)
>Al3+>Mg2+>Na+>Ca2+>K+。
(2)阳极:活性电极被氧化或溶液中还原性强的阴离子失去电子被氧化。其放电顺序:
金属阳极>S2->I->Br ->Cl->OH->含氧酸根离子。
OH-
H2O
H2O
(H+)
方法导引:分析电解反应的一般思路:
2、确定电极性质和材料。活性、惰性电极
3、分析明确溶液中存在阴阳离子。
1、确定装置的性质。电解池
4、根据放电顺序,分析阴阳两极极区离子移动方向放电情况。
5、根据溶液性质,确定电极产物,并写出电极反应。
6、写出电解总反应方程式。
课下练习汇报:以惰性(石墨)电极电解下列溶液。
⑴氯化铜溶液(CuCl2) ⑵氯化氢溶液(HCl) ⑶氯化钠溶液(NaCl)
⑷硫酸铜溶液(CuSO4) ⑸硝酸银溶液(AgNO3) ⑹氢氧化钠溶液(NaOH)
⑺稀硫酸(H2SO4) ⑻硫酸钠溶液(Na2SO4)
电解无氧酸溶液(氢氟酸除外)、不活泼金属的无氧酸盐溶液时,实质上是电解质本身被电解。如电解盐酸、CuCl2溶液等
阳极: 2Cl-- 2e-=Cl2↑
阴极: Cu2+ + 2e-=Cu
总反应:CuCl2 == Cl2↑+ Cu
通电
⑵氯化氢溶液
⑴氯化铜溶液
阳极: 2Cl-- 2e-=Cl2↑
阴极: 2H+ + 2e-=H2↑
总反应:2HCl == Cl2↑+ H2↑
通电
1、电解质本身被电解
电解液复原:若要恢复需加入一定量的溶质
一、用惰性电极进行电解时的电解规律总结
电解活泼金属的无氧酸盐溶液时,电解质和水都有一部分被电解,如电解NaCl溶液等。
电解液复原:若要恢复需通入一定量的HCl。
2、电解电解质和水(放氢生碱型)
⑶电解NaCl溶液
阳极(C):2Cl--2e- = Cl2↑
阴极(C):2H+ +2e-= H2↑
总反应:2NaCl+2H2O == 2NaOH + Cl2↑+ H2↑
通电
电解不活泼金属的含氧酸盐时,电解质和水都有一部分被电解,如电解CuSO4溶液、AgNO3溶等。
阳极 :4OH- - 4e- = 2H2O + O2↑
阴极:2Cu2+ + 4e-= 2Cu
总反应:2CuSO4 + 2H2O == 2Cu +O2↑+ 2H2SO4
通电
电解液复原:若要恢复需加入一定量金属氧化物。
⑷CuSO4溶液
3、电解电解质和水(放氧生酸型)
⑸硝酸银溶液
阳极 :4OH- - 4e-= 2H2O + O2↑
阴极:4Ag+ + 4e-= 4Ag
总反应:4AgNO3+ 2H2O == 4Ag +O2↑+4HNO3
通电
电解含氧酸、强碱溶液、活泼金属的含氧酸盐溶液时,实质上是电解水。如电解H2SO4、HNO3、NaOH、Na2SO4等溶液
阳极:4OH- - 4e- = 2H2O + O2↑
阴极:4H+ + 4e- = 2H2↑
总反应:2H2O == O2↑ + 2H2↑
通电
电解液复原:若要恢复,只需加入一定量的水。
4、电解水型(阴极生成氢气,阳极生成氧气)
⑹氢氧化钠溶液
⑺稀硫酸
⑻硫酸钠溶液
阳极:放出有刺激性气味的气体,能是湿润的淀粉碘化钾试纸变蓝
阴极:放出无色无味的气体,阴极区酚酞变红
二、电解规律的应用
电极反应式
阴极:2H+ + 2e- = H2↑
阳极:2Cl- - 2e- = Cl2↑
总式:2NaCl+2H2O === 2NaOH + H2↑+ Cl2↑
通电
阴极产物
阳极产物
1、电解饱和食盐水
+
-
纯铜
粗铜
电解液(CuSO4溶液)
阴极:Cu2+ + 2e-= Cu (还原反应)
阳极:Cu - 2e-= Cu2+ (氧化反应、主反应)
Zn-2e-=Zn2+ Fe-2e-=Fe2+
Ni-2e-=Ni2+ (次要反应)
纯铜作阴极,粗铜作阳极,阳极还包含Zn、Fe、Ni失电子,且比Cu先失电子
阳极主要金属与电解质中的阳离子相同
2、电解精炼铜
电解液CuSO4的浓度略变小,有杂质离子Zn2+、Fe2+、Ni2+
Ag、Au不失电子,沉积在阳极下方的阳极泥中
+
-
铁片
铜片
电镀液(CuSO4溶液)
电极反应
阴极:Cu2+ + 2e- = Cu (还原反应)
阳极:Cu - 2e- = Cu2+ (氧化反应)
电镀液CuSO4的浓度基本不变
3、电镀
电镀是应用电解原理,在某些金属表面镀上一薄层其他金属或合金的过程。电镀时,镀层金属作阳极,镀件(待镀金属)作阴极,含镀层金属阳离子的电解质溶液作电镀液,用直流电源。
(1)电镀铜
+
-
铁片
锌片
电镀液(ZnCl2溶液)
说明:因Zn2+离子浓度远大于H+离子浓度 [Zn2+] [H+],则Zn2+放电
(2)电镀锌
电极反应
阴极:Zn2+ + 2e- = Zn (还原反应)
阳极:Zn -2e-= Zn2+ (氧化反应)
电镀时,镀层金属锌作阳极,镀件(待镀金属)作阴极,含Zn2+的电解质溶液作电镀液。
金属 电极反应式 总反应式
钠 阳极:2Cl--2e-=Cl2↑
阴极:2Na++2e-=2Na 2NaCl(熔融) = 2Na+Cl2↑
铝 阳极:6O2--12e-=3O2↑
阴极:4Al3++12e-=4Al 2Al2O3(熔融) = 4Al+3O2↑
镁 阳极:2Cl--2e-=Cl2↑
阴极:Mg2++2e-=Mg MgCl2(熔融) = Mg+Cl2↑
4、常见活泼金属的电冶法
通电
通电
通电
5、二次电池的充电过程
⑴铅蓄电池的充电
铅蓄电池是二次电池,能放电又能充电。 放电是原电池原理, 充电是电解原理,充电时是电解池。铅蓄电池的正极连接外接电源的正极作为电解池的阳极,铅蓄电池的负极连接外接电源的负极作为电解池的阴极。
其电极反应式为:
阳极:PbSO4 + 2H2O - 2e- = PbO2 + 4H+ + SO42-
阴极:PbSO4 + 2e- = Pb + SO42-
正接正、负接负
通电
1、以石墨作电极分别电解下列溶液,电解质和水的量都发生变化的是( )
A. Na2SO4 B. AgNO3 C. NaCl D. NaOH
2、以石墨作电极电解水时,溶液pH值变大的是( )
A. Na2SO4 B. AgNO3 C. NaCl D. NaOH
BC
CD
练习
3、串联电解熔融KCl、MgCl2、Al2O3一段时间后,析出K、Mg、Al的物质的量之是 。
d
a
b
c
KI淀粉试纸
4、c作为笔在左边纸上写字,字迹变蓝,则b是 极,c上发生的反应为:
,
d的总化学反应方程式为:
。
6:3:2
正
2I--2e- =I2
2KI+2H2O == H2↑+I2↑+2KOH
电解
练习
5.火法炼铜得到的粗铜中含多种杂质(如锌、金和银等),其性能远不能达到电气工业的要求,工业上常用电解精炼法将粗铜提纯。在电解精炼时( )
A.精炼时粗铜接电源负极
B.精炼时纯铜作阴极
C.杂质都将以单质形式沉积到池底
D.纯铜片增重2.56g,电路中通过电子为0.04mol
B
练习
6、惰性电极电解下列物质的水溶液时,在阴极无金属析出( )
A.AgNO3 B.CuCl2 C.NaOH D.CaCl2
7、用惰性电极电解下列物质的水溶液时,在两极都能放出气体,且溶液的pH值增大的是( )
A.HCl B.CuSO4 C.Na2SO4 D. NaOH
8、用惰性电极电解下列物质的水溶液,一段时间后,再加入一定质量的另一种物质(中括号内),溶液能与原来完全一样的是( )
A. CuCl2〔CuO〕 B. NaOH 〔NaOH 〕
C. NaCl〔HCl〕 D. CuSO4〔Cu(OH)2〕
CD
AD
C
练习
9、某电动汽车配载一种可充放电的锂离子电池。放电时电池的总反应为:Li1-xCoO2+LixC6=LiCoO2+ C6(x<1)。下列关于该电池的说法不正确的是( )
A.放电时,Li+在电解质中由负极向正极迁移
B.放电时,负极的电极反应式为LixC6-xe-= xLi++ C6
C.充电时,若转移1mole-,石墨C6电极将增重7xg
D.充电时,阳极的电极反应式为LiCoO2-xe-=Li1-xCoO2+Li+
分析:放电时,阳离子向正极移动,A正确;放电时,负极失去电子,B正确;充电时,若转移1mol电子,则石墨电极上溶解1/xmol C6,电极质量减少,C错误;充电时阳极失去电子,为原电池的正极的逆反应,D正确。
C
课后练习:完成课本第29页3、4、5。
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
