鲁科版高中化学选择性必修1第2章化学反应的方向、限度与速率2.3.1化学反应速率教学课件
文档属性
| 名称 | 鲁科版高中化学选择性必修1第2章化学反应的方向、限度与速率2.3.1化学反应速率教学课件 |  | |
| 格式 | ppt | ||
| 文件大小 | 382.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-09 20:54:45 | ||
图片预览






文档简介
(共15张PPT)
第2章 化学反应的方向、限度与速率
第3节 化学反应速率
每一步
历程
条件
反应物的结构和反应条件
化学反应速率
*
*
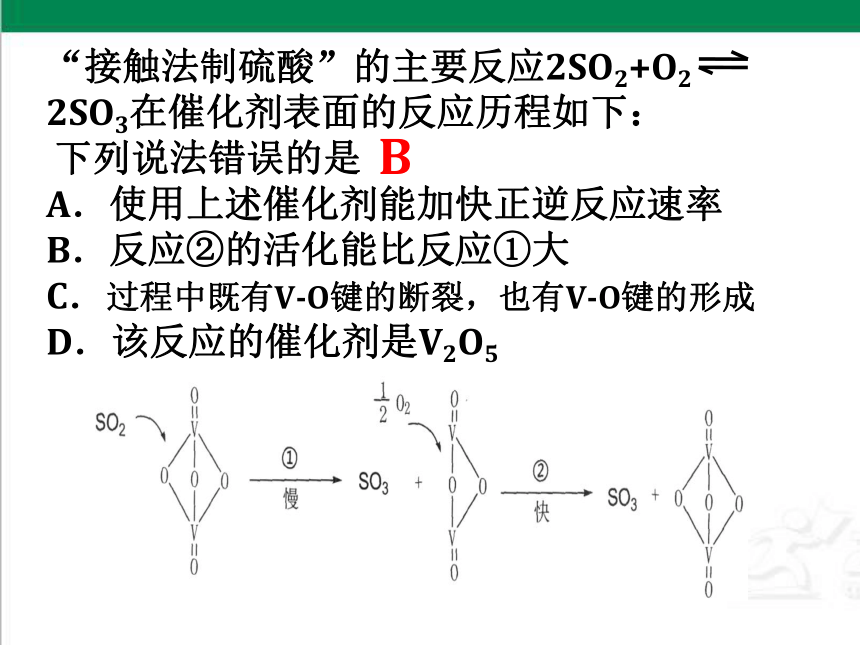
“接触法制硫酸”的主要反应2SO2+O2 2SO3在催化剂表面的反应历程如下:
下列说法错误的是
A.使用上述催化剂能加快正逆反应速率
B.反应②的活化能比反应①大
C.过程中既有V-O键的断裂,也有V-O键的形成
D.该反应的催化剂是V2O5
B
C
浓度(或质量、物质的量等)
mol·L-1·s-1
mol·L-1·min-1
*
不同
相同
系数之比
*
2、化学反应速率的计算
(1)定义式法
利用公式v= , 计算化学反应速率。
(2)关系式法
利用化学反应速率之比=物质的量浓度变化量之比=化学计量数之比。
(3)“三段式”法
①求解化学反应速率计算题的一般步骤:
a.写出有关反应的化学方程式。
b.找出各物质的起始量、转化量、某时刻量。
c.根据已知条件列方程计算。
*
*
C
*
*
C
*
*
2门世2有
3厚
0
0
S02
2
0
①
0
②
慢
S03
+
快
0
0
0
c/(mol-L)
8
C
6
4
B
2
A
0
2(min)
第2章 化学反应的方向、限度与速率
第3节 化学反应速率
每一步
历程
条件
反应物的结构和反应条件
化学反应速率
*
*
“接触法制硫酸”的主要反应2SO2+O2 2SO3在催化剂表面的反应历程如下:
下列说法错误的是
A.使用上述催化剂能加快正逆反应速率
B.反应②的活化能比反应①大
C.过程中既有V-O键的断裂,也有V-O键的形成
D.该反应的催化剂是V2O5
B
C
浓度(或质量、物质的量等)
mol·L-1·s-1
mol·L-1·min-1
*
不同
相同
系数之比
*
2、化学反应速率的计算
(1)定义式法
利用公式v= , 计算化学反应速率。
(2)关系式法
利用化学反应速率之比=物质的量浓度变化量之比=化学计量数之比。
(3)“三段式”法
①求解化学反应速率计算题的一般步骤:
a.写出有关反应的化学方程式。
b.找出各物质的起始量、转化量、某时刻量。
c.根据已知条件列方程计算。
*
*
C
*
*
C
*
*
2门世2有
3厚
0
0
S02
2
0
①
0
②
慢
S03
+
快
0
0
0
c/(mol-L)
8
C
6
4
B
2
A
0
2(min)
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
