鲁科版高中化学选择性必修1第2章化学反应的方向、限度与速率2.2.3温度对化学平衡的影响教学课件
文档属性
| 名称 | 鲁科版高中化学选择性必修1第2章化学反应的方向、限度与速率2.2.3温度对化学平衡的影响教学课件 |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-09 00:00:00 | ||
图片预览




文档简介
(共11张PPT)
第2章 化学反应的方向、限度与速率
第2节 化学反应的限度
第3课时 温度对化学平衡的影响
联想 质疑
在19世纪后期,人们发现炼铁高炉所排出的高炉气中含有相当数量的一氧化碳。有的工程师认为,这是由于一氧化碳和铁矿石的接触时间不够长造成的,于是英国耗费了大量资金建造了一个高大的炼铁高炉,以增加一氧化碳和铁矿石的接触时间。可是后来发现,用这个高炉炼铁,所排出的高炉气中的一氧化碳并没有减少,其原因是什么 如果继续增大铁矿石的量能减少一氧化碳的含量吗
高炉炼铁的原理是利用CO还原氧化铁,此反应为可逆反应,当反应达到平衡时,增加反应时间不能改变各种物质的百分含量;增加铁矿石的量不能减少一氧化碳的含量。
联想 质疑
反应条件对化学平衡的影响
预测
某化学反应mA(g)+nB(g) pC(g)+qD(g)的ΔH>0。温度、浓度或压强改变时,化学平衡状态是否改变?如果发生改变,化学平衡将向哪个方向移动?说明预测理由。
资料在线
温度与化学平衡常数的关系
温度变化 反应焓变ΔH 平衡常数K 温度变化 反应焓变ΔH 平衡常数K
升高 >0 增大 降低 >0 减小
<0 减小 <0 增大
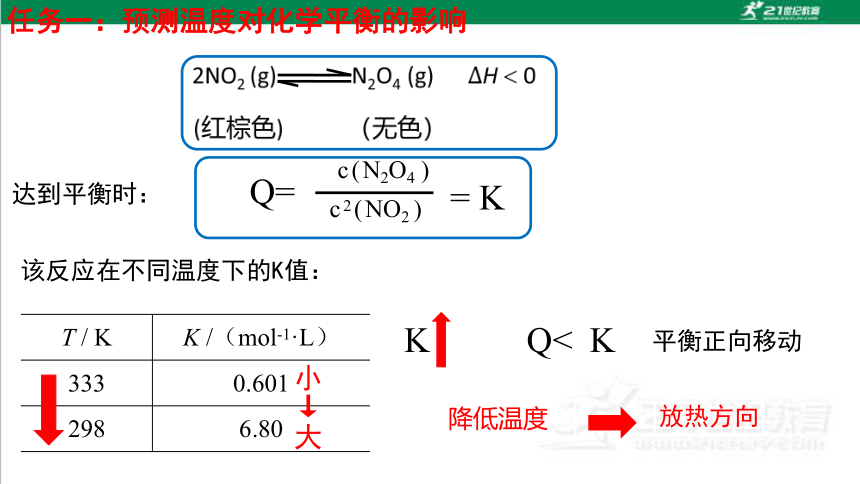
任务一:预测温度对化学平衡的影响
该反应在不同温度下的K值:
T / K K /(mol-1·L)
333 0.601
298 6.80
c(N2O4 )
c2(NO2 )
Q=
= K
达到平衡时:
小↓
大
K
Q<
K
平衡正向移动
降低温度
放热方向
任务一:预测温度对化学平衡的影响
该反应在不同温度下的K值:
T / K K /(mol-1·L)
333 0.601
298 6.80
c(N2O4 )
c2(NO2 )
Q=
= K
达到平衡时:
K
Q>
K
平衡逆向移动
升高温度
吸热方向
小↑
大
任务二:实验验证温度对化学平衡的影响
实验目的
探究温度对化学平衡的影响。
实验用品
装有二氧化氮—四氧化二氮混合气体的装置,冰水混合物,热水;烧杯。
实验方案设计及实施
设计目的 实验方案 现象预测 观察到的现象
探究温度对化学平衡的影响
冷水
热水
任务二:实验验证温度对化学平衡的影响
2NO2 (g) N2O4(g)
红棕色
无色
实验
现象 浸到冰水中时混合物颜色_____,浸到热水中时混合物颜色_____
变浅
变深
2NO2 (g) N2O4(g)
红棕色
无色
降低温度
升高温度
平衡正向移动
平衡逆向移动
颜色变浅
颜色变深
(放热反应)
(吸热反应)
冷水
热水
任务二:实验验证温度对化学平衡的影响
小结:
温度对化学平衡的影响
反应焓变 ΔH 温度变化 平衡常数K 移动方向
ΔH < 0
(放热反应) 温度升高 变小 吸热方向(逆向)
温度降低 变大 放热方向(正向)
小结:
温度对化学平衡的影响
反应焓变 ΔH 温度变化 平衡常数K 移动方向
ΔH >0
(吸热反应) 温度升高 变大 吸热方向(正向)
温度降低 变小 放热方向(逆向)
升高温度,平衡向吸热方向移动
降低温度,平衡向放热方向移动
在体积一定的密闭容器中,反应CO2(g)+H2(g) CO(g)+H2O(g) 的化学平衡常数和温度的关系如下表:
t/℃ 700 800 830 1000 1200
K 0.6 0.9 1.0 1.7 2.6
(1)该反应的正反应为 反应(填”吸热”或”放热”)。
(2)某温度下,平衡浓度符合下式:c(CO2)c(H2)=c(CO) c(H2O),可判断此时的温度为 ℃。
吸热
830
迁移应用
第2章 化学反应的方向、限度与速率
第2节 化学反应的限度
第3课时 温度对化学平衡的影响
联想 质疑
在19世纪后期,人们发现炼铁高炉所排出的高炉气中含有相当数量的一氧化碳。有的工程师认为,这是由于一氧化碳和铁矿石的接触时间不够长造成的,于是英国耗费了大量资金建造了一个高大的炼铁高炉,以增加一氧化碳和铁矿石的接触时间。可是后来发现,用这个高炉炼铁,所排出的高炉气中的一氧化碳并没有减少,其原因是什么 如果继续增大铁矿石的量能减少一氧化碳的含量吗
高炉炼铁的原理是利用CO还原氧化铁,此反应为可逆反应,当反应达到平衡时,增加反应时间不能改变各种物质的百分含量;增加铁矿石的量不能减少一氧化碳的含量。
联想 质疑
反应条件对化学平衡的影响
预测
某化学反应mA(g)+nB(g) pC(g)+qD(g)的ΔH>0。温度、浓度或压强改变时,化学平衡状态是否改变?如果发生改变,化学平衡将向哪个方向移动?说明预测理由。
资料在线
温度与化学平衡常数的关系
温度变化 反应焓变ΔH 平衡常数K 温度变化 反应焓变ΔH 平衡常数K
升高 >0 增大 降低 >0 减小
<0 减小 <0 增大
任务一:预测温度对化学平衡的影响
该反应在不同温度下的K值:
T / K K /(mol-1·L)
333 0.601
298 6.80
c(N2O4 )
c2(NO2 )
Q=
= K
达到平衡时:
小↓
大
K
Q<
K
平衡正向移动
降低温度
放热方向
任务一:预测温度对化学平衡的影响
该反应在不同温度下的K值:
T / K K /(mol-1·L)
333 0.601
298 6.80
c(N2O4 )
c2(NO2 )
Q=
= K
达到平衡时:
K
Q>
K
平衡逆向移动
升高温度
吸热方向
小↑
大
任务二:实验验证温度对化学平衡的影响
实验目的
探究温度对化学平衡的影响。
实验用品
装有二氧化氮—四氧化二氮混合气体的装置,冰水混合物,热水;烧杯。
实验方案设计及实施
设计目的 实验方案 现象预测 观察到的现象
探究温度对化学平衡的影响
冷水
热水
任务二:实验验证温度对化学平衡的影响
2NO2 (g) N2O4(g)
红棕色
无色
实验
现象 浸到冰水中时混合物颜色_____,浸到热水中时混合物颜色_____
变浅
变深
2NO2 (g) N2O4(g)
红棕色
无色
降低温度
升高温度
平衡正向移动
平衡逆向移动
颜色变浅
颜色变深
(放热反应)
(吸热反应)
冷水
热水
任务二:实验验证温度对化学平衡的影响
小结:
温度对化学平衡的影响
反应焓变 ΔH 温度变化 平衡常数K 移动方向
ΔH < 0
(放热反应) 温度升高 变小 吸热方向(逆向)
温度降低 变大 放热方向(正向)
小结:
温度对化学平衡的影响
反应焓变 ΔH 温度变化 平衡常数K 移动方向
ΔH >0
(吸热反应) 温度升高 变大 吸热方向(正向)
温度降低 变小 放热方向(逆向)
升高温度,平衡向吸热方向移动
降低温度,平衡向放热方向移动
在体积一定的密闭容器中,反应CO2(g)+H2(g) CO(g)+H2O(g) 的化学平衡常数和温度的关系如下表:
t/℃ 700 800 830 1000 1200
K 0.6 0.9 1.0 1.7 2.6
(1)该反应的正反应为 反应(填”吸热”或”放热”)。
(2)某温度下,平衡浓度符合下式:c(CO2)c(H2)=c(CO) c(H2O),可判断此时的温度为 ℃。
吸热
830
迁移应用
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
