鲁科版高中化学选择性必修1第3章物质在水溶液中的行为3.1.1水的电离电解质在水溶液中的存在形态教学课件(共33张PPT)
文档属性
| 名称 | 鲁科版高中化学选择性必修1第3章物质在水溶液中的行为3.1.1水的电离电解质在水溶液中的存在形态教学课件(共33张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-09 00:00:00 | ||
图片预览











文档简介
(共33张PPT)
第1节 水与水溶液
第3章 物质在水溶液中的行为
知识回顾
1.电解质: 或 能导电的 。
非电解质: 和 均不能导电的 。
溶于水
熔融状态
溶于水
熔融状态
化合物
化合物
电解质:酸、碱、盐、活泼金属氧化物、水
非电解质:多数有机物,非金属氧化物、部分氢化物
电解质溶液(如盐酸、CH3COOH溶液等)能够导电。那么,纯水能导电吗 为了研究这个问题,有人曾经用经过很多次纯化处理所制得的纯水进行导电性实验。结果发现其仍具有微弱的导电性,经分析得知纯水中存在氢离子和氢氧根离子。请写出水电离的方程式,并分析水的电离特点。
联想质疑
(2)电离特点
①水的电离为可逆过程 ②水的电离程度很微弱
③水的电离为吸热过程 ④水电离出的c平(H+)=c平(OH-)
1.水的电离
(1)水是一种极弱的电解质,能微弱电离,存在电离平衡
25℃纯水中:c平(H+)=c平(OH-)=
1.0×10-7mol·L-1
一、水的电离及水的离子积常数
Kw = C平(H+) × C平(OH-)
一定温度下,水电离出的H+和OH-浓度的乘积为一定值,称为水的离子积常数(Kw),简称水的离子积
Kw =
25℃时
1×10-14 mol2 L-2
(室温)
一定温度下,Kw是一个常数
Kw只与温度有关!
增大
为什么?
H2O(l) H+(aq) + OH-(aq)
H>0
t/℃ KW/mol2 L-2
25 1.0×10-14
55 7.3×10-14
80 2.5×10-13
100 5.5×10-13
结论:
1. Kw只与温度有关,温度越高,Kw越大
2.水的电离是一个吸热过程,升高温度,促进水的电离
温度升高,Kw
不同温度下水的离子积常数
注意
(1)Kw只是温度的函数,一定温度下Kw是一个常数。25℃时,Kw=10-14
(2)Kw只随温度的升高而增大,与c(H+) 、 c(OH-)无关。
(3)Kw适用于一定温度下任何稀的电解质溶液。
(4)在任何水溶液中,均存在水的电离平衡,也就是任何水溶液中都是H+、OH-共存的。
【理解应用】
1.25℃时,若某稀盐酸中,c平(H+)=1.0×10-4 mol·L-1,则溶液中c平(OH-)为 mol·L-1。
1.0×10-10
不同溶液中的c(H+) 、 c(OH-)可能不同,但是水电离出的c(H+)水与c(OH-)水相等
公式中[H+]、[OH-]均指溶液中总物质的量浓度
Kw = c平(H+) c平(OH-)
①纯水中,Kw= c(H+)水c(OH-)水
③稀碱溶液中,OH-来源于碱和水的电离,而H+只来源于水。c水(OH-)=c平(H+)。 25℃时,若碱电离出的c平(OH-)碱 >10-5 mol·L-1,则忽略水的电离。如0.1 mol·L-1的NaOH溶液中
c水(OH-)=c平(H+)=1×10-13 mol·L-1
②稀酸溶液中,H+来源于酸和水的电离,而OH-只来源于水,c水(H+)=c平(OH-)。25℃时,若酸电离出的c平(H+)酸 >10-5 mol·L-1,则忽略水的电离。如0.1 mol·L-1的HCl溶液中
c水(H+)=c平(OH-)=1×10-13 mol·L-1
拓展延伸
Kw= c(H+)酸c(OH-)水(忽略水电离的H+)
Kw= c(H+)水c(OH-)碱(忽略水电离的OH-)
常温下:
1、纯水中c(H+) =___________,c(OH—) =___________,
2、NaCl溶液中c(H+)=__________, c(OH—)=_________,
3、0.02mol/LHCl溶液,
c(H+)=__________,c(OH—)=___________
c(H+)水 =____________, c(OH—)水 =_____________
1×10-7mol/L
1×10-7mol/L
1×10-7mol/L
1×10-7mol/L
0.02mol/L
5×10-13mol/L
5×10-13mol/L
5×10-13mol/L
4、0.5mol/LBa(OH)2溶液,
c(H+)=______________,c(OH—)=___________,
c(H+)水 =____________, c(OH—)水 =_____________
1.0 mol/L
1×10-14mol/L
1×10-14mol/L
1×10-14mol/L
【归纳总结】
1.在不同溶液中,c平(H+)、c平(OH-)可能不同,但由水电离出的
c平(H+)与c平(OH-)总是相等的。
2.稀酸溶液中,c(OH-)水=c平(OH-)溶液
稀碱溶液中,c(H+)水=c平(H+)溶液
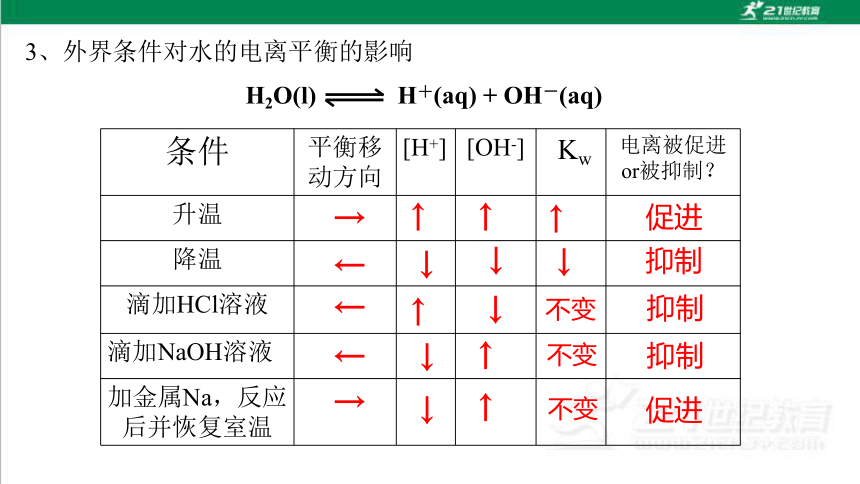
3、外界条件对水的电离平衡的影响
条件 平衡移动方向 [H+] [OH-]
Kw 电离被促进or被抑制?
升温
降温
滴加HCl溶液
滴加NaOH溶液
加金属Na,反应后并恢复室温
H2O(l) H+(aq) + OH-(aq)
→
←
↓
↑
↑
↑
促进
↓
↓
抑制
↑
←
↓
不变
抑制
↑
←
↓
不变
抑制
↓
→
↑
不变
促进
促进水的电离:升温、加入能消耗H+或OH-的物质
抑制水的电离:降温、加入酸(或强酸的酸式盐)、加入碱
加碱
加酸
盐类水解(第2节再介绍)
升高温度
抑制水电离
促进水电离
其他:加活泼金属(如Na、K等)
降低温度
归纳总结
迁移应用
判断下列说法是否正确
(1) 水的离子积常数Kw=10-14
(2) 温度升高,纯水中的c平(H+)增大,c平(OH-)减小
(3) 水的电离程度很小,纯水中主要存在形态是水分子
(4) 在纯水中加入少量硫酸铵,可促进水的电离,使水的离子积增大
(5) 不管是纯水还是在酸、碱、盐溶液中,水电离产生的C平(H+)和C平(OH-)始终相等。
×
√
×
×
√
水的电离程度很小,其主要存在形态是水分子,因此纯水的导电能力很弱。加入电解质后导电能力增强,不同的电解质其导电能力是否相同?影响溶液导电性因素是什么?
联想质疑
溶液导电性
自由移动离子浓度大小
离子所带电荷
观察思考
纯水的导电能力非常弱,但是向其中加入电解质形成溶液后导电能力增强。请通过实验判断下列溶液的导电能力是否相同。
实验
在四个烧杯中分别盛有等体积、等浓度(0.5mol·L-1)的盐酸、氨水、CH3COOH溶液、NaCl溶液,按图3-1-1所示装置连接仪器,接通电源,注意观察灯泡的亮度。
电解质溶液的导电能力一样吗
实验现象
实验结论
在体积和浓度相同的条件下,盐酸、NaCl 溶液的灯泡亮度比CH3COOH溶液、氨水的亮。
在体积和浓度相同的条件下,盐酸、NaCl 溶液的导电能力比CH3COOH溶液、氨水的强。
2.浓度相同的不同电解质的水溶液的导电能力不同,其原因是什么?
1、电解质溶液导电的本质是什么?浓度相同的四组溶液的灯泡亮度不同的原因是什么?
溶液的导电能力强弱不同
溶液中自由移动的离子浓度大小不同
溶液中存在能够自由移动的离子
灯泡的亮度
3.浓度相同的不同电解质的水溶液的自由离子浓度不同,其原因是什么?
溶液的导电能力
溶液中自由移动的阴阳离子浓度
电解质的电离程度大小
相同浓度的电解质的强弱
电解质的电离程度大小不同
总结
4.氯化氢、醋酸等电解质溶于水过程中发生了哪些变化?它们最终以何种形态存在?
氯化氢、醋酸等电解质在溶于水以后,都会电离,但是电解质的电离程度大小不同,氯化氢全部电离,醋酸部分电离。
HCI和CH3COOH电离情况的比较
HCI存在形态
CH3COOH存在形态
CH3COOH分子、H+、CH3COO-
H+、Cl-
二、电解质在水溶液中的存在形态
在稀的水溶液中能完全电离的电解质
强酸、强碱、大多数盐属于强电解质
在溶于水时部分电离的电解质
弱酸、弱碱、水属于弱电解质
常见强酸:
常见强碱:
常见弱酸:
常见弱碱:
HCl、HNO3、H2SO4、HClO4、HBr、HI
NaOH、KOH、Ca(OH)2、Ba(OH)2
H2CO3、HClO、H2SO3、CHCOOH、HF、H2S
NH3·H2O、Cu(OH)2、Fe(OH)3等
电解质判断注意事项
(1)电解质包括酸、碱、绝大多数盐、活泼金属氧化物、水等
(2)活泼金属氧化物是电解质,是因其在熔融时电离
(3) 必须是自身电离出离子的化合物才是电解质
(4) 单质和混合物既不是电解质,也不是非电解质
强弱电解质判断注意
(1)电解质的强弱与溶液的导电性和溶解度无直接关系
溶液的导电能力取决于自由离子浓度和离子所带电荷,强电解质溶液中离子浓度不一定大,溶液的导电能力不一定强。
(2)电解质的强弱与电解质的溶解性大小没有直接关系
溶解度很小的电解质只要溶于水的部分完全电离就是强电解质。如碳酸钙难溶于水为强电解质;但氟化氢易溶于水,为弱电解质。
【理解应用】
1.正误判断
(1)强电解质溶液的导电能力不一定强( )
(2)某些难溶盐,虽然溶于水的部分完全电离,但其溶解度小,属于弱电解质,如BaSO4等( )
(3)强电解质一定是离子化合物( )
(4)若电解质为离子化合物,在熔融状态能电离,若电解质为共价化合物,在液态不电离( )
√
√
×
×
2.下列物质中,属于电解质的是________ (填序号,下同),
属于强电解质的是______,属于弱电解质的是________。
①HClO4 ②盐酸 ③氯气 ④CH3COONH4 ⑤乙醇 ⑥硫酸 ⑦H2SO3 ⑧熔融Ba(OH)2 ⑨HCl ⑩氨气 CO2
【答案】①④⑥⑦⑧⑨ ①④⑥⑧⑨ ⑦
强电解质:完全电离 ,用“=”
弱电解质:不完全电离,用“ ”
HCl = H+ + Cl-
NaCl = Na+ + Cl-
CH3COOH H+ + CH3COO-
NH3 H2O NH4+ + OH-
(1)多元弱酸:分步电离,电离程度逐步减弱,必须分步书写
如H2CO3:H2CO3 H++HCO3 -(主)
HCO3- H++CO(次)
(2)多元弱碱:分步进行的,但一般按一步电离的形式书写
如Fe(OH)3:Fe(OH)3 Fe3++3OH-
NaHSO4:水溶液中,NaHSO4=Na++H++SO42-
熔融状态,NaHSO4=Na++HSO42-
多元弱酸、弱碱的电离
拓展延伸
酸式盐电离方程式的书写
(1) Cu(OH)2 _____________________________
(2) Ca(OH)2 _____________________________
(3)HClO______________________________
(4)H2SO4 _______________________________
(5) NaHSO4 ____________________________
(6) NaHCO3 ____________________________
(7) CaCO3 ____________________________
写出下列物质的电离方程式
【理解应用】
(1)NaHSO4电离要注意是在水溶液里,还是熔融状态。
(2)只含共价键的电解质只有在水溶液里才能发生电离(H2O除外),液态和熔融状态均不电离。
(3)弱酸的酸式盐第一步是盐的完全电离,第二步是弱酸酸根的部分电离,容易出错。
视野拓展
电解质溶于水后形成的离子或分子并不是单独存在的,而是与水分子相互吸引、相互结合,以“水合分子”或“水合离子”的形态存在。这种溶质分子或离子与溶剂相互吸引的作用叫作
溶剂化作用。
课堂小结
Kw=C平(H+)×C平(OH-)
温度、加酸、加碱
=
【课堂检测】
1.纯水在25 ℃和80 ℃时的c平(H+)前后两个量的大小关系是( )
A.大于 B.等于 C.小于 D.不能确定
2.室温下某溶液中由水电离产生的c(H+)=1×10-10 mol·L-1,该溶液不可能是( ) A. NaHSO4 B. NaCl C. HCl D. Ba(OH)2
此时C(H+)<常温下纯水电离出的C(H+),说明水的电离受到了抑制, NaHSO4、 HCl、 Ba(OH)2对水的电离都起到抑制作用
3.在不同温度下的水溶液中c平(H+)与c平(OH-)的关系如图所示。请回答下列问题:
(1)曲线Ⅰ代表的温度下,水的离子积为_____,
曲线Ⅰ所代表的温度________(填“高于”“低于”
或“等于”)曲线Ⅱ所代表的温度。你判断的依据
是______________________________________________ 。
(2)曲线Ⅰ所代表的温度下,0.01 mol·L-1的NaOH溶液的c平(H+)为________ mol·L-1。
(3)向盐酸中逐滴加入NaOH溶液至过量,水的电离平衡移动方向为 。
(1)1×10-12 mol2·L-2 高于 曲线Ⅱ所代表的水的离子积比曲线Ⅰ的小,由于水的电离过程是吸热过程,温度越高,离子积越大,故曲线Ⅱ代表的温度低
(2)10-10 中和前先向右移动,中和后向左移动
第1节 水与水溶液
第3章 物质在水溶液中的行为
知识回顾
1.电解质: 或 能导电的 。
非电解质: 和 均不能导电的 。
溶于水
熔融状态
溶于水
熔融状态
化合物
化合物
电解质:酸、碱、盐、活泼金属氧化物、水
非电解质:多数有机物,非金属氧化物、部分氢化物
电解质溶液(如盐酸、CH3COOH溶液等)能够导电。那么,纯水能导电吗 为了研究这个问题,有人曾经用经过很多次纯化处理所制得的纯水进行导电性实验。结果发现其仍具有微弱的导电性,经分析得知纯水中存在氢离子和氢氧根离子。请写出水电离的方程式,并分析水的电离特点。
联想质疑
(2)电离特点
①水的电离为可逆过程 ②水的电离程度很微弱
③水的电离为吸热过程 ④水电离出的c平(H+)=c平(OH-)
1.水的电离
(1)水是一种极弱的电解质,能微弱电离,存在电离平衡
25℃纯水中:c平(H+)=c平(OH-)=
1.0×10-7mol·L-1
一、水的电离及水的离子积常数
Kw = C平(H+) × C平(OH-)
一定温度下,水电离出的H+和OH-浓度的乘积为一定值,称为水的离子积常数(Kw),简称水的离子积
Kw =
25℃时
1×10-14 mol2 L-2
(室温)
一定温度下,Kw是一个常数
Kw只与温度有关!
增大
为什么?
H2O(l) H+(aq) + OH-(aq)
H>0
t/℃ KW/mol2 L-2
25 1.0×10-14
55 7.3×10-14
80 2.5×10-13
100 5.5×10-13
结论:
1. Kw只与温度有关,温度越高,Kw越大
2.水的电离是一个吸热过程,升高温度,促进水的电离
温度升高,Kw
不同温度下水的离子积常数
注意
(1)Kw只是温度的函数,一定温度下Kw是一个常数。25℃时,Kw=10-14
(2)Kw只随温度的升高而增大,与c(H+) 、 c(OH-)无关。
(3)Kw适用于一定温度下任何稀的电解质溶液。
(4)在任何水溶液中,均存在水的电离平衡,也就是任何水溶液中都是H+、OH-共存的。
【理解应用】
1.25℃时,若某稀盐酸中,c平(H+)=1.0×10-4 mol·L-1,则溶液中c平(OH-)为 mol·L-1。
1.0×10-10
不同溶液中的c(H+) 、 c(OH-)可能不同,但是水电离出的c(H+)水与c(OH-)水相等
公式中[H+]、[OH-]均指溶液中总物质的量浓度
Kw = c平(H+) c平(OH-)
①纯水中,Kw= c(H+)水c(OH-)水
③稀碱溶液中,OH-来源于碱和水的电离,而H+只来源于水。c水(OH-)=c平(H+)。 25℃时,若碱电离出的c平(OH-)碱 >10-5 mol·L-1,则忽略水的电离。如0.1 mol·L-1的NaOH溶液中
c水(OH-)=c平(H+)=1×10-13 mol·L-1
②稀酸溶液中,H+来源于酸和水的电离,而OH-只来源于水,c水(H+)=c平(OH-)。25℃时,若酸电离出的c平(H+)酸 >10-5 mol·L-1,则忽略水的电离。如0.1 mol·L-1的HCl溶液中
c水(H+)=c平(OH-)=1×10-13 mol·L-1
拓展延伸
Kw= c(H+)酸c(OH-)水(忽略水电离的H+)
Kw= c(H+)水c(OH-)碱(忽略水电离的OH-)
常温下:
1、纯水中c(H+) =___________,c(OH—) =___________,
2、NaCl溶液中c(H+)=__________, c(OH—)=_________,
3、0.02mol/LHCl溶液,
c(H+)=__________,c(OH—)=___________
c(H+)水 =____________, c(OH—)水 =_____________
1×10-7mol/L
1×10-7mol/L
1×10-7mol/L
1×10-7mol/L
0.02mol/L
5×10-13mol/L
5×10-13mol/L
5×10-13mol/L
4、0.5mol/LBa(OH)2溶液,
c(H+)=______________,c(OH—)=___________,
c(H+)水 =____________, c(OH—)水 =_____________
1.0 mol/L
1×10-14mol/L
1×10-14mol/L
1×10-14mol/L
【归纳总结】
1.在不同溶液中,c平(H+)、c平(OH-)可能不同,但由水电离出的
c平(H+)与c平(OH-)总是相等的。
2.稀酸溶液中,c(OH-)水=c平(OH-)溶液
稀碱溶液中,c(H+)水=c平(H+)溶液
3、外界条件对水的电离平衡的影响
条件 平衡移动方向 [H+] [OH-]
Kw 电离被促进or被抑制?
升温
降温
滴加HCl溶液
滴加NaOH溶液
加金属Na,反应后并恢复室温
H2O(l) H+(aq) + OH-(aq)
→
←
↓
↑
↑
↑
促进
↓
↓
抑制
↑
←
↓
不变
抑制
↑
←
↓
不变
抑制
↓
→
↑
不变
促进
促进水的电离:升温、加入能消耗H+或OH-的物质
抑制水的电离:降温、加入酸(或强酸的酸式盐)、加入碱
加碱
加酸
盐类水解(第2节再介绍)
升高温度
抑制水电离
促进水电离
其他:加活泼金属(如Na、K等)
降低温度
归纳总结
迁移应用
判断下列说法是否正确
(1) 水的离子积常数Kw=10-14
(2) 温度升高,纯水中的c平(H+)增大,c平(OH-)减小
(3) 水的电离程度很小,纯水中主要存在形态是水分子
(4) 在纯水中加入少量硫酸铵,可促进水的电离,使水的离子积增大
(5) 不管是纯水还是在酸、碱、盐溶液中,水电离产生的C平(H+)和C平(OH-)始终相等。
×
√
×
×
√
水的电离程度很小,其主要存在形态是水分子,因此纯水的导电能力很弱。加入电解质后导电能力增强,不同的电解质其导电能力是否相同?影响溶液导电性因素是什么?
联想质疑
溶液导电性
自由移动离子浓度大小
离子所带电荷
观察思考
纯水的导电能力非常弱,但是向其中加入电解质形成溶液后导电能力增强。请通过实验判断下列溶液的导电能力是否相同。
实验
在四个烧杯中分别盛有等体积、等浓度(0.5mol·L-1)的盐酸、氨水、CH3COOH溶液、NaCl溶液,按图3-1-1所示装置连接仪器,接通电源,注意观察灯泡的亮度。
电解质溶液的导电能力一样吗
实验现象
实验结论
在体积和浓度相同的条件下,盐酸、NaCl 溶液的灯泡亮度比CH3COOH溶液、氨水的亮。
在体积和浓度相同的条件下,盐酸、NaCl 溶液的导电能力比CH3COOH溶液、氨水的强。
2.浓度相同的不同电解质的水溶液的导电能力不同,其原因是什么?
1、电解质溶液导电的本质是什么?浓度相同的四组溶液的灯泡亮度不同的原因是什么?
溶液的导电能力强弱不同
溶液中自由移动的离子浓度大小不同
溶液中存在能够自由移动的离子
灯泡的亮度
3.浓度相同的不同电解质的水溶液的自由离子浓度不同,其原因是什么?
溶液的导电能力
溶液中自由移动的阴阳离子浓度
电解质的电离程度大小
相同浓度的电解质的强弱
电解质的电离程度大小不同
总结
4.氯化氢、醋酸等电解质溶于水过程中发生了哪些变化?它们最终以何种形态存在?
氯化氢、醋酸等电解质在溶于水以后,都会电离,但是电解质的电离程度大小不同,氯化氢全部电离,醋酸部分电离。
HCI和CH3COOH电离情况的比较
HCI存在形态
CH3COOH存在形态
CH3COOH分子、H+、CH3COO-
H+、Cl-
二、电解质在水溶液中的存在形态
在稀的水溶液中能完全电离的电解质
强酸、强碱、大多数盐属于强电解质
在溶于水时部分电离的电解质
弱酸、弱碱、水属于弱电解质
常见强酸:
常见强碱:
常见弱酸:
常见弱碱:
HCl、HNO3、H2SO4、HClO4、HBr、HI
NaOH、KOH、Ca(OH)2、Ba(OH)2
H2CO3、HClO、H2SO3、CHCOOH、HF、H2S
NH3·H2O、Cu(OH)2、Fe(OH)3等
电解质判断注意事项
(1)电解质包括酸、碱、绝大多数盐、活泼金属氧化物、水等
(2)活泼金属氧化物是电解质,是因其在熔融时电离
(3) 必须是自身电离出离子的化合物才是电解质
(4) 单质和混合物既不是电解质,也不是非电解质
强弱电解质判断注意
(1)电解质的强弱与溶液的导电性和溶解度无直接关系
溶液的导电能力取决于自由离子浓度和离子所带电荷,强电解质溶液中离子浓度不一定大,溶液的导电能力不一定强。
(2)电解质的强弱与电解质的溶解性大小没有直接关系
溶解度很小的电解质只要溶于水的部分完全电离就是强电解质。如碳酸钙难溶于水为强电解质;但氟化氢易溶于水,为弱电解质。
【理解应用】
1.正误判断
(1)强电解质溶液的导电能力不一定强( )
(2)某些难溶盐,虽然溶于水的部分完全电离,但其溶解度小,属于弱电解质,如BaSO4等( )
(3)强电解质一定是离子化合物( )
(4)若电解质为离子化合物,在熔融状态能电离,若电解质为共价化合物,在液态不电离( )
√
√
×
×
2.下列物质中,属于电解质的是________ (填序号,下同),
属于强电解质的是______,属于弱电解质的是________。
①HClO4 ②盐酸 ③氯气 ④CH3COONH4 ⑤乙醇 ⑥硫酸 ⑦H2SO3 ⑧熔融Ba(OH)2 ⑨HCl ⑩氨气 CO2
【答案】①④⑥⑦⑧⑨ ①④⑥⑧⑨ ⑦
强电解质:完全电离 ,用“=”
弱电解质:不完全电离,用“ ”
HCl = H+ + Cl-
NaCl = Na+ + Cl-
CH3COOH H+ + CH3COO-
NH3 H2O NH4+ + OH-
(1)多元弱酸:分步电离,电离程度逐步减弱,必须分步书写
如H2CO3:H2CO3 H++HCO3 -(主)
HCO3- H++CO(次)
(2)多元弱碱:分步进行的,但一般按一步电离的形式书写
如Fe(OH)3:Fe(OH)3 Fe3++3OH-
NaHSO4:水溶液中,NaHSO4=Na++H++SO42-
熔融状态,NaHSO4=Na++HSO42-
多元弱酸、弱碱的电离
拓展延伸
酸式盐电离方程式的书写
(1) Cu(OH)2 _____________________________
(2) Ca(OH)2 _____________________________
(3)HClO______________________________
(4)H2SO4 _______________________________
(5) NaHSO4 ____________________________
(6) NaHCO3 ____________________________
(7) CaCO3 ____________________________
写出下列物质的电离方程式
【理解应用】
(1)NaHSO4电离要注意是在水溶液里,还是熔融状态。
(2)只含共价键的电解质只有在水溶液里才能发生电离(H2O除外),液态和熔融状态均不电离。
(3)弱酸的酸式盐第一步是盐的完全电离,第二步是弱酸酸根的部分电离,容易出错。
视野拓展
电解质溶于水后形成的离子或分子并不是单独存在的,而是与水分子相互吸引、相互结合,以“水合分子”或“水合离子”的形态存在。这种溶质分子或离子与溶剂相互吸引的作用叫作
溶剂化作用。
课堂小结
Kw=C平(H+)×C平(OH-)
温度、加酸、加碱
=
【课堂检测】
1.纯水在25 ℃和80 ℃时的c平(H+)前后两个量的大小关系是( )
A.大于 B.等于 C.小于 D.不能确定
2.室温下某溶液中由水电离产生的c(H+)=1×10-10 mol·L-1,该溶液不可能是( ) A. NaHSO4 B. NaCl C. HCl D. Ba(OH)2
此时C(H+)<常温下纯水电离出的C(H+),说明水的电离受到了抑制, NaHSO4、 HCl、 Ba(OH)2对水的电离都起到抑制作用
3.在不同温度下的水溶液中c平(H+)与c平(OH-)的关系如图所示。请回答下列问题:
(1)曲线Ⅰ代表的温度下,水的离子积为_____,
曲线Ⅰ所代表的温度________(填“高于”“低于”
或“等于”)曲线Ⅱ所代表的温度。你判断的依据
是______________________________________________ 。
(2)曲线Ⅰ所代表的温度下,0.01 mol·L-1的NaOH溶液的c平(H+)为________ mol·L-1。
(3)向盐酸中逐滴加入NaOH溶液至过量,水的电离平衡移动方向为 。
(1)1×10-12 mol2·L-2 高于 曲线Ⅱ所代表的水的离子积比曲线Ⅰ的小,由于水的电离过程是吸热过程,温度越高,离子积越大,故曲线Ⅱ代表的温度低
(2)10-10 中和前先向右移动,中和后向左移动
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
