鲁科版高中化学选择性必修1第3章物质在水溶液中的行为3.2.3盐类的水解平衡的移动教学课件
文档属性
| 名称 | 鲁科版高中化学选择性必修1第3章物质在水溶液中的行为3.2.3盐类的水解平衡的移动教学课件 |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-09 20:57:29 | ||
图片预览



文档简介
(共18张PPT)
第3章 物质在水溶液中的行为
第2节 弱电解质的电离 盐类的水解
第3课时 盐类水解平衡的移动 盐类水解的应用
盐类水解平衡的移动 盐类水解的应用
学习目标:
1.掌握盐类水解平衡的影响因素
2.掌握盐类水解的应用
一、水解平衡的移动
2、课本第103页 活动·探究:通过研讨,
你认为影响盐类水解的因素有哪些?
1、在常温下,pH=9的NaOH和CH3COONa两种溶液中 ,设由水电离产生的OH-浓度分别为a和b,则a与b的关系为
A、a>b B、a=10-4b
C、b=10-4a D、a=b
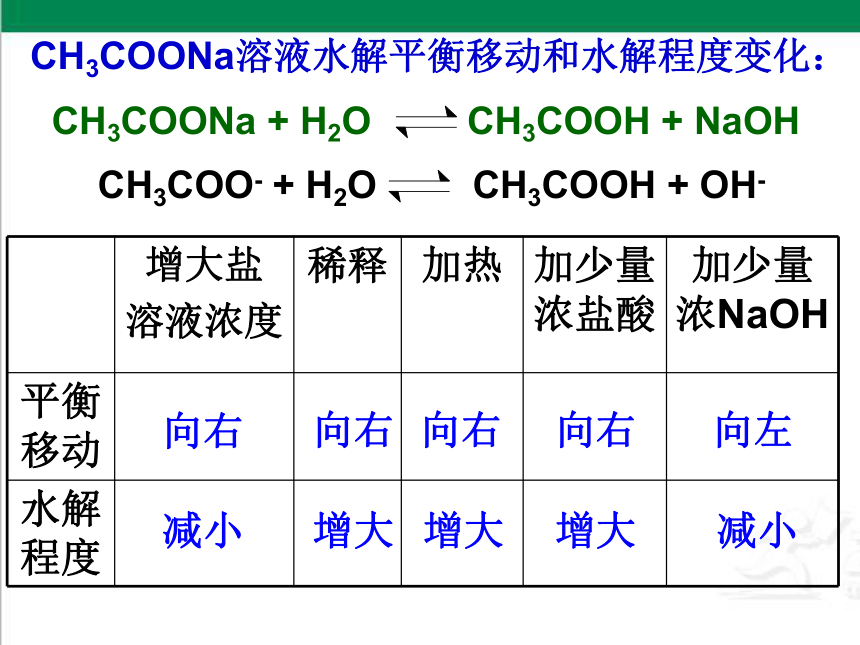
增大盐
溶液浓度 稀释 加热 加少量浓盐酸 加少量浓NaOH
平衡移动
水解程度
CH3COONa溶液水解平衡移动和水解程度变化:
向右
减小
向右
增大
向右
向左
向右
增大
增大
减小
CH3COONa + H2O CH3COOH + NaOH
CH3COO- + H2O CH3COOH + OH-
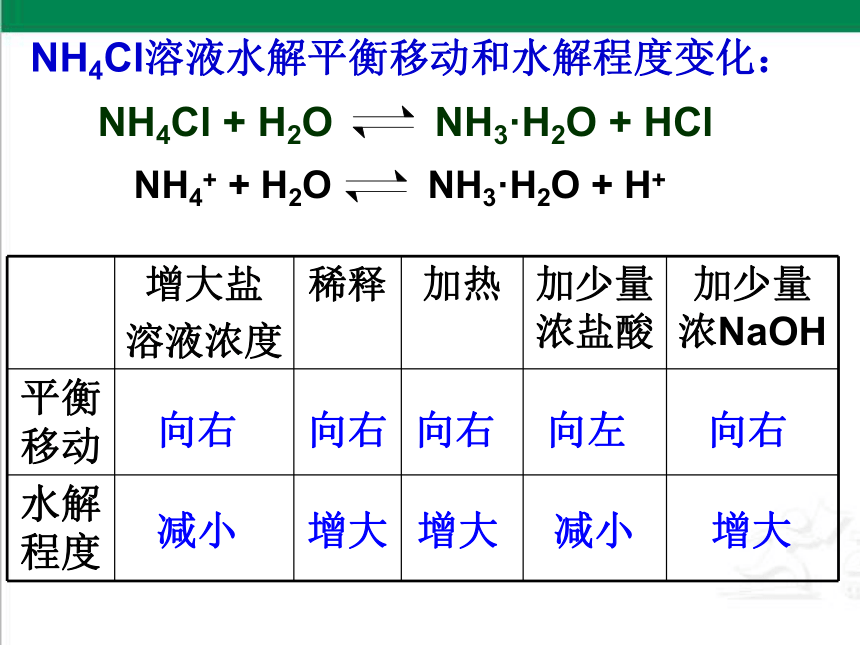
增大盐
溶液浓度 稀释 加热 加少量浓盐酸 加少量浓NaOH
平衡移动
水解程度
NH4Cl溶液水解平衡移动和水解程度变化:
向右
减小
向右
增大
向右
向左
向右
增大
增大
减小
NH4Cl + H2O NH3·H2O + HCl
NH4+ + H2O NH3·H2O + H+
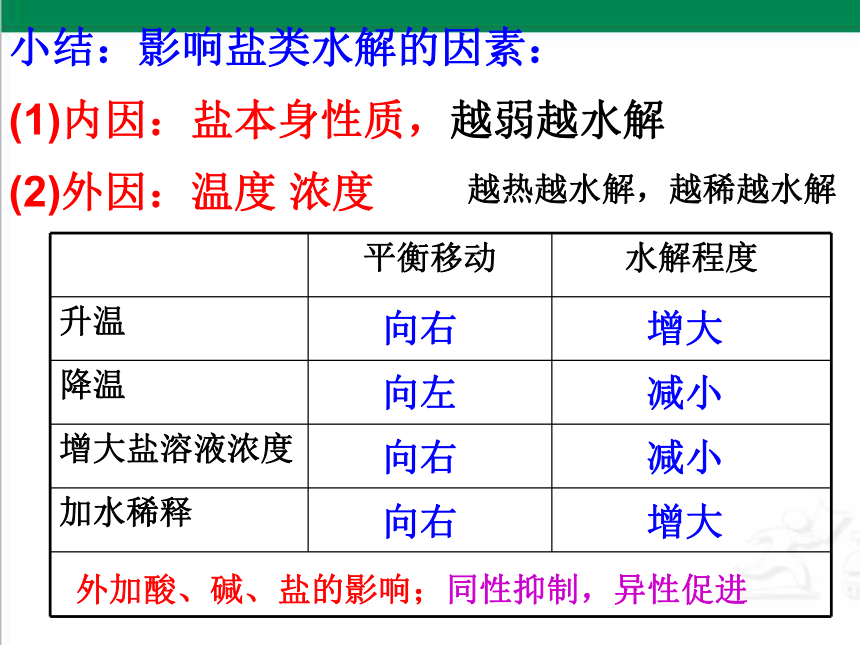
小结:影响盐类水解的因素:
(1)内因:盐本身性质,越弱越水解
(2)外因:温度 浓度
平衡移动 水解程度
升温
降温
增大盐溶液浓度
加水稀释
向右
增大
向左
减小
向右
向右
减小
增大
外加酸、碱、盐的影响;同性抑制,异性促进
越热越水解,越稀越水解
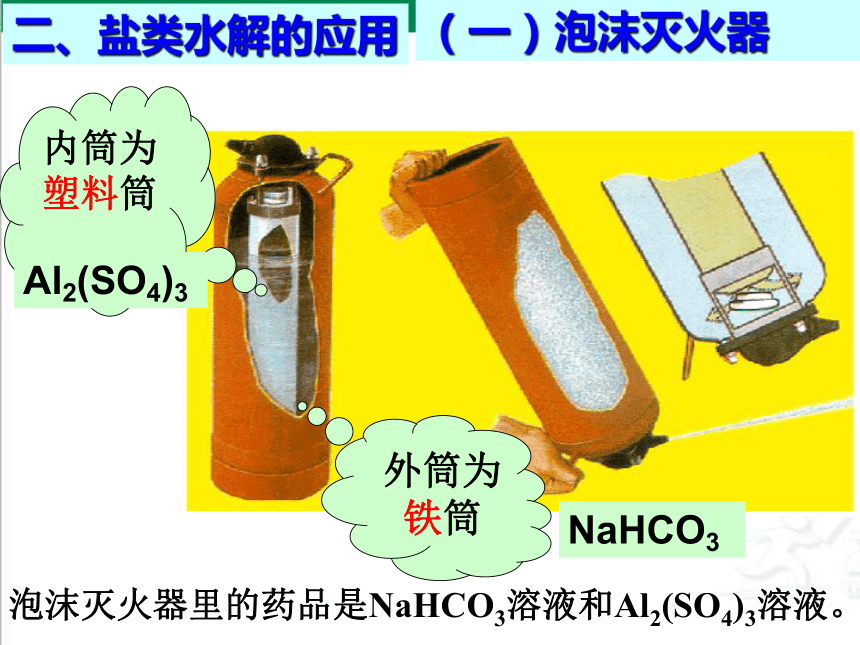
内筒为塑料筒
泡沫灭火器里的药品是NaHCO3溶液和Al2(SO4)3溶液。
(一)泡沫灭火器
NaHCO3
Al2(SO4)3
外筒为铁筒
二、盐类水解的应用
总式:Al3++3HCO3- = Al(OH)3↓+3CO2↑
完全双水解进行得非常充分,故用“=”连接,且标注“↑”、“↓”符号。
Al3+与S2-在水溶液中能共存吗?
应用:制备Al2S3不能在水溶液中进行。应用Al粉和硫粉直接加热。
泡沫灭火器能快速生成CO2气体和Al(OH)3沉淀。分析Al3+、HCO3-将会发生的反应。
Al3++3H2O Al(OH)3+3H+,
HCO3-+H2O H2CO3 +OH-,
能发生完全双水解的离子:Al3+与[Al(OH)4]-、HCO3-、CO32-、S2- ;Fe3+与HCO3-、CO32-
双水解方程式书写步骤:
1.找出能发生水解的离子(先不要写水),对应写出相应的弱酸和弱碱(或沉淀和气体),一般用“ ”,完全用“=”“↑”“↓”。
2.电荷守恒法配平。
3.补水。
练习:①Al3+与S2- ②Al3+与[Al(OH)4]-
③Fe3+与HCO3- ④ Fe3+与CO32-
⑤CH3COO-与NH4+
一般双水解比单一离子水解程度大,但仍然微弱,离子可以大量共存
完全双水解进行得非常充分,可生成沉淀和气体,离子不能大量共存
(二)水解反应的应用-制备胶体、净水、除污
教材P105活动探究,总结盐类的水解有哪些应用。
1、制备胶体(Fe3+的水解)
2、净水
3、除污
水解原理的应用(二)
完成教材P105“活动·探究”
1、配制和保存易水解的盐溶液
Fe3++3H2O Fe(OH)3+3H+ △H>0
配制Fe2(SO4)3溶液,要先加少量的稀H2SO4。
[小结]:配制易水解的金属盐溶液应加少量的______
相应的酸
(三)水解反应的应用--化学实验中的盐类水解
思考:1.如何用FeCl3固体配制FeCl3溶液?
先将FeCl3溶于浓盐酸中,再加水稀释至所需溶液。
2、碳酸钠溶液保存不能用玻璃塞?
思考:粗铜精炼的电解质溶液是什么?
H2SO4酸化的CuSO4
4、水解除杂(常考)
除去CuCl2溶液中混有的Fe3+杂质,可选用( )
A.Cu B.NaOH C.NH3 H2O D.CuO
Fe3++3H2O Fe(OH)3+3H+ ,加入CuO或Cu(OH)2或CuCO3,消耗水解产生的H+,平衡正移,使Fe3+转化为Fe(OH)3沉淀过滤除去。
3、离子共存
5、制备胶体
6、制备无水盐
草木灰不宜与铵态氮肥混合施用:
草木灰的成分:K2CO3,水解呈碱性
CO32-+H2O HCO3- +OH-,
HCO3-+H2O H2CO3 +OH-,
铵态氮肥——铵盐,水解呈酸性。
NH4++H2O NH3·H2O+ H+,
混施后,OH-与H+中和成水,两种盐水解相互促进,平衡向右移动,以致生成NH3·H2O,在阳光照射下进一步分解成NH3逸出,从而降低了肥效。
7、解释生活现象
8、蒸干盐溶液所得物质的判断规律
①考虑盐是否分解。如加热蒸干Ca(HCO3)2,因其分解,所得固体应是CaCO3。
②考虑氧化还原反应。如加热蒸干Na2SO3溶液,因Na2SO3易被氧化,所得固体应是Na2SO4。
③盐水解生成挥发性酸时,蒸干后一般得到弱碱,如蒸干AlCl3溶液,得Al(OH)3。盐水解生成不挥发性酸,蒸干后一般仍为原物质。如Al2(SO4)3
④盐水解生成强碱时,蒸干后一般得到原物质。如Na2CO3等。
1. AlCl3、CuCl2、MgCl2
2. CuSO4
3. Na2CO3
Na2CO3+H2O NaHCO3+NaOH
4. Na[Al(OH)4]
Na[Al(OH)4] Al(OH)3+NaOH
5. NaHCO3
NaHCO3+H2O H2CO3+NaOH
6.KMnO4
7.Na2SO3
氢氧化物 氧化物
CuSO4·5H2O CuSO4
Na2CO3·10H2O Na2CO3
Na[Al(OH)4]
Na2CO3
K2MnO4 MnO2
Na2SO4
例:Al2(SO4)3溶液加热蒸发后得到固体是什么?
判断下列盐溶液加热蒸干、灼烧后的产物:
书写离子浓度大小、电荷守恒、物料守恒、质子守恒。
1. CH3COONa
2. NH4Cl
3. Na2CO3(Na2S类似)
4. NaHCO3(显碱性,HCO3-的水解>电离)
5. NaHSO3 (显酸性,HSO3-的电离>水解)
6. 等浓度的CH3COOH与CH3COONa (显酸性,CH3COOH的电离>CH3COO-的水解)
7.等浓度的Na2CO3与NaHCO3
5min默写
1、书写下列原理中的水解离子方程式
①泡沫灭火器原理
②纯碱去油污
③Fe(OH)3胶体的制备
④明矾净水
⑤Al2S3不能由水溶液中反应制得
⑥CH3COONH4
2、将下列盐溶液加热蒸干灼烧最后得到什么固体?
①AlCl3 ②Fe2(SO4)3 ③Na2CO3
④Na[Al(OH)4] ⑤NaHCO3
第3章 物质在水溶液中的行为
第2节 弱电解质的电离 盐类的水解
第3课时 盐类水解平衡的移动 盐类水解的应用
盐类水解平衡的移动 盐类水解的应用
学习目标:
1.掌握盐类水解平衡的影响因素
2.掌握盐类水解的应用
一、水解平衡的移动
2、课本第103页 活动·探究:通过研讨,
你认为影响盐类水解的因素有哪些?
1、在常温下,pH=9的NaOH和CH3COONa两种溶液中 ,设由水电离产生的OH-浓度分别为a和b,则a与b的关系为
A、a>b B、a=10-4b
C、b=10-4a D、a=b
增大盐
溶液浓度 稀释 加热 加少量浓盐酸 加少量浓NaOH
平衡移动
水解程度
CH3COONa溶液水解平衡移动和水解程度变化:
向右
减小
向右
增大
向右
向左
向右
增大
增大
减小
CH3COONa + H2O CH3COOH + NaOH
CH3COO- + H2O CH3COOH + OH-
增大盐
溶液浓度 稀释 加热 加少量浓盐酸 加少量浓NaOH
平衡移动
水解程度
NH4Cl溶液水解平衡移动和水解程度变化:
向右
减小
向右
增大
向右
向左
向右
增大
增大
减小
NH4Cl + H2O NH3·H2O + HCl
NH4+ + H2O NH3·H2O + H+
小结:影响盐类水解的因素:
(1)内因:盐本身性质,越弱越水解
(2)外因:温度 浓度
平衡移动 水解程度
升温
降温
增大盐溶液浓度
加水稀释
向右
增大
向左
减小
向右
向右
减小
增大
外加酸、碱、盐的影响;同性抑制,异性促进
越热越水解,越稀越水解
内筒为塑料筒
泡沫灭火器里的药品是NaHCO3溶液和Al2(SO4)3溶液。
(一)泡沫灭火器
NaHCO3
Al2(SO4)3
外筒为铁筒
二、盐类水解的应用
总式:Al3++3HCO3- = Al(OH)3↓+3CO2↑
完全双水解进行得非常充分,故用“=”连接,且标注“↑”、“↓”符号。
Al3+与S2-在水溶液中能共存吗?
应用:制备Al2S3不能在水溶液中进行。应用Al粉和硫粉直接加热。
泡沫灭火器能快速生成CO2气体和Al(OH)3沉淀。分析Al3+、HCO3-将会发生的反应。
Al3++3H2O Al(OH)3+3H+,
HCO3-+H2O H2CO3 +OH-,
能发生完全双水解的离子:Al3+与[Al(OH)4]-、HCO3-、CO32-、S2- ;Fe3+与HCO3-、CO32-
双水解方程式书写步骤:
1.找出能发生水解的离子(先不要写水),对应写出相应的弱酸和弱碱(或沉淀和气体),一般用“ ”,完全用“=”“↑”“↓”。
2.电荷守恒法配平。
3.补水。
练习:①Al3+与S2- ②Al3+与[Al(OH)4]-
③Fe3+与HCO3- ④ Fe3+与CO32-
⑤CH3COO-与NH4+
一般双水解比单一离子水解程度大,但仍然微弱,离子可以大量共存
完全双水解进行得非常充分,可生成沉淀和气体,离子不能大量共存
(二)水解反应的应用-制备胶体、净水、除污
教材P105活动探究,总结盐类的水解有哪些应用。
1、制备胶体(Fe3+的水解)
2、净水
3、除污
水解原理的应用(二)
完成教材P105“活动·探究”
1、配制和保存易水解的盐溶液
Fe3++3H2O Fe(OH)3+3H+ △H>0
配制Fe2(SO4)3溶液,要先加少量的稀H2SO4。
[小结]:配制易水解的金属盐溶液应加少量的______
相应的酸
(三)水解反应的应用--化学实验中的盐类水解
思考:1.如何用FeCl3固体配制FeCl3溶液?
先将FeCl3溶于浓盐酸中,再加水稀释至所需溶液。
2、碳酸钠溶液保存不能用玻璃塞?
思考:粗铜精炼的电解质溶液是什么?
H2SO4酸化的CuSO4
4、水解除杂(常考)
除去CuCl2溶液中混有的Fe3+杂质,可选用( )
A.Cu B.NaOH C.NH3 H2O D.CuO
Fe3++3H2O Fe(OH)3+3H+ ,加入CuO或Cu(OH)2或CuCO3,消耗水解产生的H+,平衡正移,使Fe3+转化为Fe(OH)3沉淀过滤除去。
3、离子共存
5、制备胶体
6、制备无水盐
草木灰不宜与铵态氮肥混合施用:
草木灰的成分:K2CO3,水解呈碱性
CO32-+H2O HCO3- +OH-,
HCO3-+H2O H2CO3 +OH-,
铵态氮肥——铵盐,水解呈酸性。
NH4++H2O NH3·H2O+ H+,
混施后,OH-与H+中和成水,两种盐水解相互促进,平衡向右移动,以致生成NH3·H2O,在阳光照射下进一步分解成NH3逸出,从而降低了肥效。
7、解释生活现象
8、蒸干盐溶液所得物质的判断规律
①考虑盐是否分解。如加热蒸干Ca(HCO3)2,因其分解,所得固体应是CaCO3。
②考虑氧化还原反应。如加热蒸干Na2SO3溶液,因Na2SO3易被氧化,所得固体应是Na2SO4。
③盐水解生成挥发性酸时,蒸干后一般得到弱碱,如蒸干AlCl3溶液,得Al(OH)3。盐水解生成不挥发性酸,蒸干后一般仍为原物质。如Al2(SO4)3
④盐水解生成强碱时,蒸干后一般得到原物质。如Na2CO3等。
1. AlCl3、CuCl2、MgCl2
2. CuSO4
3. Na2CO3
Na2CO3+H2O NaHCO3+NaOH
4. Na[Al(OH)4]
Na[Al(OH)4] Al(OH)3+NaOH
5. NaHCO3
NaHCO3+H2O H2CO3+NaOH
6.KMnO4
7.Na2SO3
氢氧化物 氧化物
CuSO4·5H2O CuSO4
Na2CO3·10H2O Na2CO3
Na[Al(OH)4]
Na2CO3
K2MnO4 MnO2
Na2SO4
例:Al2(SO4)3溶液加热蒸发后得到固体是什么?
判断下列盐溶液加热蒸干、灼烧后的产物:
书写离子浓度大小、电荷守恒、物料守恒、质子守恒。
1. CH3COONa
2. NH4Cl
3. Na2CO3(Na2S类似)
4. NaHCO3(显碱性,HCO3-的水解>电离)
5. NaHSO3 (显酸性,HSO3-的电离>水解)
6. 等浓度的CH3COOH与CH3COONa (显酸性,CH3COOH的电离>CH3COO-的水解)
7.等浓度的Na2CO3与NaHCO3
5min默写
1、书写下列原理中的水解离子方程式
①泡沫灭火器原理
②纯碱去油污
③Fe(OH)3胶体的制备
④明矾净水
⑤Al2S3不能由水溶液中反应制得
⑥CH3COONH4
2、将下列盐溶液加热蒸干灼烧最后得到什么固体?
①AlCl3 ②Fe2(SO4)3 ③Na2CO3
④Na[Al(OH)4] ⑤NaHCO3
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
