鲁科版高中化学选择性必修1第3章物质在水溶液中的行为3.4.1离子反应发生的条件教学课件(共18张PPT)
文档属性
| 名称 | 鲁科版高中化学选择性必修1第3章物质在水溶液中的行为3.4.1离子反应发生的条件教学课件(共18张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 957.5KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-09 00:00:00 | ||
图片预览




文档简介
(共18张PPT)
第4节 离子反应
当向水中加入一种电解质时,所形成的水溶液中可能存在电离平衡、水解平衡或沉淀溶解平衡;当向水中加入两种或两种以上电解质时,溶液中的各种离子之间可能发生反应;当向电解质溶液中加入金属单质或通入气体时,电解质电离出的离子与所加物质的原子或分子之间可能发生反应。这些反应都有什么特点 它们为什么会发生 研究这样的反应有什么意义
联想·质疑
交流研讨
1.以下两种物质混合时,溶液中存在哪些离子 哪些离子之间会发生反应 写出有关反应的离子方程式。
(1)Na2SO4溶液与 BaCl2溶液;
(2)石灰乳[Ca(OH) 2浊液】与Na2CO3溶液;
(3)Na2CO3 溶液与盐酸;
(4)盐酸与锌粒;
(5)CH3COONa溶液与盐酸;
(6)KI溶液与溴水。
SO42-+Ba2+==BaSO4↓
Ca(OH) 2+CO32-==CaCO3↓+2OH-
CO32-+2H+==CO2↑+H2O
Zn+2H+==H2↑+Zn2+
CH3COO-+H+==CH3COOH
2I-+Br2==I2+2Br -
交流研讨
2.你学过的离子反应还有哪些 它们各有什么特点 满足哪些条件时离子反应能够发生 为什么在这些条件下离子反应能够发生
离子反应:
离子反应发生条件:
离子反应特点:
溶液中离子之间以及离子与原子或分子之间发生的反应
某种或某些离子浓度的降低
形成沉淀、弱电解质、气体或离子参与氧化还原反应
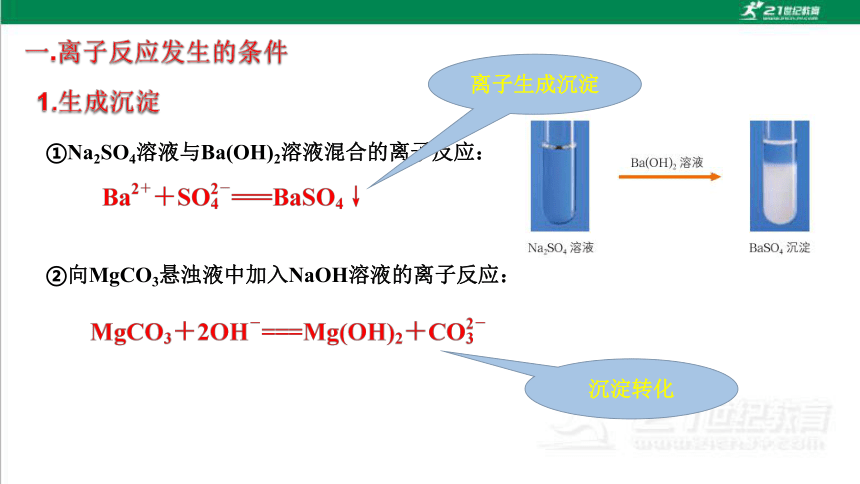
①Na2SO4溶液与Ba(OH)2溶液混合的离子反应:
②向MgCO3悬浊液中加入NaOH溶液的离子反应:
离子生成沉淀
沉淀转化
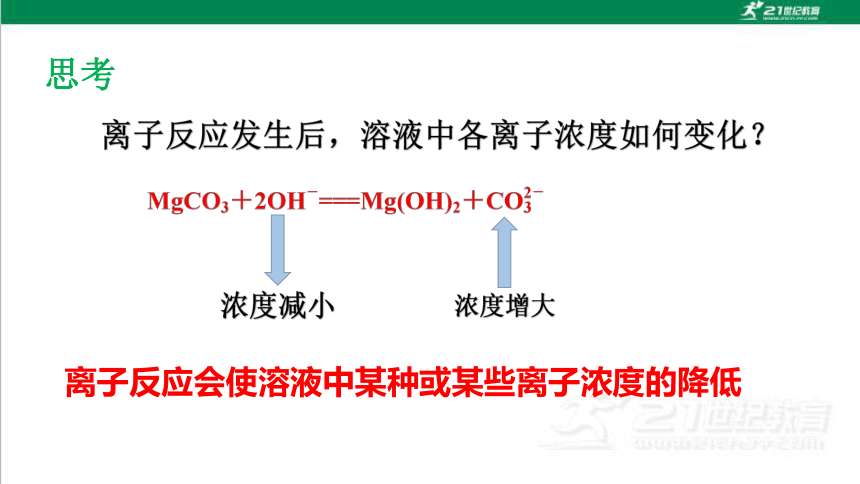
思考
浓度减小
浓度增大
离子反应会使溶液中某种或某些离子浓度的降低
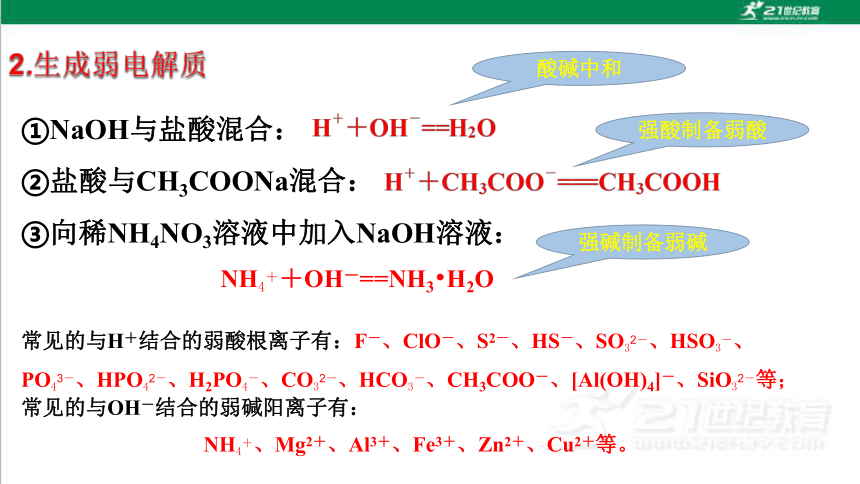
①NaOH与盐酸混合:
②盐酸与CH3COONa混合:
③向稀NH4NO3溶液中加入NaOH溶液:
常见的与H+结合的弱酸根离子有:F-、ClO-、S2-、HS-、SO32-、HSO3-、PO43-、HPO42-、H2PO4-、CO32-、HCO3-、CH3COO-、[Al(OH)4]-、SiO32-等;
常见的与OH-结合的弱碱阳离子有:
NH4+、Mg2+、Al3+、Fe3+、Zn2+、Cu2+等。
NH4++OH-==NH3 H2O
强酸制备弱酸
强碱制备弱碱
酸碱中和
①Na2CO3溶液与稀硫酸混合:
②浓NH4NO3溶液中加入浓NaOH溶液:
NH4++OH-==NH3↑+H2O。
CO32-+2H+===H2O+CO2↑
常见生成气体或挥发性物质的离子反应:
H+与CO32-、SO32-、S2-、HS-、HSO3-、HCO3-等;
OH-与NH4+。
归纳总结
NH4++OH-==NH3↑+H2O。
NH4++OH-==NH3 H2O。
稀NH4NO3溶液与稀NaOH溶液:
浓NH4NO3溶液与浓NaOH溶液:
①氧化性离子与还原性离子的反应
5Fe2++MnO4-+8H+===5Fe3++Mn2++4H2O
Zn+Cu2+===Zn2++Cu
Zn+2H+===Zn2++H2↑
2Fe3++Cu==2Fe2++Cu2+
2Fe2++Cl2==2Fe3++2Cl-
Br2+2I-===2Br-+I2
②有离子参加的氧化还原反应
在溶液中,具有氧化性和还原性的离子相遇时,二者能发生氧化还原反应而使离子浓度降低。
③原电池中发生的氧化还原反应的离子反应
④电解池中发生的氧化还原反应的离子反应
铜锌原电池反应的离子方程式:Zn+Cu2+===Zn2++Cu
电解饱和食盐水的离子方程式:2Cl-+2H2O=====2OH-+H2↑+Cl2↑
通电
(1)MnO4-(H+)与Cl-、Br-、I-、S2-、HS-、SO32-、HSO3-、Fe2+等。
(2)NO3-(H+)与Br-、I-、S2-、HS-、SO32-、HSO3-、Fe2+等。
(3)ClO-与Br-、I-、S2-、HS-、SO32-、HSO3-、Fe2+等。
(4)Fe3+与I-、S2-、HS-、SO32-、HSO3-等。
归纳总结
常见发生氧化还原反应的离子
回顾思考
除以上离子反应类型外,你还知道哪些离子反应类型?
Al3++3HCO3-==Al(OH)3↓+3CO2↑
Fe3++3SCN-==Fe(SCN)3;
Ag++2NH3·H2O==[Ag(NH3)2]++2H2O
迁移应用
1.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A.使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl-
B.[OH-]=1×10-13 mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
C.与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42-
D.水电离的[H+]=1×10-11 mol·L-1的溶液中:K+、Na+、[Al(OH)4]-、CO32-
B
迁移应用
2.写出下列与量有关的离子方程式
(1)过量的二氧化硫通入氢氧化钠溶液反应的离子方程式________________________________________________________________
(2)向NaHSO4溶液中逐滴滴入Ba(OH)2溶液至沉淀完全
____________________________________________________。
溶液至中性_______________________________________。
(3)向同浓度的NaBr、NaI混合溶液中滴入少量氯水
________________________________________________________________
SO2+OH-==HSO3-
H++SO42-+Ba2++OH-===BaSO4↓+H2O
2H++SO42-+Ba2++2OH-==BaSO4↓+2H2O
2I-+Cl2==I2+2Cl-
应用指导
离子方程式的书写注意要点
(1)一易:易溶的强电解质(强酸、强碱和大多数可溶性盐)以实际参加反应的离子符号表示;其他物质(非电解质、弱电解质、难溶物、气体、单质、氧化物等)用化学式表示。
(2)两等:离子方程式两边的原子个数、电荷总数均应相等。
(3)三查:检查各项是否都有公约数,是否漏写必要的反应条件,是否漏写离子反应。
应用指导
与量有关的离子方程式的书写注意问题
(1)要注意“过量”“少量”“等物质的量”“适量”“任意量”以及滴加顺序对离子方程式的影响。
(2)以量少的为标准,一般将少量物质的物质的量,先定为“1 mol”,确定另一种物质参加反应的离子的物质的量。同时少量物质参加反应的离子系数之比要符合化学式。
第4节 离子反应
当向水中加入一种电解质时,所形成的水溶液中可能存在电离平衡、水解平衡或沉淀溶解平衡;当向水中加入两种或两种以上电解质时,溶液中的各种离子之间可能发生反应;当向电解质溶液中加入金属单质或通入气体时,电解质电离出的离子与所加物质的原子或分子之间可能发生反应。这些反应都有什么特点 它们为什么会发生 研究这样的反应有什么意义
联想·质疑
交流研讨
1.以下两种物质混合时,溶液中存在哪些离子 哪些离子之间会发生反应 写出有关反应的离子方程式。
(1)Na2SO4溶液与 BaCl2溶液;
(2)石灰乳[Ca(OH) 2浊液】与Na2CO3溶液;
(3)Na2CO3 溶液与盐酸;
(4)盐酸与锌粒;
(5)CH3COONa溶液与盐酸;
(6)KI溶液与溴水。
SO42-+Ba2+==BaSO4↓
Ca(OH) 2+CO32-==CaCO3↓+2OH-
CO32-+2H+==CO2↑+H2O
Zn+2H+==H2↑+Zn2+
CH3COO-+H+==CH3COOH
2I-+Br2==I2+2Br -
交流研讨
2.你学过的离子反应还有哪些 它们各有什么特点 满足哪些条件时离子反应能够发生 为什么在这些条件下离子反应能够发生
离子反应:
离子反应发生条件:
离子反应特点:
溶液中离子之间以及离子与原子或分子之间发生的反应
某种或某些离子浓度的降低
形成沉淀、弱电解质、气体或离子参与氧化还原反应
①Na2SO4溶液与Ba(OH)2溶液混合的离子反应:
②向MgCO3悬浊液中加入NaOH溶液的离子反应:
离子生成沉淀
沉淀转化
思考
浓度减小
浓度增大
离子反应会使溶液中某种或某些离子浓度的降低
①NaOH与盐酸混合:
②盐酸与CH3COONa混合:
③向稀NH4NO3溶液中加入NaOH溶液:
常见的与H+结合的弱酸根离子有:F-、ClO-、S2-、HS-、SO32-、HSO3-、PO43-、HPO42-、H2PO4-、CO32-、HCO3-、CH3COO-、[Al(OH)4]-、SiO32-等;
常见的与OH-结合的弱碱阳离子有:
NH4+、Mg2+、Al3+、Fe3+、Zn2+、Cu2+等。
NH4++OH-==NH3 H2O
强酸制备弱酸
强碱制备弱碱
酸碱中和
①Na2CO3溶液与稀硫酸混合:
②浓NH4NO3溶液中加入浓NaOH溶液:
NH4++OH-==NH3↑+H2O。
CO32-+2H+===H2O+CO2↑
常见生成气体或挥发性物质的离子反应:
H+与CO32-、SO32-、S2-、HS-、HSO3-、HCO3-等;
OH-与NH4+。
归纳总结
NH4++OH-==NH3↑+H2O。
NH4++OH-==NH3 H2O。
稀NH4NO3溶液与稀NaOH溶液:
浓NH4NO3溶液与浓NaOH溶液:
①氧化性离子与还原性离子的反应
5Fe2++MnO4-+8H+===5Fe3++Mn2++4H2O
Zn+Cu2+===Zn2++Cu
Zn+2H+===Zn2++H2↑
2Fe3++Cu==2Fe2++Cu2+
2Fe2++Cl2==2Fe3++2Cl-
Br2+2I-===2Br-+I2
②有离子参加的氧化还原反应
在溶液中,具有氧化性和还原性的离子相遇时,二者能发生氧化还原反应而使离子浓度降低。
③原电池中发生的氧化还原反应的离子反应
④电解池中发生的氧化还原反应的离子反应
铜锌原电池反应的离子方程式:Zn+Cu2+===Zn2++Cu
电解饱和食盐水的离子方程式:2Cl-+2H2O=====2OH-+H2↑+Cl2↑
通电
(1)MnO4-(H+)与Cl-、Br-、I-、S2-、HS-、SO32-、HSO3-、Fe2+等。
(2)NO3-(H+)与Br-、I-、S2-、HS-、SO32-、HSO3-、Fe2+等。
(3)ClO-与Br-、I-、S2-、HS-、SO32-、HSO3-、Fe2+等。
(4)Fe3+与I-、S2-、HS-、SO32-、HSO3-等。
归纳总结
常见发生氧化还原反应的离子
回顾思考
除以上离子反应类型外,你还知道哪些离子反应类型?
Al3++3HCO3-==Al(OH)3↓+3CO2↑
Fe3++3SCN-==Fe(SCN)3;
Ag++2NH3·H2O==[Ag(NH3)2]++2H2O
迁移应用
1.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A.使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl-
B.[OH-]=1×10-13 mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
C.与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42-
D.水电离的[H+]=1×10-11 mol·L-1的溶液中:K+、Na+、[Al(OH)4]-、CO32-
B
迁移应用
2.写出下列与量有关的离子方程式
(1)过量的二氧化硫通入氢氧化钠溶液反应的离子方程式________________________________________________________________
(2)向NaHSO4溶液中逐滴滴入Ba(OH)2溶液至沉淀完全
____________________________________________________。
溶液至中性_______________________________________。
(3)向同浓度的NaBr、NaI混合溶液中滴入少量氯水
________________________________________________________________
SO2+OH-==HSO3-
H++SO42-+Ba2++OH-===BaSO4↓+H2O
2H++SO42-+Ba2++2OH-==BaSO4↓+2H2O
2I-+Cl2==I2+2Cl-
应用指导
离子方程式的书写注意要点
(1)一易:易溶的强电解质(强酸、强碱和大多数可溶性盐)以实际参加反应的离子符号表示;其他物质(非电解质、弱电解质、难溶物、气体、单质、氧化物等)用化学式表示。
(2)两等:离子方程式两边的原子个数、电荷总数均应相等。
(3)三查:检查各项是否都有公约数,是否漏写必要的反应条件,是否漏写离子反应。
应用指导
与量有关的离子方程式的书写注意问题
(1)要注意“过量”“少量”“等物质的量”“适量”“任意量”以及滴加顺序对离子方程式的影响。
(2)以量少的为标准,一般将少量物质的物质的量,先定为“1 mol”,确定另一种物质参加反应的离子的物质的量。同时少量物质参加反应的离子系数之比要符合化学式。
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
