鲁科版高中化学选择性必修1第3章物质在水溶液中的行为3.5微项目探秘索尔微维制碱法和侯氏制碱法教学(共25张PPT)件
文档属性
| 名称 | 鲁科版高中化学选择性必修1第3章物质在水溶液中的行为3.5微项目探秘索尔微维制碱法和侯氏制碱法教学(共25张PPT)件 |

|
|
| 格式 | ppt | ||
| 文件大小 | 1002.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-09 00:00:00 | ||
图片预览








文档简介
(共25张PPT)
第3 章 物质在水溶液中的行为
微项目 探秘索尔维制碱法和侯氏制碱法
——化学平衡思想的创造性应用
一、导入新课
纯碱是重要的基础化工原料,其产量和消费量通常作为衡量一个国家工业发展水平的指标。
工业纯碱常用于制造玻璃、洗涤剂、建筑材料等。食用纯碱可用于食品工业,如生产味精、作为食品添加剂等。
历史上比较重要的制碱方法有路布兰(N.Leblanc)法、索尔维(E.Solvay)法和侯氏制碱法。我国对纯碱的需求量大,但纯碱工业起步较晚。化学工业科学家侯德榜为我国的制碱工业作出了突出的贡献,他发明的“侯氏制碱法”在人类化学工业史上写下了光辉的一页。
二、解读索尔维制碱法
1.关键反应
NaCl + CO2 + H2O + NH3 === NaHCO3↓ + NH4Cl
比利时工程师索尔维以食盐、石灰石和氨为原料制得碳酸钠和氯化钙,1867年这种方法被正式命名为索尔维制碱法。
索尔维法的关键反应:
二、解读索尔维制碱法
2.实验室模拟索尔维制碱法
锥形瓶中装有碳酸钙粉末,分液漏斗中装有稀硫酸,试管中装有氨盐水,并滴有酚酞溶液。
用冰水浴降低试管内的温度。
打开分液漏斗,观察二氧化碳通入氨盐水的现象。
(1)实验内容
二、解读索尔维制碱法
2.实验室模拟索尔维制碱法
(2)实验现象
通入CO2后,试管中一开始出现澄清状态,15min之后溶液颜色变浅,随着通入CO2时间变长,酚酞完全褪色,溶液中有沉淀逐渐析出。
增大c(Na+)
和c(HCO3)
-
二、解读索尔维制碱法
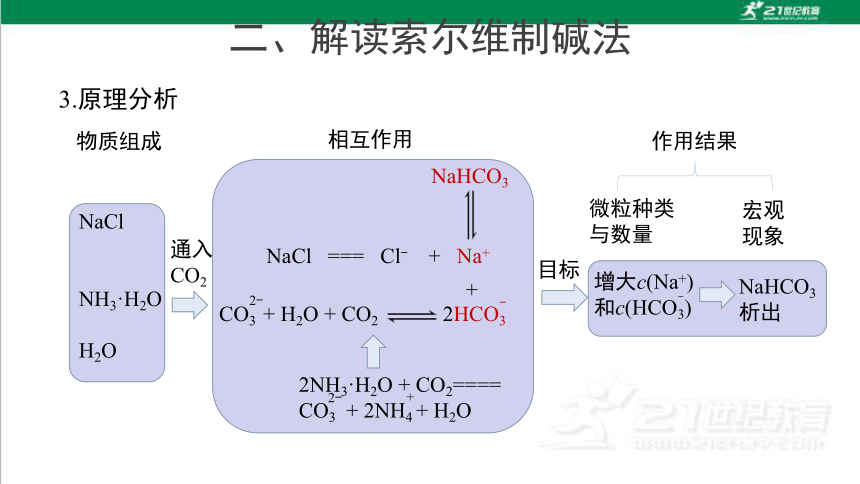
3.原理分析
物质组成
相互作用
作用结果
NaCl
NH3·H2O
H2O
NaCl === Cl- + Na+
NaHCO3
CO3 + H2O + CO2 2HCO3
2-
-
+
2NH3·H2O + CO2====
CO3 + 2NH4 + H2O
2-
+
通入
CO2
目标
微粒种类
与数量
宏观
现象
NaHCO3
析出
二、解读索尔维制碱法
3.原理分析
思考讨论:
(1)NaHCO3可溶于水,而索尔维法却能得到NaHCO3沉淀,试用化学平衡的原理解释原因。
可溶性物质的溶解是存在限度的,当相应的离子浓度过大时,可溶性物质也会析出,类似沉淀溶解平衡。索尔维法通过增大Na+ 、HCO3 的浓度,使平衡 NaHCO3 Na+ + HCO3 的Q>K,平衡左移,产生沉淀。
-
-
二、解读索尔维制碱法
3.原理分析
思考讨论:
(2)实验中氨盐水的作用是什么?为什么要先向饱和食盐水中通入氨气制得氨盐水,再通入二氧化碳?
氨盐水的作用是增大CO2的吸收量,增大HCO3 的浓度。
CO2在食盐水中溶解度较小,直接通入CO2难以获得足量的HCO3,NH3易溶于水,能使H2CO3 H+ + HCO3 平衡右移,使HCO3 浓度增大。
-
-
-
-
-
-
二、解读索尔维制碱法
3.原理分析
思考讨论:
(3)实验发现,酚酞完全褪色后才有沉淀逐渐析出。在整个实验过程中,溶液中微粒的种类、数量发生了什么变化?原因是什么?
在整个实验过程中,溶液中增加了CO3 、HCO3 ;
HCO3 、NH4、H+数量增加,Na+、OH-数量减小,Cl-数量不变。
2-
-
-
+
二、解读索尔维制碱法
3.原理分析
思考讨论:
(3)实验发现,酚酞完全褪色后才有沉淀逐渐析出。在整个实验过程中,溶液中微粒的种类、数量发生了什么变化?原因是什么?
反应开始时溶液呈碱性,此时通入的二氧化碳与氨水反应,反应产物主要为CO3 。
随着反应的进行,氨水逐渐消耗,溶液的 pH 逐渐降低,OH-数量减少, NH4 、H+数量增多,生成的CO3 与继续通入的二氧化碳反应生成了HCO3 , HCO3 浓度逐渐增大。当浓度增大至一定程度时,它与Na+结合生成碳酸氢钠沉淀析出,Na+数量减少,Cl-未参与离子反应,数量不变。
2-
+
-
-
2-
二、解读索尔维制碱法
4.基本工艺流程
精制饱和食盐水
吸氨
NH3
碳酸化
过滤
NaHCO3
沉淀
煅烧
Na2CO3
灰蒸
母液
废液
石灰石
煅烧
石灰
乳
CO2
CO2
NH3
二、解读索尔维制碱法
4.基本工艺流程
发生的主要反应:
高温
CaO+H2O === Ca(OH)2
二、解读索尔维制碱法
5.索尔维法的优、缺点
优点:
原料(食盐和石灰石)便宜,产品纯碱的纯度高;
副产品氨和二氧化碳都可以回收循环使用;
制造步骤简单,适合于大规模生产。
缺点:
原料食盐的利用率低;
生成了没有多大用途的氯化钙(CaCl2)。
三、体会侯氏制碱法的创新
1.创新背景
我国化学实业家范旭东最初将制碱厂设在天津塘沽,塘沽靠海,原料食盐容易获得。1937年,卢沟桥事变后不久,日军攻占天津,制碱厂被迫停产。范旭东、侯德榜等将工厂迁至四川。四川没有廉价的海盐,只能使用从深井中吊上来的低浓度“井盐水”。索尔维法的食盐利用率低,只有72%~74%,使生产成本很高,这也导致中国的纯碱工业陷入困境。根据当时的情况,侯德榜创造性地提出了侯氏制碱法。
三、体会侯氏制碱法的创新
2.反应原理
NH3+CO2+H2O===NH4HCO3
NaHCO3加热分解可制取Na2CO3:
三、体会侯氏制碱法的创新
3.工艺流程
精制饱和食盐水
吸氨
NH3
碳酸化
过滤
NaHCO3
沉淀
煅烧
Na2CO3
NH4Cl
冷析
吸氨
盐析
母液Ⅱ
CO2
NaCl
降温
母液Ⅰ
NH3
CO2
由合成氨工业提供
澄清
三、体会侯氏制碱法的创新
4.侯氏制碱法的创新之处
侯氏制碱法的食盐利用率可达98%,大大提高了原料(NaCl)的利用率,不产生无用的CaCl2。
实现大规模联合生产,降低成本。利用一个厂的废料作为另一个厂的主要原料。如合成氨厂的废料CO2可以作为制碱厂的主要原料,制碱厂无用的Cl-可以代替价格比较昂贵的硫酸来固定氨制成氮肥,降低了成本,提高了综合经济效益。
三、体会侯氏制碱法的创新
【归纳总结】
分析真实溶液问题的一般思路
(1)分析溶液的物质组成、微粒和相互作用
真实溶液的复杂问题归根结底是溶液中的物质及其相互作用的问题。例如,要寻找索尔维法食盐利用率低的原因,需要分析制碱母液的组成及微粒,母液处理过程中的反应和平衡移动,以及废液的组成及微粒。
-
三、体会侯氏制碱法的创新
【归纳总结】
分析真实溶液问题的一般思路
(2)根据目标确定待解决的关键问题
真实问题解决需要明确目标,有目的地调控溶液中的物质组成、微粒和平衡。例如,要提高食盐利用率、避免Na+的浪费,就需要重新利用索尔维法排放的废液。为此,需要设法增大母液中有用微粒Na+和HCO3 的浓度,同时考虑母液中其他微粒是否会影响生产,以及如何处理。
-
三、体会侯氏制碱法的创新
【归纳总结】
分析真实溶液问题的一般思路
(3)基于信息和数据进行推理
真实溶液中,物质可能发生多次、多种相互作用。基于信息和数据,可以进行合理的推论。例如,基于氯化铵的溶解度数据以及氯化钠溶解度随温度的变化,可以推测“冷析”过程的产物及目的。
-
四、课堂练习
1.侯氏制碱法中可循环利用的物质是( )
A
A.CO2、NaCl B.NH3、NaCl
C.NH3、CO2 D.CaO、NH3
A.实验时先点燃装置①的酒精灯,过一段时间后再打开装置③中分液漏斗的旋塞
B.装置②的干燥管中可盛放蘸稀硫酸的脱脂棉,作用是吸收多余的NH3
C.向步骤I所得滤液中通入氨气,加入细小的食盐颗粒并降温可析出NH4Cl
D.用装置④加热碳酸氢钠可实现步骤Ⅱ的转化,所得CO2可循环使用
2.“侯氏制碱法”是我国化工专家侯德榜为世界制碱工业作出的突出贡献。某实验小组模拟“侯氏制碱法”的工艺流程及实验装置(部分夹持装置省略)如下。下列叙述错误的是( )
四、课堂练习
D
3.下列关于氨碱法(索氏)和联合制碱法(侯氏)说法错误的是( )
A.两者的原料来源相同
B.两者的生产原理相同
C.两者对食盐利用率不同
D.两者最终产品都是Na2CO3
四、课堂练习
A
五、课堂小结
索尔维制碱法的基本工艺流程
精制饱和食盐水
吸氨
NH3
碳酸化
过滤
NaHCO3
沉淀
煅烧
Na2CO3
灰蒸
母液
废液
石灰石
煅烧
石灰
乳
CO2
CO2
NH3
五、课堂小结
侯氏制碱法工艺流程
精制饱和食盐水
吸氨
NH3
碳酸化
过滤
NaHCO3
沉淀
煅烧
Na2CO3
NH4Cl
冷析
吸氨
盐析
母液Ⅱ
CO2
NaCl
降温
母液Ⅰ
NH3
CO2
由合成氨工业提供
澄清
第3 章 物质在水溶液中的行为
微项目 探秘索尔维制碱法和侯氏制碱法
——化学平衡思想的创造性应用
一、导入新课
纯碱是重要的基础化工原料,其产量和消费量通常作为衡量一个国家工业发展水平的指标。
工业纯碱常用于制造玻璃、洗涤剂、建筑材料等。食用纯碱可用于食品工业,如生产味精、作为食品添加剂等。
历史上比较重要的制碱方法有路布兰(N.Leblanc)法、索尔维(E.Solvay)法和侯氏制碱法。我国对纯碱的需求量大,但纯碱工业起步较晚。化学工业科学家侯德榜为我国的制碱工业作出了突出的贡献,他发明的“侯氏制碱法”在人类化学工业史上写下了光辉的一页。
二、解读索尔维制碱法
1.关键反应
NaCl + CO2 + H2O + NH3 === NaHCO3↓ + NH4Cl
比利时工程师索尔维以食盐、石灰石和氨为原料制得碳酸钠和氯化钙,1867年这种方法被正式命名为索尔维制碱法。
索尔维法的关键反应:
二、解读索尔维制碱法
2.实验室模拟索尔维制碱法
锥形瓶中装有碳酸钙粉末,分液漏斗中装有稀硫酸,试管中装有氨盐水,并滴有酚酞溶液。
用冰水浴降低试管内的温度。
打开分液漏斗,观察二氧化碳通入氨盐水的现象。
(1)实验内容
二、解读索尔维制碱法
2.实验室模拟索尔维制碱法
(2)实验现象
通入CO2后,试管中一开始出现澄清状态,15min之后溶液颜色变浅,随着通入CO2时间变长,酚酞完全褪色,溶液中有沉淀逐渐析出。
增大c(Na+)
和c(HCO3)
-
二、解读索尔维制碱法
3.原理分析
物质组成
相互作用
作用结果
NaCl
NH3·H2O
H2O
NaCl === Cl- + Na+
NaHCO3
CO3 + H2O + CO2 2HCO3
2-
-
+
2NH3·H2O + CO2====
CO3 + 2NH4 + H2O
2-
+
通入
CO2
目标
微粒种类
与数量
宏观
现象
NaHCO3
析出
二、解读索尔维制碱法
3.原理分析
思考讨论:
(1)NaHCO3可溶于水,而索尔维法却能得到NaHCO3沉淀,试用化学平衡的原理解释原因。
可溶性物质的溶解是存在限度的,当相应的离子浓度过大时,可溶性物质也会析出,类似沉淀溶解平衡。索尔维法通过增大Na+ 、HCO3 的浓度,使平衡 NaHCO3 Na+ + HCO3 的Q>K,平衡左移,产生沉淀。
-
-
二、解读索尔维制碱法
3.原理分析
思考讨论:
(2)实验中氨盐水的作用是什么?为什么要先向饱和食盐水中通入氨气制得氨盐水,再通入二氧化碳?
氨盐水的作用是增大CO2的吸收量,增大HCO3 的浓度。
CO2在食盐水中溶解度较小,直接通入CO2难以获得足量的HCO3,NH3易溶于水,能使H2CO3 H+ + HCO3 平衡右移,使HCO3 浓度增大。
-
-
-
-
-
-
二、解读索尔维制碱法
3.原理分析
思考讨论:
(3)实验发现,酚酞完全褪色后才有沉淀逐渐析出。在整个实验过程中,溶液中微粒的种类、数量发生了什么变化?原因是什么?
在整个实验过程中,溶液中增加了CO3 、HCO3 ;
HCO3 、NH4、H+数量增加,Na+、OH-数量减小,Cl-数量不变。
2-
-
-
+
二、解读索尔维制碱法
3.原理分析
思考讨论:
(3)实验发现,酚酞完全褪色后才有沉淀逐渐析出。在整个实验过程中,溶液中微粒的种类、数量发生了什么变化?原因是什么?
反应开始时溶液呈碱性,此时通入的二氧化碳与氨水反应,反应产物主要为CO3 。
随着反应的进行,氨水逐渐消耗,溶液的 pH 逐渐降低,OH-数量减少, NH4 、H+数量增多,生成的CO3 与继续通入的二氧化碳反应生成了HCO3 , HCO3 浓度逐渐增大。当浓度增大至一定程度时,它与Na+结合生成碳酸氢钠沉淀析出,Na+数量减少,Cl-未参与离子反应,数量不变。
2-
+
-
-
2-
二、解读索尔维制碱法
4.基本工艺流程
精制饱和食盐水
吸氨
NH3
碳酸化
过滤
NaHCO3
沉淀
煅烧
Na2CO3
灰蒸
母液
废液
石灰石
煅烧
石灰
乳
CO2
CO2
NH3
二、解读索尔维制碱法
4.基本工艺流程
发生的主要反应:
高温
CaO+H2O === Ca(OH)2
二、解读索尔维制碱法
5.索尔维法的优、缺点
优点:
原料(食盐和石灰石)便宜,产品纯碱的纯度高;
副产品氨和二氧化碳都可以回收循环使用;
制造步骤简单,适合于大规模生产。
缺点:
原料食盐的利用率低;
生成了没有多大用途的氯化钙(CaCl2)。
三、体会侯氏制碱法的创新
1.创新背景
我国化学实业家范旭东最初将制碱厂设在天津塘沽,塘沽靠海,原料食盐容易获得。1937年,卢沟桥事变后不久,日军攻占天津,制碱厂被迫停产。范旭东、侯德榜等将工厂迁至四川。四川没有廉价的海盐,只能使用从深井中吊上来的低浓度“井盐水”。索尔维法的食盐利用率低,只有72%~74%,使生产成本很高,这也导致中国的纯碱工业陷入困境。根据当时的情况,侯德榜创造性地提出了侯氏制碱法。
三、体会侯氏制碱法的创新
2.反应原理
NH3+CO2+H2O===NH4HCO3
NaHCO3加热分解可制取Na2CO3:
三、体会侯氏制碱法的创新
3.工艺流程
精制饱和食盐水
吸氨
NH3
碳酸化
过滤
NaHCO3
沉淀
煅烧
Na2CO3
NH4Cl
冷析
吸氨
盐析
母液Ⅱ
CO2
NaCl
降温
母液Ⅰ
NH3
CO2
由合成氨工业提供
澄清
三、体会侯氏制碱法的创新
4.侯氏制碱法的创新之处
侯氏制碱法的食盐利用率可达98%,大大提高了原料(NaCl)的利用率,不产生无用的CaCl2。
实现大规模联合生产,降低成本。利用一个厂的废料作为另一个厂的主要原料。如合成氨厂的废料CO2可以作为制碱厂的主要原料,制碱厂无用的Cl-可以代替价格比较昂贵的硫酸来固定氨制成氮肥,降低了成本,提高了综合经济效益。
三、体会侯氏制碱法的创新
【归纳总结】
分析真实溶液问题的一般思路
(1)分析溶液的物质组成、微粒和相互作用
真实溶液的复杂问题归根结底是溶液中的物质及其相互作用的问题。例如,要寻找索尔维法食盐利用率低的原因,需要分析制碱母液的组成及微粒,母液处理过程中的反应和平衡移动,以及废液的组成及微粒。
-
三、体会侯氏制碱法的创新
【归纳总结】
分析真实溶液问题的一般思路
(2)根据目标确定待解决的关键问题
真实问题解决需要明确目标,有目的地调控溶液中的物质组成、微粒和平衡。例如,要提高食盐利用率、避免Na+的浪费,就需要重新利用索尔维法排放的废液。为此,需要设法增大母液中有用微粒Na+和HCO3 的浓度,同时考虑母液中其他微粒是否会影响生产,以及如何处理。
-
三、体会侯氏制碱法的创新
【归纳总结】
分析真实溶液问题的一般思路
(3)基于信息和数据进行推理
真实溶液中,物质可能发生多次、多种相互作用。基于信息和数据,可以进行合理的推论。例如,基于氯化铵的溶解度数据以及氯化钠溶解度随温度的变化,可以推测“冷析”过程的产物及目的。
-
四、课堂练习
1.侯氏制碱法中可循环利用的物质是( )
A
A.CO2、NaCl B.NH3、NaCl
C.NH3、CO2 D.CaO、NH3
A.实验时先点燃装置①的酒精灯,过一段时间后再打开装置③中分液漏斗的旋塞
B.装置②的干燥管中可盛放蘸稀硫酸的脱脂棉,作用是吸收多余的NH3
C.向步骤I所得滤液中通入氨气,加入细小的食盐颗粒并降温可析出NH4Cl
D.用装置④加热碳酸氢钠可实现步骤Ⅱ的转化,所得CO2可循环使用
2.“侯氏制碱法”是我国化工专家侯德榜为世界制碱工业作出的突出贡献。某实验小组模拟“侯氏制碱法”的工艺流程及实验装置(部分夹持装置省略)如下。下列叙述错误的是( )
四、课堂练习
D
3.下列关于氨碱法(索氏)和联合制碱法(侯氏)说法错误的是( )
A.两者的原料来源相同
B.两者的生产原理相同
C.两者对食盐利用率不同
D.两者最终产品都是Na2CO3
四、课堂练习
A
五、课堂小结
索尔维制碱法的基本工艺流程
精制饱和食盐水
吸氨
NH3
碳酸化
过滤
NaHCO3
沉淀
煅烧
Na2CO3
灰蒸
母液
废液
石灰石
煅烧
石灰
乳
CO2
CO2
NH3
五、课堂小结
侯氏制碱法工艺流程
精制饱和食盐水
吸氨
NH3
碳酸化
过滤
NaHCO3
沉淀
煅烧
Na2CO3
NH4Cl
冷析
吸氨
盐析
母液Ⅱ
CO2
NaCl
降温
母液Ⅰ
NH3
CO2
由合成氨工业提供
澄清
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
