湖南省长沙市望城区第二中学2024-2025学年高二下学期7月期末化学试卷(含答案)
文档属性
| 名称 | 湖南省长沙市望城区第二中学2024-2025学年高二下学期7月期末化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 467.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-09 00:42:04 | ||
图片预览


文档简介
高二期末化学试卷
一、单选题(本大题共14个小题,每小题3分,共42分)
1.可逆反应:2NO2(g)2NO(g)+O2(g)在容积固定的密闭容器中进行,达到平衡的标志正确的有
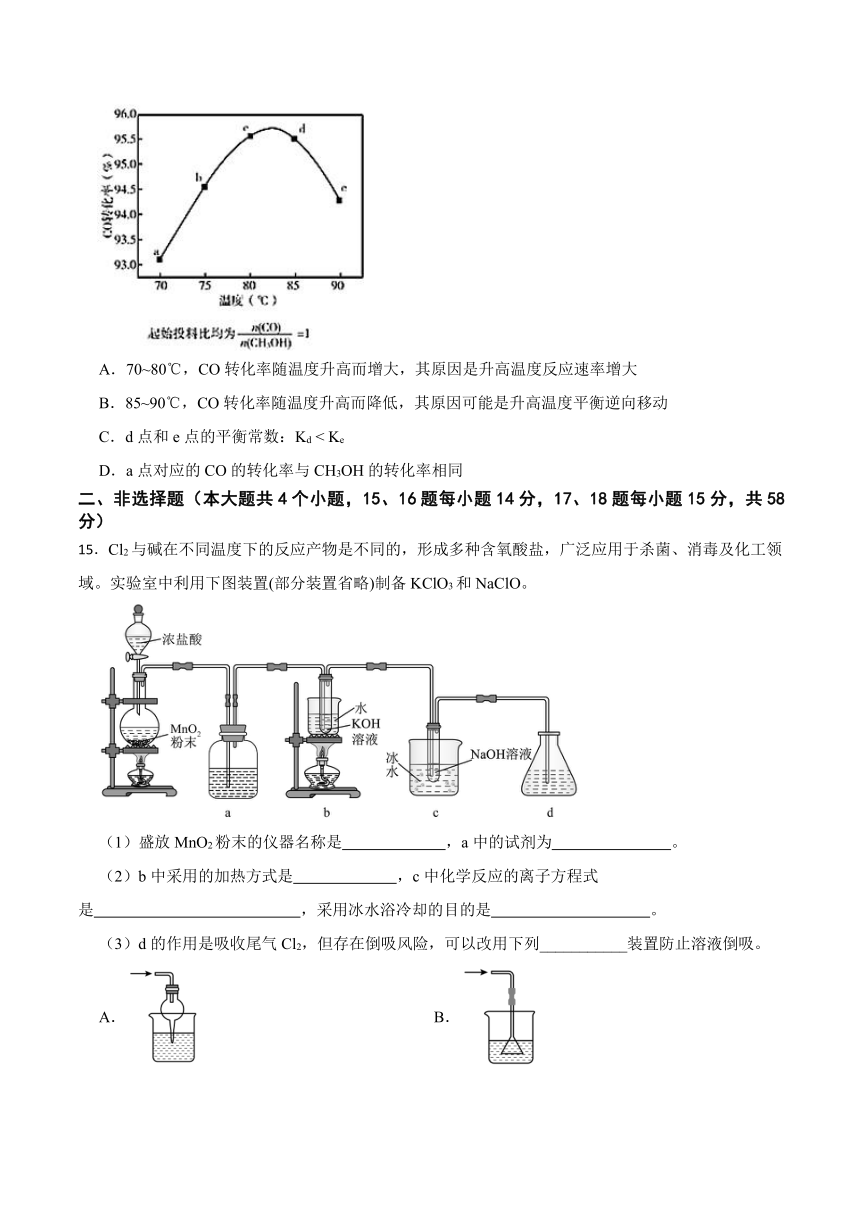
①单位时间内反应n mol O2的同时,生成2n mol NO
②容器内总压强不再变化的状态
③NO2、NO、O2的物质的量浓度为2:2:1的状态
④混合气体的密度不再改变的状态
⑤混合气体的颜色不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A.2个 B.3个 C.4个 D.5个
2.下列说法正确的是
A.若把H2S分子写成H3S分子,违背了共价键的方向性
B.s轨道和p轨道重叠可以形成π键
C.共价键都具有方向性
D.C2H4与Cl2的加成反应C2H4只涉及π键断裂
3.反应S+6HNO3(浓)=H2SO4+6NO2↑+2H2O中氧化剂是
A.H2SO4 B.HNO3 C.NO2 D.S
4.能正确表示下列反应的离子方程式是
A.溶液与少量溶液反应:
B.电解水溶液:
C.向溶液中滴入酸化的溶液产生白色沉淀:
D.向溶液中滴入溶液产生黑色沉淀和气泡:
5. 某化合物的分子式为。X、Y、Z三种元素位于同一短周期且原子序数依次增大,三者的原子核外电子层数之和与未成对电子数之和相等,Z是周期表中电负性最大的元素。下列说法正确的是
A.三者中Z的原子半径最大 B.三者中Y的第一电离能最小
C.X的最高化合价为 D.与键角相等
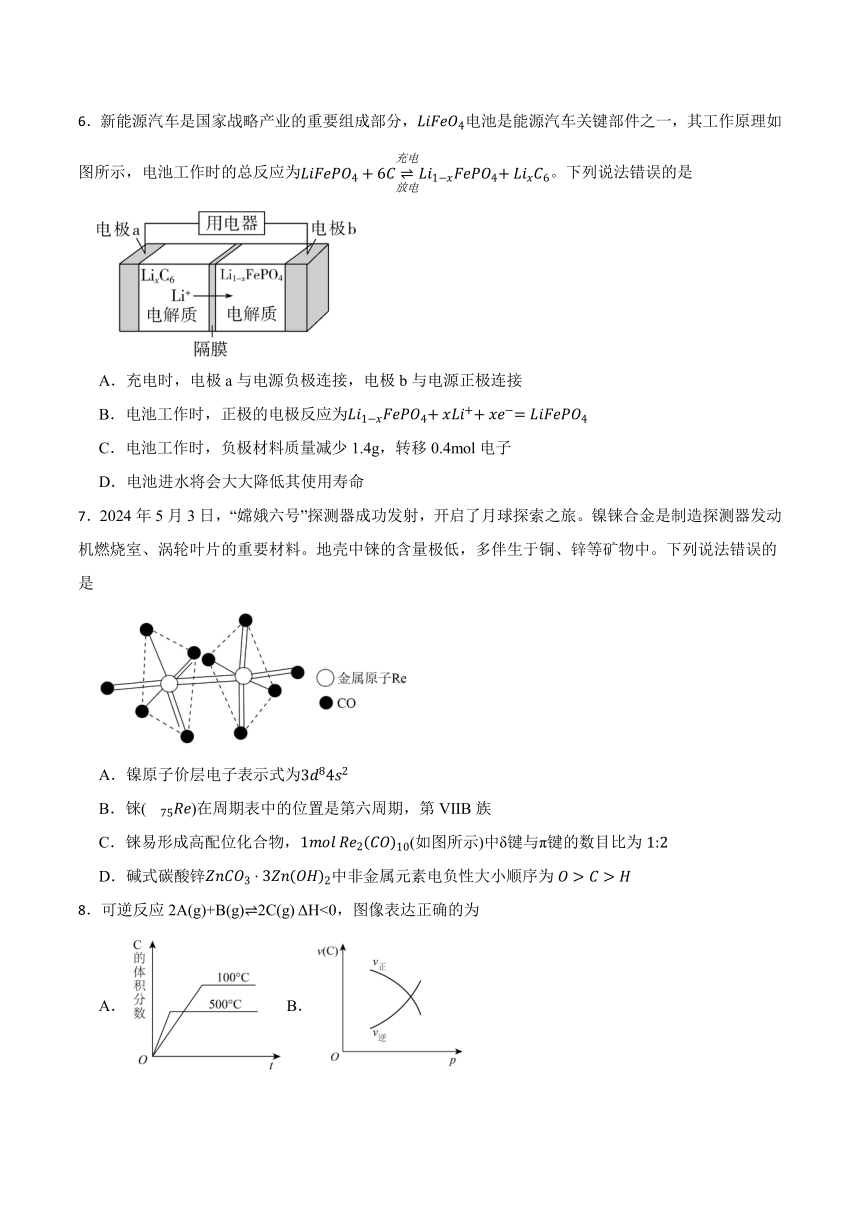
6.新能源汽车是国家战略产业的重要组成部分,电池是能源汽车关键部件之一,其工作原理如图所示,电池工作时的总反应为。下列说法错误的是
A.充电时,电极a与电源负极连接,电极b与电源正极连接
B.电池工作时,正极的电极反应为
C.电池工作时,负极材料质量减少1.4g,转移0.4mol电子
D.电池进水将会大大降低其使用寿命
7.2024年5月3日,“嫦娥六号”探测器成功发射,开启了月球探索之旅。镍铼合金是制造探测器发动机燃烧室、涡轮叶片的重要材料。地壳中铼的含量极低,多伴生于铜、锌等矿物中。下列说法错误的是
A.镍原子价层电子表示式为
B.铼()在周期表中的位置是第六周期,第VIIB族
C.铼易形成高配位化合物,(如图所示)中δ键与π键的数目比为
D.碱式碳酸锌中非金属元素电负性大小顺序为
8.可逆反应2A(g)+B(g)2C(g) ΔH<0,图像表达正确的为
A.B.
C.D.
9.下列离子方程式书写正确的是
A.草酸与酸性高锰酸钾溶液反应:
B.铅酸蓄电池充电时的阳极反应:
C.乙酸乙酯在碱性环境下水解:
D.向苯酚钠溶液中通入少量
10.已知NO2(g)+CO(g)=NO(g)+CO2(g)的反应过程及能量变化如图所示,设该反应的焓变为ΔH,则下列说法正确的是
A.ΔH>0
B.反应物的总键能大于生成物的总键能
C.增大反应物浓度,可以增大单位体积内活化分子百分数
D.使用催化剂可以增大反应物的活化分子百分数
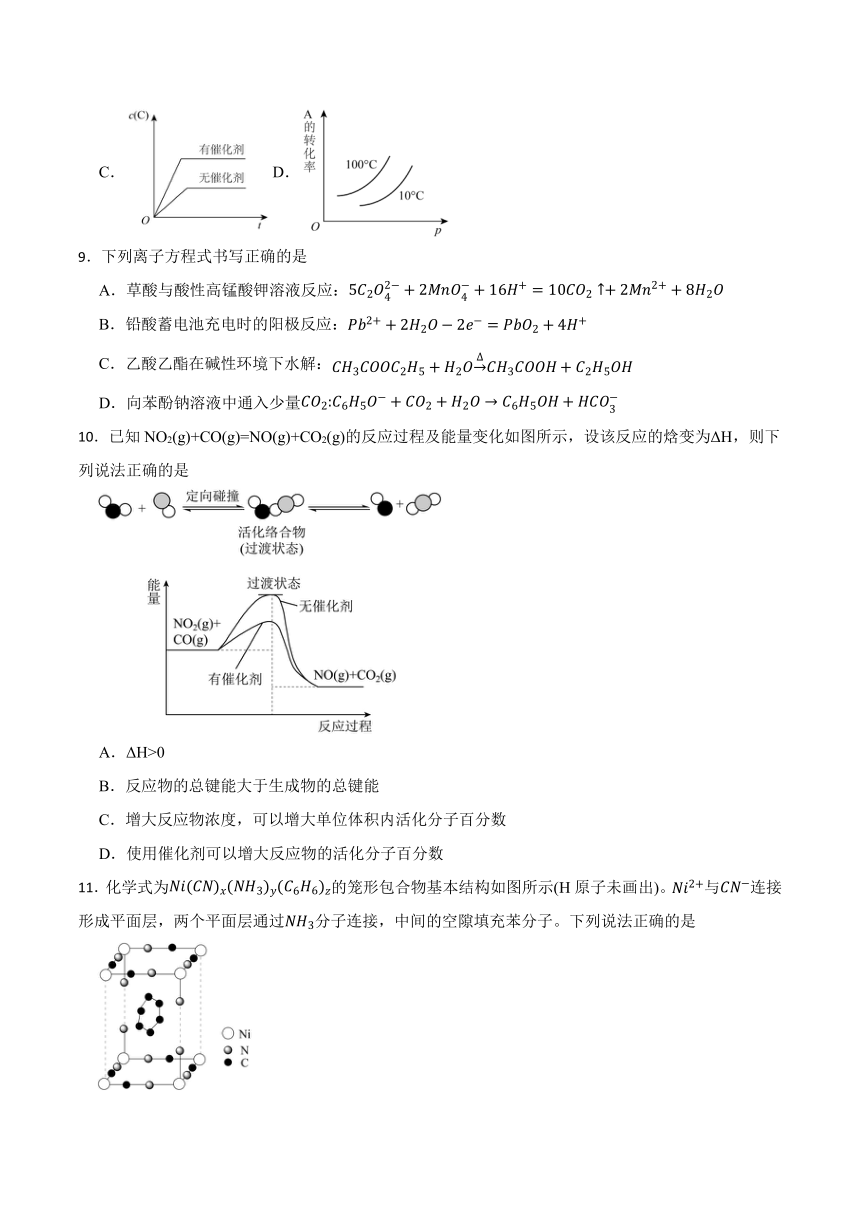
11.化学式为的笼形包合物基本结构如图所示(H原子未画出)。与连接形成平面层,两个平面层通过分子连接,中间的空隙填充苯分子。下列说法正确的是
A.
B.该结构是晶胞
C.该笼形包合物溶于酸可形成一种弱酸,中键和键个数之比为
D.部分与C原子配位,部分与N原子配位,且两者个数之比为
12.向相同容积的甲、乙两容器中分别充入和,发生如下反应:。若甲容器保持恒温恒容,乙容器保持绝热恒容,分别达到平衡。甲容器中平衡时生成为,同时放出热量。下列说法正确的是
A.平衡时,反应放出的热量:甲>乙
B.平衡时,的质量:甲>乙
C.乙容器若把条件“绝热恒容”改为“恒温恒压”,则平衡后大于
D.相同条件下,若仅向甲容器充入,平衡时生成,同时吸收热量
13.乙二胺四乙酸(EDTA)是一种重要的络合剂,其能与绝大多数的金属离子形成稳定的配合物,简易机理如图所示。下列叙述错误的是
A.EDTA的核磁共振氢谱上有3组峰 B.EDTA中含有两种官能团
C.螯合物中含有4个sp2-pπ键 D.螯合物中有5个五元螯合环
14.甲酸甲酯是重要有机化工原料,制备反应为CH3OH(g)+CO(g) HCOOCH3(g) ΔH<0;相同时间内,在容积固定的密闭容器中,使反应在不同温度下进行(起始投料比均为1),相同时间内测得CO的转化率随温度变化的曲线如下图。下列说法中不正确的是
A.70~80℃,CO转化率随温度升高而增大,其原因是升高温度反应速率增大
B.85~90℃,CO转化率随温度升高而降低,其原因可能是升高温度平衡逆向移动
C.d点和e点的平衡常数:Kd < Ke
D.a点对应的CO的转化率与CH3OH的转化率相同
二、非选择题(本大题共4个小题,15、16题每小题14分,17、18题每小题15分,共58分)
15.Cl2与碱在不同温度下的反应产物是不同的,形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用下图装置(部分装置省略)制备KClO3和NaClO。
(1)盛放MnO2粉末的仪器名称是 ,a中的试剂为 。
(2)b中采用的加热方式是 ,c中化学反应的离子方程式是 ,采用冰水浴冷却的目的是 。
(3)d的作用是吸收尾气Cl2,但存在倒吸风险,可以改用下列___________装置防止溶液倒吸。
A. B.
C. D.
16.有机反应一般速率较小,副反应多,产物复杂。结合学过的知识回答下列问题:
(1)甲同学欲用装置I比较乙酸、苯酚、碳酸的酸性强弱,苯酚钠溶液中发生反应的化学方程式是 ;饱和NaHCO3溶液的作用是 。
(2)乙同学利用装置Ⅱ制备乙烯并验证乙烯的性质。当温度迅速上升后,可观察到试管中的溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色。
①装置Ⅱ生成乙烯的化学方程式是 。
②丙同学认为:溴水褪色的现象不能证明装置I中有乙烯生成,原因是 。
③丙同学查文献得知:若用溴水验证,反应后装置Ⅱ的产物主要为BrCH2CH2OH,含少量BrCH2CH2Br。建议将装置中的溴水改为“溴的CCl4溶液”以排除H2O对乙烯与Br2反应的干扰。写出乙烯与溴水反应生成BrCH2CH2OH的化学方程式 。
(3)丁同学利用下装置探究卤代烃的性质,他向圆底烧瓶中加入2.0gNaOH和15mL无水乙醇,搅拌。再加入5mL1-溴丁烷和几片碎瓷片,微热。产生的气体依次通过试管A、B后,试管B溶液紫红色逐渐褪去。
①写出1-溴丁烷发生消去反应的化学方程式 试管A中盛放的试剂是 。
②已知溴乙烷的沸点为38.4℃,1-溴丁烷的沸点为101.6℃。有同学用溴乙烷代替1-溴丁烷进行实验,发现试管B中酸性KMnO4溶液不褪色。试分析实验失败的可能原因 。
17.工业废水中的六价铬[Cr(VI)]常采用还原沉淀法、离子交换法和微生物法等方法进行处理。
(1)室温下,含Cr(VI)的微粒在水溶液中存在如下平衡:
H2CrO4 H++HCrO ΔH1
HCrO H++CrO ΔH2
2HCrO +H2O ΔH3
室温下,反应2CrO+2H+ +H2O的ΔH= (用含ΔH1、ΔH2或ΔH3的代数式表示)。
(2)还原沉淀法:使用Na2SO3将Cr(VI)还原为Cr3+,再将Cr3+转化为沉淀除去。
①酸性条件下Cr(VI)具有很强的氧化能力,将还原为Cr3+的离子方程式为 。
②其他条件相同,用Na2SO3处理不同初始pH的含Cr(VI)废水相同时间,当pH<2时,Cr(VI)的去除率随pH降低而降低的原因是 。
(3)微生物法:
①用硫酸盐还原菌(SRB)处理含Cr(VI)废水时,Cr(VI)去除率随温度的变化如图所示。55℃时,Cr(VI)的去除率很低的原因是 。
②水体中,Fe合金在SRB存在条件下腐蚀的机理如图所示。Fe腐蚀后生成FeS的过程可描述为:Fe失去电子转化为Fe2+, 。
(4)离子交换法:用强碱性离子交换树脂(ROH)与和HCrO等发生离子交换,交换过程中发生如下反应:
ROH(s)+HCrO(aq) RHCrO4(s)+OH-(aq)
2ROH(s)+(aq) R2CrO4(s)+2OH-(aq)
其他条件相同,当pH>4时,Cr(VI)去除率随pH升高而下降的原因是 。
18.有M、R、Q、Y、Z五种短周期主族元素,其中Z为短周期主族元素中原子半径最大的,Y的最高正价与最低负价的代数和为0,M、R、Q、Y四种元素在元素周期表中的相对位置如图.回答下列问题:
M
Y Q R
(1)R在元素周期表中的位置是 .
(2)写出单质Y的一种用途: .
(3)Z、M、Q的简单离子的半径由大到小的顺序为 (用离子符号表示).
(4)写出的电子式: .其所含的化学键类型为 .
(5)下列事实能作为比较元素Y与R的非金属性相对强弱依据的是____(填标号).
A.常温下Y的单质呈固态,R的单质呈气态
B.最简单氢化物的稳定性:
C.Y与R形成的化合物中Y呈正价
D.酸性:
(6)写出常温下,R的单质与Z的最高价氧化物对应水化物的稀溶液反应的离子方程式: .
答案解析部分
1.【答案】C
2.【答案】D
3.【答案】B
4.【答案】D
5.【答案】B
6.【答案】C
7.【答案】C
8.【答案】A
9.【答案】D
10.【答案】D
11.【答案】D
12.【答案】A
13.【答案】C
14.【答案】C
15.【答案】(1)圆底烧瓶;饱和食盐水
(2)水浴加热;Cl2+2OH-=Cl-+ClO-+H2O;避免生成
(3)A;D
16.【答案】(1);除去CO2中的乙酸(吸收乙酸),防止其与苯酚钠溶液反应产生沉淀
(2);乙烯中混有SO2等还原性气体也能使溴水褪色;
(3);H2O;溴乙烷沸点低,加热时,多数挥发,没有充分反应
17.【答案】(1)ΔH3-2ΔH2
(2)3++8H+=2Cr3++3+4H2O;部分与H+结合后转化为SO2逸出,使得与Cr(VI)反应的的物质的量浓度减小,反应速率减慢
(3)55℃时,硫酸盐还原菌发生变性,几乎失去活性;H2O得到电子转化为H,被H还原为S2-,S2-与Fe2+结合生成FeS
(4)pH升高导致离子交换平衡逆向移动;pH升高导致HCrO转化为,交换所需ROH的量是交换HCrO所需ROH的量的两倍
18.【答案】(1)第三周期第族
(2)作半导体材料
(3)
(4);离子键、(非极性)共价键
(5)B;C
(6)
一、单选题(本大题共14个小题,每小题3分,共42分)
1.可逆反应:2NO2(g)2NO(g)+O2(g)在容积固定的密闭容器中进行,达到平衡的标志正确的有
①单位时间内反应n mol O2的同时,生成2n mol NO
②容器内总压强不再变化的状态
③NO2、NO、O2的物质的量浓度为2:2:1的状态
④混合气体的密度不再改变的状态
⑤混合气体的颜色不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A.2个 B.3个 C.4个 D.5个
2.下列说法正确的是
A.若把H2S分子写成H3S分子,违背了共价键的方向性
B.s轨道和p轨道重叠可以形成π键
C.共价键都具有方向性
D.C2H4与Cl2的加成反应C2H4只涉及π键断裂
3.反应S+6HNO3(浓)=H2SO4+6NO2↑+2H2O中氧化剂是
A.H2SO4 B.HNO3 C.NO2 D.S
4.能正确表示下列反应的离子方程式是
A.溶液与少量溶液反应:
B.电解水溶液:
C.向溶液中滴入酸化的溶液产生白色沉淀:
D.向溶液中滴入溶液产生黑色沉淀和气泡:
5. 某化合物的分子式为。X、Y、Z三种元素位于同一短周期且原子序数依次增大,三者的原子核外电子层数之和与未成对电子数之和相等,Z是周期表中电负性最大的元素。下列说法正确的是
A.三者中Z的原子半径最大 B.三者中Y的第一电离能最小
C.X的最高化合价为 D.与键角相等
6.新能源汽车是国家战略产业的重要组成部分,电池是能源汽车关键部件之一,其工作原理如图所示,电池工作时的总反应为。下列说法错误的是
A.充电时,电极a与电源负极连接,电极b与电源正极连接
B.电池工作时,正极的电极反应为
C.电池工作时,负极材料质量减少1.4g,转移0.4mol电子
D.电池进水将会大大降低其使用寿命
7.2024年5月3日,“嫦娥六号”探测器成功发射,开启了月球探索之旅。镍铼合金是制造探测器发动机燃烧室、涡轮叶片的重要材料。地壳中铼的含量极低,多伴生于铜、锌等矿物中。下列说法错误的是
A.镍原子价层电子表示式为
B.铼()在周期表中的位置是第六周期,第VIIB族
C.铼易形成高配位化合物,(如图所示)中δ键与π键的数目比为
D.碱式碳酸锌中非金属元素电负性大小顺序为
8.可逆反应2A(g)+B(g)2C(g) ΔH<0,图像表达正确的为
A.B.
C.D.
9.下列离子方程式书写正确的是
A.草酸与酸性高锰酸钾溶液反应:
B.铅酸蓄电池充电时的阳极反应:
C.乙酸乙酯在碱性环境下水解:
D.向苯酚钠溶液中通入少量
10.已知NO2(g)+CO(g)=NO(g)+CO2(g)的反应过程及能量变化如图所示,设该反应的焓变为ΔH,则下列说法正确的是
A.ΔH>0
B.反应物的总键能大于生成物的总键能
C.增大反应物浓度,可以增大单位体积内活化分子百分数
D.使用催化剂可以增大反应物的活化分子百分数
11.化学式为的笼形包合物基本结构如图所示(H原子未画出)。与连接形成平面层,两个平面层通过分子连接,中间的空隙填充苯分子。下列说法正确的是
A.
B.该结构是晶胞
C.该笼形包合物溶于酸可形成一种弱酸,中键和键个数之比为
D.部分与C原子配位,部分与N原子配位,且两者个数之比为
12.向相同容积的甲、乙两容器中分别充入和,发生如下反应:。若甲容器保持恒温恒容,乙容器保持绝热恒容,分别达到平衡。甲容器中平衡时生成为,同时放出热量。下列说法正确的是
A.平衡时,反应放出的热量:甲>乙
B.平衡时,的质量:甲>乙
C.乙容器若把条件“绝热恒容”改为“恒温恒压”,则平衡后大于
D.相同条件下,若仅向甲容器充入,平衡时生成,同时吸收热量
13.乙二胺四乙酸(EDTA)是一种重要的络合剂,其能与绝大多数的金属离子形成稳定的配合物,简易机理如图所示。下列叙述错误的是
A.EDTA的核磁共振氢谱上有3组峰 B.EDTA中含有两种官能团
C.螯合物中含有4个sp2-pπ键 D.螯合物中有5个五元螯合环
14.甲酸甲酯是重要有机化工原料,制备反应为CH3OH(g)+CO(g) HCOOCH3(g) ΔH<0;相同时间内,在容积固定的密闭容器中,使反应在不同温度下进行(起始投料比均为1),相同时间内测得CO的转化率随温度变化的曲线如下图。下列说法中不正确的是
A.70~80℃,CO转化率随温度升高而增大,其原因是升高温度反应速率增大
B.85~90℃,CO转化率随温度升高而降低,其原因可能是升高温度平衡逆向移动
C.d点和e点的平衡常数:Kd < Ke
D.a点对应的CO的转化率与CH3OH的转化率相同
二、非选择题(本大题共4个小题,15、16题每小题14分,17、18题每小题15分,共58分)
15.Cl2与碱在不同温度下的反应产物是不同的,形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用下图装置(部分装置省略)制备KClO3和NaClO。
(1)盛放MnO2粉末的仪器名称是 ,a中的试剂为 。
(2)b中采用的加热方式是 ,c中化学反应的离子方程式是 ,采用冰水浴冷却的目的是 。
(3)d的作用是吸收尾气Cl2,但存在倒吸风险,可以改用下列___________装置防止溶液倒吸。
A. B.
C. D.
16.有机反应一般速率较小,副反应多,产物复杂。结合学过的知识回答下列问题:
(1)甲同学欲用装置I比较乙酸、苯酚、碳酸的酸性强弱,苯酚钠溶液中发生反应的化学方程式是 ;饱和NaHCO3溶液的作用是 。
(2)乙同学利用装置Ⅱ制备乙烯并验证乙烯的性质。当温度迅速上升后,可观察到试管中的溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色。
①装置Ⅱ生成乙烯的化学方程式是 。
②丙同学认为:溴水褪色的现象不能证明装置I中有乙烯生成,原因是 。
③丙同学查文献得知:若用溴水验证,反应后装置Ⅱ的产物主要为BrCH2CH2OH,含少量BrCH2CH2Br。建议将装置中的溴水改为“溴的CCl4溶液”以排除H2O对乙烯与Br2反应的干扰。写出乙烯与溴水反应生成BrCH2CH2OH的化学方程式 。
(3)丁同学利用下装置探究卤代烃的性质,他向圆底烧瓶中加入2.0gNaOH和15mL无水乙醇,搅拌。再加入5mL1-溴丁烷和几片碎瓷片,微热。产生的气体依次通过试管A、B后,试管B溶液紫红色逐渐褪去。
①写出1-溴丁烷发生消去反应的化学方程式 试管A中盛放的试剂是 。
②已知溴乙烷的沸点为38.4℃,1-溴丁烷的沸点为101.6℃。有同学用溴乙烷代替1-溴丁烷进行实验,发现试管B中酸性KMnO4溶液不褪色。试分析实验失败的可能原因 。
17.工业废水中的六价铬[Cr(VI)]常采用还原沉淀法、离子交换法和微生物法等方法进行处理。
(1)室温下,含Cr(VI)的微粒在水溶液中存在如下平衡:
H2CrO4 H++HCrO ΔH1
HCrO H++CrO ΔH2
2HCrO +H2O ΔH3
室温下,反应2CrO+2H+ +H2O的ΔH= (用含ΔH1、ΔH2或ΔH3的代数式表示)。
(2)还原沉淀法:使用Na2SO3将Cr(VI)还原为Cr3+,再将Cr3+转化为沉淀除去。
①酸性条件下Cr(VI)具有很强的氧化能力,将还原为Cr3+的离子方程式为 。
②其他条件相同,用Na2SO3处理不同初始pH的含Cr(VI)废水相同时间,当pH<2时,Cr(VI)的去除率随pH降低而降低的原因是 。
(3)微生物法:
①用硫酸盐还原菌(SRB)处理含Cr(VI)废水时,Cr(VI)去除率随温度的变化如图所示。55℃时,Cr(VI)的去除率很低的原因是 。
②水体中,Fe合金在SRB存在条件下腐蚀的机理如图所示。Fe腐蚀后生成FeS的过程可描述为:Fe失去电子转化为Fe2+, 。
(4)离子交换法:用强碱性离子交换树脂(ROH)与和HCrO等发生离子交换,交换过程中发生如下反应:
ROH(s)+HCrO(aq) RHCrO4(s)+OH-(aq)
2ROH(s)+(aq) R2CrO4(s)+2OH-(aq)
其他条件相同,当pH>4时,Cr(VI)去除率随pH升高而下降的原因是 。
18.有M、R、Q、Y、Z五种短周期主族元素,其中Z为短周期主族元素中原子半径最大的,Y的最高正价与最低负价的代数和为0,M、R、Q、Y四种元素在元素周期表中的相对位置如图.回答下列问题:
M
Y Q R
(1)R在元素周期表中的位置是 .
(2)写出单质Y的一种用途: .
(3)Z、M、Q的简单离子的半径由大到小的顺序为 (用离子符号表示).
(4)写出的电子式: .其所含的化学键类型为 .
(5)下列事实能作为比较元素Y与R的非金属性相对强弱依据的是____(填标号).
A.常温下Y的单质呈固态,R的单质呈气态
B.最简单氢化物的稳定性:
C.Y与R形成的化合物中Y呈正价
D.酸性:
(6)写出常温下,R的单质与Z的最高价氧化物对应水化物的稀溶液反应的离子方程式: .
答案解析部分
1.【答案】C
2.【答案】D
3.【答案】B
4.【答案】D
5.【答案】B
6.【答案】C
7.【答案】C
8.【答案】A
9.【答案】D
10.【答案】D
11.【答案】D
12.【答案】A
13.【答案】C
14.【答案】C
15.【答案】(1)圆底烧瓶;饱和食盐水
(2)水浴加热;Cl2+2OH-=Cl-+ClO-+H2O;避免生成
(3)A;D
16.【答案】(1);除去CO2中的乙酸(吸收乙酸),防止其与苯酚钠溶液反应产生沉淀
(2);乙烯中混有SO2等还原性气体也能使溴水褪色;
(3);H2O;溴乙烷沸点低,加热时,多数挥发,没有充分反应
17.【答案】(1)ΔH3-2ΔH2
(2)3++8H+=2Cr3++3+4H2O;部分与H+结合后转化为SO2逸出,使得与Cr(VI)反应的的物质的量浓度减小,反应速率减慢
(3)55℃时,硫酸盐还原菌发生变性,几乎失去活性;H2O得到电子转化为H,被H还原为S2-,S2-与Fe2+结合生成FeS
(4)pH升高导致离子交换平衡逆向移动;pH升高导致HCrO转化为,交换所需ROH的量是交换HCrO所需ROH的量的两倍
18.【答案】(1)第三周期第族
(2)作半导体材料
(3)
(4);离子键、(非极性)共价键
(5)B;C
(6)
同课章节目录
