人教版高中化学必修第一册第二章海水中的重要元素——钠和氯2.1.3碳酸钠和碳酸氢钠焰色试验教学课件(共31张PPT)
文档属性
| 名称 | 人教版高中化学必修第一册第二章海水中的重要元素——钠和氯2.1.3碳酸钠和碳酸氢钠焰色试验教学课件(共31张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-11 00:00:00 | ||
图片预览









文档简介
(共31张PPT)
第3课时 碳酸钠和碳酸氢钠 焰色试验
【课程目标】
1.结合真实情境中的应用实例或通过实验探究,了解Na2CO3、NaHCO3的主要性质,了解它们在生产、生活中的应用。
2.了解焰色试验的操作与应用。
01.夯基提能
知识点一 碳酸钠和碳酸氢钠
【知识衔接】
(1)碳酸钠(Na2CO3)俗名纯碱、苏打;碳酸氢钠(NaHCO3)俗名小苏打,二者都属于盐。
(2)Na2CO3和NaHCO3都能与盐酸反应生成NaCl、CO2和H2O,反应的化学方程式分别为Na2CO3+2HCl(足量)===2NaCl+CO2↑+H2O、NaHCO3+HCl===NaCl+CO2↑+H2O。
1.主要用途
(1)碳酸钠:用于纺织、制皂、造纸、制玻璃、制药、食用碱、工业用碱等。
(2)碳酸氢钠:可用于发酵粉、胃酸中和剂、食用碱、工业用碱等。
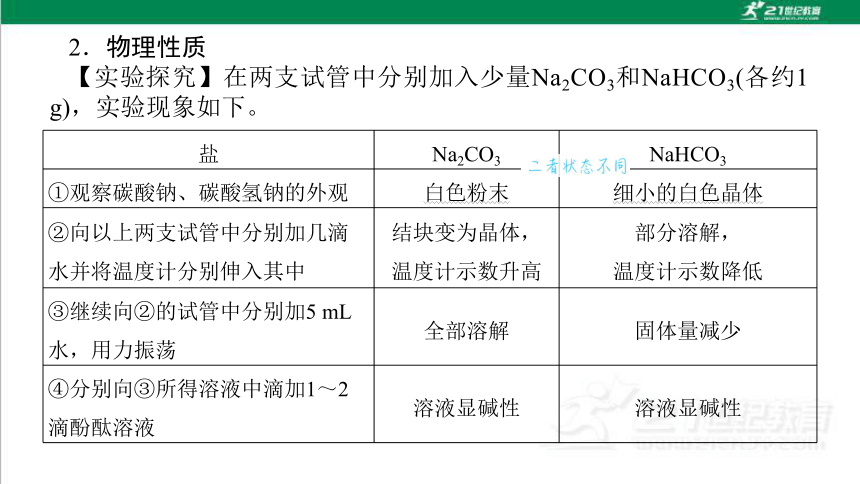
2.物理性质
【实验探究】在两支试管中分别加入少量Na2CO3和NaHCO3(各约1 g),实验现象如下。
盐 Na2CO3 NaHCO3
①观察碳酸钠、碳酸氢钠的外观 白色粉末 细小的白色晶体
②向以上两支试管中分别加几滴水并将温度计分别伸入其中 结块变为晶体,
温度计示数升高 部分溶解,
温度计示数降低
③继续向②的试管中分别加5 mL水,用力振荡 全部溶解 固体量减少
④分别向③所得溶液中滴加1~2滴酚酞溶液 溶液显碱性 溶液显碱性
【实验结论】
(1)碳酸钠:俗名纯碱,为白色粉末,易溶于水,溶解时________热量,水溶液呈碱性,遇少量水变成晶体(水合碳酸钠,化学式为Na2CO3·xH2O)。
(2)碳酸氢钠:俗名________,为细小的白色晶体,易溶于水,溶解时________热量,水溶液呈碱性,比碳酸钠溶解度________。
放出
小苏打
吸收
小
【师说·助学1】
已知Na2CO3粉末遇水生成碳酸钠晶体(Na2CO3·xH2O),碳酸钠晶体在干燥空气中易失去结晶水变成碳酸钠粉末。
钠长期露置在空气中,先后发生了哪些变化?用流程图表示。
答案:
【师说·助学2】 已知反应Na2CO3+CO2+H2O===2NaHCO3。向饱和Na2CO3溶液中通入过量CO2,预测会产生什么现象?说出你预测的依据。化学方程式为Na2CO3+CO2+H2O===2NaHCO3↓,注意沉淀符号。
答案:有晶体析出。CO2与饱和Na2CO3溶液反应生成NaHCO3,所得NaHCO3的质量比参加反应的Na2CO3的质量大,又由于常温下NaHCO3的溶解度小于Na2CO3,且反应过程中消耗了水,故会有NaHCO3晶体从溶液中析出。
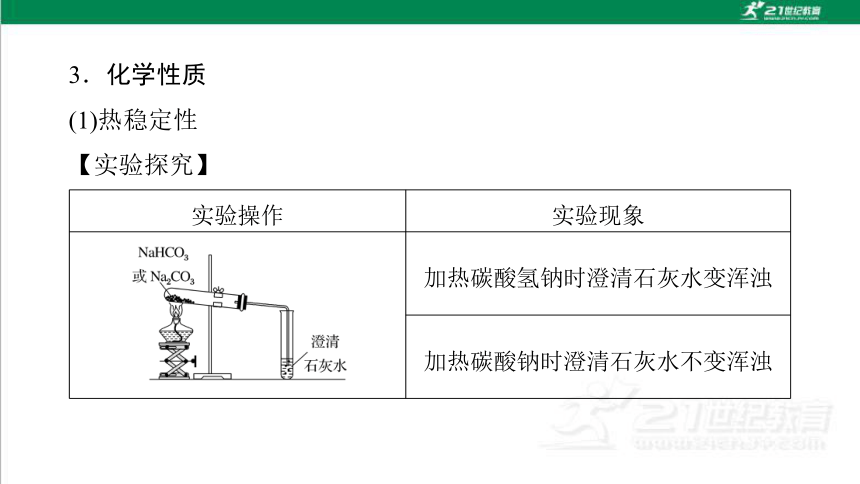
3.化学性质
(1)热稳定性
【实验探究】
实验操作 实验现象
加热碳酸氢钠时澄清石灰水变浑浊
加热碳酸钠时澄清石灰水不变浑浊
【实验结论】
①NaHCO3不稳定,受热易分解,化学方程式为
________________________________________。
②Na2CO3很稳定,受热不易分解。
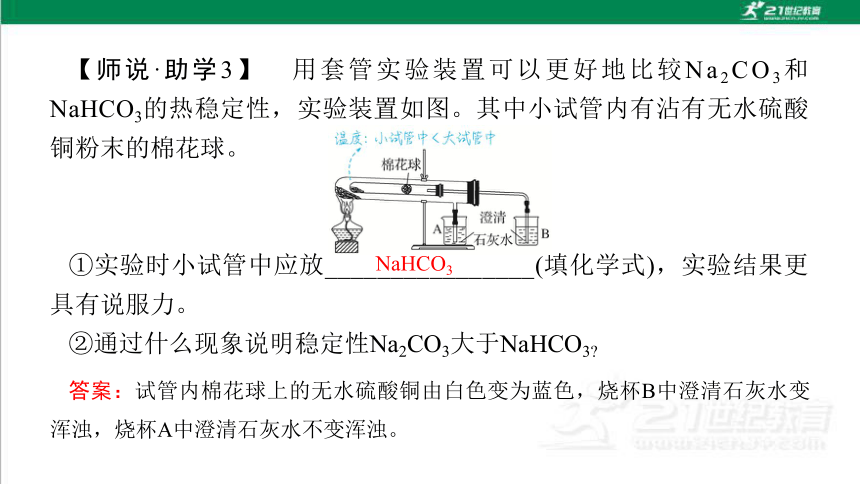
【师说·助学3】 用套管实验装置可以更好地比较Na2CO3和NaHCO3的热稳定性,实验装置如图。其中小试管内有沾有无水硫酸铜粉末的棉花球。
①实验时小试管中应放________________(填化学式),实验结果更具有说服力。
②通过什么现象说明稳定性Na2CO3大于NaHCO3
NaHCO3
答案:试管内棉花球上的无水硫酸铜由白色变为蓝色,烧杯B中澄清石灰水变浑浊,烧杯A中澄清石灰水不变浑浊。
(2)与酸的反应
【实验探究】
控制反应条件相同:所用盐酸完全相同,所用Na2CO3、NaHCO3的质量相同。
实验步骤及操作 在两支试管中分别加入3 mL同一稀盐酸,将两个分别装有0.3 g Na2CO3和0.3 g NaHCO3固体的小气球套在两支试管口,将气球内固体同时倒入试管中,观察现象
【实验现象】两支试管中都产生气泡,气球膨胀,加入碳酸氢钠的试管中产生气泡更快,气球膨胀得更大。
【实验结论】
①反应离子方程式:
________________________、________________________。
②相同条件下,________与酸反应产生CO2的速率更快。
碳酸氢钠
(3)与CaCl2、Ca(OH)2溶液的反应
【实验探究】
CaCl2 Ca(OH)2
实验操作
实验现象 加入稀Na2CO3溶液,立即产生白色沉淀,加入少量稀NaHCO3溶液,无明显现象 两支试管中都产生白色沉淀
【即学即练】
1.碳酸钠的化学性质如图所示,试写出反应①~③的化学方程式。
答案:
①Na2CO3+2HCl===2NaCl+H2O+CO2↑
②Na2CO3+Ca(OH)2===CaCO3↓+2NaOH
③Na2CO3+BaCl2===BaCO3↓+2NaCl
2.碳酸氢钠的化学性质如图所示,试写出反应①~④的化学方程式。
【归纳总结】
(1)NaHCO3既能与盐酸反应又能与氢氧化钠溶液反应,表示为
(2)Na2CO3与NaHCO3的相互转化关系表示如下。
知识点二 焰色试验
1.定义
根据火焰呈现的特征颜色,可以判断试样所含的________元素,这样的定性分析操作称为焰色试验。
2.操作(教材实验2-6)
(1)洗:用________洗净铂丝(或光洁无锈的铁丝)。本身在灼烧时不产生特征焰色
金属
盐酸
(2)烧:将洗净的铂丝(或光洁无锈的铁丝)在火焰上灼烧至与__________相同。
(3)蘸:蘸取试样。可以是单质或化合物,可以是固体或溶液
(4)烧:在无色的外焰上灼烧,并观察____________。 因为外焰颜色浅且温度高
3.几种常见元素的焰色
钠:______色,钾:______色(透过 观察),钡:______色,钙:______色,铜:______色。避免钠的黄色光干扰
原火焰颜色
火焰的颜色
黄
紫
蓝色钴玻璃
黄绿
砖红
绿
【师说·助学】 为什么用盐酸洗涤铂丝而不用硫酸洗涤铂丝?为什么用铂丝或铁丝等蘸取试剂做焰色试验,而不采用铜丝?
答案:盐酸沸点比硫酸低,加热时易挥发无残留。铂丝或铁丝做焰色试验时没有颜色,而铜在灼烧时有绿色的焰色。
【即学即练】
1.正误判断,错误的说明原因。
(1)可利用焰色试验来鉴别Na2CO3溶液和K2SO4溶液:_________。
(2)若某无色溶液的焰色试验观察到焰色为黄色,说明该溶液只含Na+无K+:_____________________________________。
(3)焰色试验是金属元素的化学性质:
____________________________________________。
正确
错误。说明溶液含Na+或者同时含有Na+和K+
错误。焰色试验属于金属元素的物理性质。
2.对焰色试验实验操作注意事项的下列说法,正确的是( )
①钾的火焰颜色,要透过蓝色钴玻璃观察
②先把铂丝灼烧到与原来火焰颜色相同,再蘸被检物质
③每次实验后,要用盐酸把铂丝洗净
④实验时最好选用本身颜色较浅的火焰
⑤没有铂丝,也可以用光洁无锈的铁丝代替
A.仅有③不正确 B.仅有④不正确
C.仅有⑤不正确 D.全对
答案:D
解析:焰色试验是靠观察火焰颜色来鉴别物质的,成功与否的关键是避免杂质和其他颜色的干扰。①是为了滤去黄光;②、③是为了除去铂丝上的杂质;④本身颜色越浅的火焰,焰色试验时干扰越小,被检物质的火焰颜色越明显;⑤焰色试验可用铂丝,也可用光洁无锈的铁丝代替。
02.素养落实
题型 Na2CO3与NaHCO3的鉴别
例1 (1)某课外小组在实验中,将盐酸逐滴滴加到碳酸钠溶液中,开始无气泡产生,一段时间后产生气泡。试分析其原因。
(2)若将碳酸钠溶液逐滴滴加到盐酸中,会观察到什么现象?写出发生反应的离子方程式。
例2 现有两瓶无标签的无色溶液,分别装有Na2CO3溶液和NaHCO3溶液,用下列试剂或方法能将两者区分的是( )
①Ca(OH)2 ②盐酸 ③CaCl2 ④NaOH ⑤加热
A.①③ B.①④ C.②③ D.②⑤
答案:C
解析:①④都是碱,加入Na2CO3、NaHCO3中,现象相同(①都有沉淀、④都无明显现象),所以①④不能区分。向Na2CO3溶液和NaHCO3溶液中加②盐酸,产生气泡速率快的是NaHCO3溶液,产生气泡速率慢的是Na2CO3溶液,可以区分。加入③CaCl2时,Na2CO3溶液中有沉淀生成,而NaHCO3溶液中无沉淀生成,可以区分。⑤加热法,因两者都是溶液,加热都不分解,故无法区分。
鉴别Na2CO3和NaHCO3的三种方法
【变式演练】
有两试管分别装有Na2CO3溶液和NaHCO3溶液,下列操作或判断正确的是( )
方案 操作 判断
A 分别加入澄清石灰水 产生沉淀者为Na2CO3
B 分别加入等浓度的稀盐酸 反应较剧烈者为Na2CO3
C 分别加入CaCl2溶液 产生沉淀者为Na2CO3
D 逐滴加入等浓度的盐酸 立即产生气泡者为Na2CO3
答案:C
解析:有关反应为Na2CO3+Ca(OH)2===CaCO3↓+2NaOH,Ca(OH)2+2NaHCO3===CaCO3↓+Na2CO3+2H2O。两者产生白色沉淀现象相同,A不正确;滴加等浓度的稀盐酸时,NaHCO3溶液反应更剧烈,B不正确;Na2CO3与CaCl2反应生成CaCO3白色沉淀,NaHCO3与CaCl2不反应,C正确;逐滴加入盐酸时,NaHCO3立即产生气泡,Na2CO3开始无明显现象,后有无色气体放出,D不正确。
第3课时 碳酸钠和碳酸氢钠 焰色试验
【课程目标】
1.结合真实情境中的应用实例或通过实验探究,了解Na2CO3、NaHCO3的主要性质,了解它们在生产、生活中的应用。
2.了解焰色试验的操作与应用。
01.夯基提能
知识点一 碳酸钠和碳酸氢钠
【知识衔接】
(1)碳酸钠(Na2CO3)俗名纯碱、苏打;碳酸氢钠(NaHCO3)俗名小苏打,二者都属于盐。
(2)Na2CO3和NaHCO3都能与盐酸反应生成NaCl、CO2和H2O,反应的化学方程式分别为Na2CO3+2HCl(足量)===2NaCl+CO2↑+H2O、NaHCO3+HCl===NaCl+CO2↑+H2O。
1.主要用途
(1)碳酸钠:用于纺织、制皂、造纸、制玻璃、制药、食用碱、工业用碱等。
(2)碳酸氢钠:可用于发酵粉、胃酸中和剂、食用碱、工业用碱等。
2.物理性质
【实验探究】在两支试管中分别加入少量Na2CO3和NaHCO3(各约1 g),实验现象如下。
盐 Na2CO3 NaHCO3
①观察碳酸钠、碳酸氢钠的外观 白色粉末 细小的白色晶体
②向以上两支试管中分别加几滴水并将温度计分别伸入其中 结块变为晶体,
温度计示数升高 部分溶解,
温度计示数降低
③继续向②的试管中分别加5 mL水,用力振荡 全部溶解 固体量减少
④分别向③所得溶液中滴加1~2滴酚酞溶液 溶液显碱性 溶液显碱性
【实验结论】
(1)碳酸钠:俗名纯碱,为白色粉末,易溶于水,溶解时________热量,水溶液呈碱性,遇少量水变成晶体(水合碳酸钠,化学式为Na2CO3·xH2O)。
(2)碳酸氢钠:俗名________,为细小的白色晶体,易溶于水,溶解时________热量,水溶液呈碱性,比碳酸钠溶解度________。
放出
小苏打
吸收
小
【师说·助学1】
已知Na2CO3粉末遇水生成碳酸钠晶体(Na2CO3·xH2O),碳酸钠晶体在干燥空气中易失去结晶水变成碳酸钠粉末。
钠长期露置在空气中,先后发生了哪些变化?用流程图表示。
答案:
【师说·助学2】 已知反应Na2CO3+CO2+H2O===2NaHCO3。向饱和Na2CO3溶液中通入过量CO2,预测会产生什么现象?说出你预测的依据。化学方程式为Na2CO3+CO2+H2O===2NaHCO3↓,注意沉淀符号。
答案:有晶体析出。CO2与饱和Na2CO3溶液反应生成NaHCO3,所得NaHCO3的质量比参加反应的Na2CO3的质量大,又由于常温下NaHCO3的溶解度小于Na2CO3,且反应过程中消耗了水,故会有NaHCO3晶体从溶液中析出。
3.化学性质
(1)热稳定性
【实验探究】
实验操作 实验现象
加热碳酸氢钠时澄清石灰水变浑浊
加热碳酸钠时澄清石灰水不变浑浊
【实验结论】
①NaHCO3不稳定,受热易分解,化学方程式为
________________________________________。
②Na2CO3很稳定,受热不易分解。
【师说·助学3】 用套管实验装置可以更好地比较Na2CO3和NaHCO3的热稳定性,实验装置如图。其中小试管内有沾有无水硫酸铜粉末的棉花球。
①实验时小试管中应放________________(填化学式),实验结果更具有说服力。
②通过什么现象说明稳定性Na2CO3大于NaHCO3
NaHCO3
答案:试管内棉花球上的无水硫酸铜由白色变为蓝色,烧杯B中澄清石灰水变浑浊,烧杯A中澄清石灰水不变浑浊。
(2)与酸的反应
【实验探究】
控制反应条件相同:所用盐酸完全相同,所用Na2CO3、NaHCO3的质量相同。
实验步骤及操作 在两支试管中分别加入3 mL同一稀盐酸,将两个分别装有0.3 g Na2CO3和0.3 g NaHCO3固体的小气球套在两支试管口,将气球内固体同时倒入试管中,观察现象
【实验现象】两支试管中都产生气泡,气球膨胀,加入碳酸氢钠的试管中产生气泡更快,气球膨胀得更大。
【实验结论】
①反应离子方程式:
________________________、________________________。
②相同条件下,________与酸反应产生CO2的速率更快。
碳酸氢钠
(3)与CaCl2、Ca(OH)2溶液的反应
【实验探究】
CaCl2 Ca(OH)2
实验操作
实验现象 加入稀Na2CO3溶液,立即产生白色沉淀,加入少量稀NaHCO3溶液,无明显现象 两支试管中都产生白色沉淀
【即学即练】
1.碳酸钠的化学性质如图所示,试写出反应①~③的化学方程式。
答案:
①Na2CO3+2HCl===2NaCl+H2O+CO2↑
②Na2CO3+Ca(OH)2===CaCO3↓+2NaOH
③Na2CO3+BaCl2===BaCO3↓+2NaCl
2.碳酸氢钠的化学性质如图所示,试写出反应①~④的化学方程式。
【归纳总结】
(1)NaHCO3既能与盐酸反应又能与氢氧化钠溶液反应,表示为
(2)Na2CO3与NaHCO3的相互转化关系表示如下。
知识点二 焰色试验
1.定义
根据火焰呈现的特征颜色,可以判断试样所含的________元素,这样的定性分析操作称为焰色试验。
2.操作(教材实验2-6)
(1)洗:用________洗净铂丝(或光洁无锈的铁丝)。本身在灼烧时不产生特征焰色
金属
盐酸
(2)烧:将洗净的铂丝(或光洁无锈的铁丝)在火焰上灼烧至与__________相同。
(3)蘸:蘸取试样。可以是单质或化合物,可以是固体或溶液
(4)烧:在无色的外焰上灼烧,并观察____________。 因为外焰颜色浅且温度高
3.几种常见元素的焰色
钠:______色,钾:______色(透过 观察),钡:______色,钙:______色,铜:______色。避免钠的黄色光干扰
原火焰颜色
火焰的颜色
黄
紫
蓝色钴玻璃
黄绿
砖红
绿
【师说·助学】 为什么用盐酸洗涤铂丝而不用硫酸洗涤铂丝?为什么用铂丝或铁丝等蘸取试剂做焰色试验,而不采用铜丝?
答案:盐酸沸点比硫酸低,加热时易挥发无残留。铂丝或铁丝做焰色试验时没有颜色,而铜在灼烧时有绿色的焰色。
【即学即练】
1.正误判断,错误的说明原因。
(1)可利用焰色试验来鉴别Na2CO3溶液和K2SO4溶液:_________。
(2)若某无色溶液的焰色试验观察到焰色为黄色,说明该溶液只含Na+无K+:_____________________________________。
(3)焰色试验是金属元素的化学性质:
____________________________________________。
正确
错误。说明溶液含Na+或者同时含有Na+和K+
错误。焰色试验属于金属元素的物理性质。
2.对焰色试验实验操作注意事项的下列说法,正确的是( )
①钾的火焰颜色,要透过蓝色钴玻璃观察
②先把铂丝灼烧到与原来火焰颜色相同,再蘸被检物质
③每次实验后,要用盐酸把铂丝洗净
④实验时最好选用本身颜色较浅的火焰
⑤没有铂丝,也可以用光洁无锈的铁丝代替
A.仅有③不正确 B.仅有④不正确
C.仅有⑤不正确 D.全对
答案:D
解析:焰色试验是靠观察火焰颜色来鉴别物质的,成功与否的关键是避免杂质和其他颜色的干扰。①是为了滤去黄光;②、③是为了除去铂丝上的杂质;④本身颜色越浅的火焰,焰色试验时干扰越小,被检物质的火焰颜色越明显;⑤焰色试验可用铂丝,也可用光洁无锈的铁丝代替。
02.素养落实
题型 Na2CO3与NaHCO3的鉴别
例1 (1)某课外小组在实验中,将盐酸逐滴滴加到碳酸钠溶液中,开始无气泡产生,一段时间后产生气泡。试分析其原因。
(2)若将碳酸钠溶液逐滴滴加到盐酸中,会观察到什么现象?写出发生反应的离子方程式。
例2 现有两瓶无标签的无色溶液,分别装有Na2CO3溶液和NaHCO3溶液,用下列试剂或方法能将两者区分的是( )
①Ca(OH)2 ②盐酸 ③CaCl2 ④NaOH ⑤加热
A.①③ B.①④ C.②③ D.②⑤
答案:C
解析:①④都是碱,加入Na2CO3、NaHCO3中,现象相同(①都有沉淀、④都无明显现象),所以①④不能区分。向Na2CO3溶液和NaHCO3溶液中加②盐酸,产生气泡速率快的是NaHCO3溶液,产生气泡速率慢的是Na2CO3溶液,可以区分。加入③CaCl2时,Na2CO3溶液中有沉淀生成,而NaHCO3溶液中无沉淀生成,可以区分。⑤加热法,因两者都是溶液,加热都不分解,故无法区分。
鉴别Na2CO3和NaHCO3的三种方法
【变式演练】
有两试管分别装有Na2CO3溶液和NaHCO3溶液,下列操作或判断正确的是( )
方案 操作 判断
A 分别加入澄清石灰水 产生沉淀者为Na2CO3
B 分别加入等浓度的稀盐酸 反应较剧烈者为Na2CO3
C 分别加入CaCl2溶液 产生沉淀者为Na2CO3
D 逐滴加入等浓度的盐酸 立即产生气泡者为Na2CO3
答案:C
解析:有关反应为Na2CO3+Ca(OH)2===CaCO3↓+2NaOH,Ca(OH)2+2NaHCO3===CaCO3↓+Na2CO3+2H2O。两者产生白色沉淀现象相同,A不正确;滴加等浓度的稀盐酸时,NaHCO3溶液反应更剧烈,B不正确;Na2CO3与CaCl2反应生成CaCO3白色沉淀,NaHCO3与CaCl2不反应,C正确;逐滴加入盐酸时,NaHCO3立即产生气泡,Na2CO3开始无明显现象,后有无色气体放出,D不正确。
