人教版高中化学必修第一册第二章海水中的重要元素——钠和氯2.2.2氯气的实验室制法氯离子的检验教学课件
文档属性
| 名称 | 人教版高中化学必修第一册第二章海水中的重要元素——钠和氯2.2.2氯气的实验室制法氯离子的检验教学课件 |  | |
| 格式 | ppt | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-11 19:42:07 | ||
图片预览




文档简介
(共18张PPT)
新人教版 化学 必修一
氯气的实验室制法
01
氯离子的检验
02
氯气的实验室制法
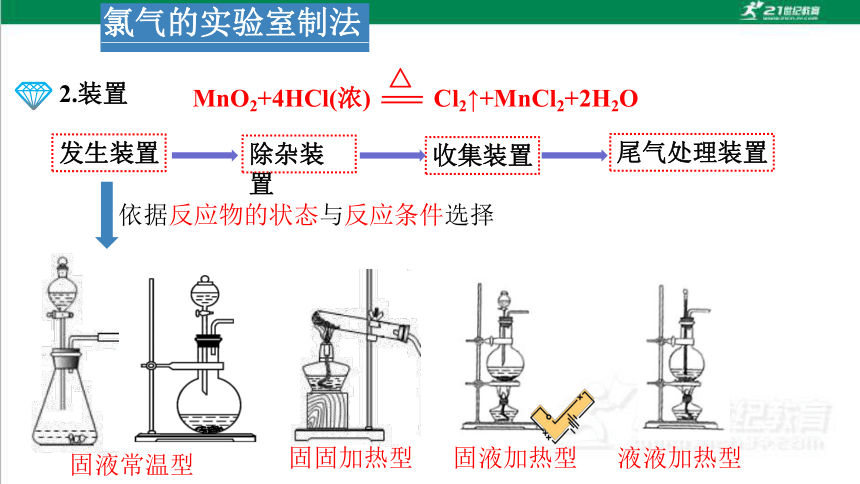
1.原理
MnO2+4HCl(浓) Cl2↑+MnCl2+2H2O
△
浓盐酸与二氧化锰加热制取氯气
MnO2+4H++2Cl- Cl2↑+Mn2++2H2O
△
氯气的实验室制法
2.装置
发生装置
除杂装置
收集装置
尾气处理装置
MnO2+4HCl(浓) Cl2↑+MnCl2+2H2O
△
依据反应物的状态与反应条件选择
固液常温型
固固加热型
固液加热型
液液加热型
氯气的实验室制法
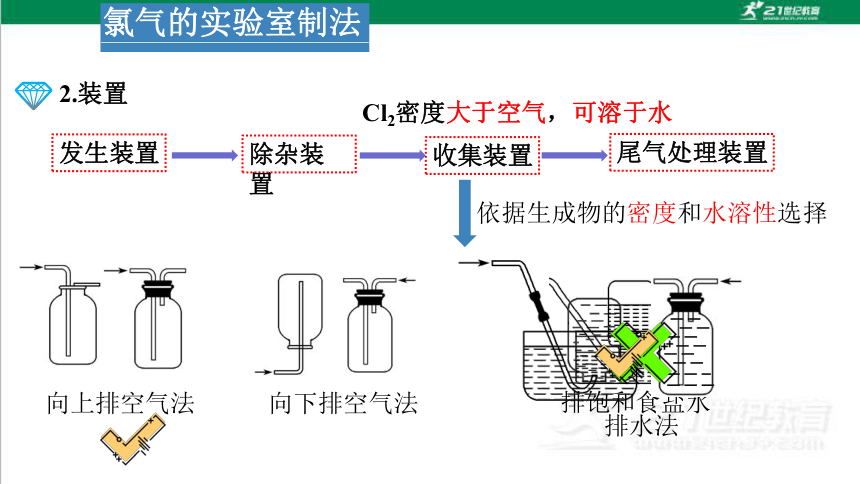
2.装置
发生装置
除杂装置
收集装置
尾气处理装置
依据生成物的密度和水溶性选择
排饱和食盐水
向上排空气法
向下排空气法
排水法
Cl2密度大于空气,可溶于水
氯气的实验室制法
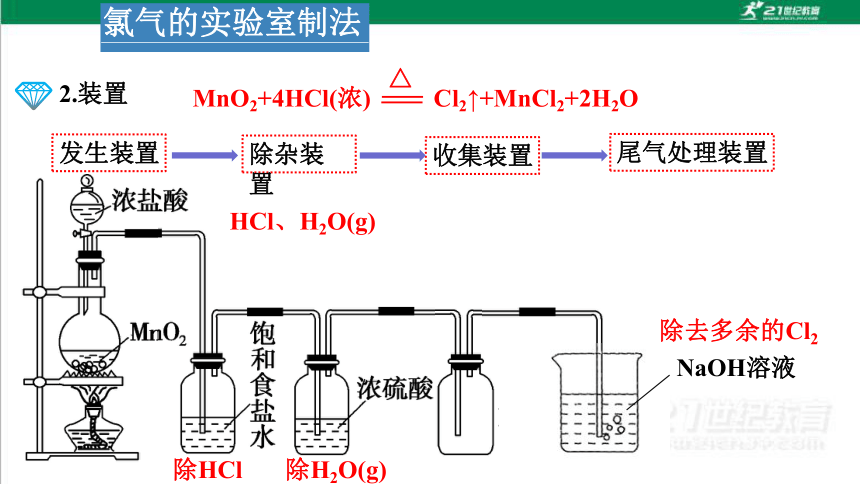
2.装置
发生装置
除杂装置
收集装置
尾气处理装置
MnO2+4HCl(浓) Cl2↑+MnCl2+2H2O
△
HCl、H2O(g)
除H2O(g)
除HCl
NaOH溶液
除去多余的Cl2
Cl2的实验室制法
氯气的实验室制法
3.氯气的验满方法
湿润的蓝色石蕊试纸先变红后变褪色,则收集满
观察集气瓶口呈黄绿色,则收集满
湿润的淀粉-KI试纸在集气瓶口变蓝,则收集满
原理:Cl2 + 2KI === I2 + 2KCl,置换出的I2遇淀粉变蓝
氯气的实验室制法
4.注意事项
实验结束后,先使反应停止并排出装置中残留的Cl2,
再拆卸装置,避免污染空气。
必须用浓盐酸,浓盐酸中部分Cl-的化合价升高,被氧化,
MnO2与稀盐酸不反应
为了减少制得的Cl2中HCl的含量,加热温度不宜过高,
以减少HCl的挥发。
尾气吸收时,不能用澄清石灰水吸收Cl2,因为溶液中Ca(OH)2浓度小,吸收不完全
氯气的实验室制法
知识拓展
快速制Cl2的方法
用KMnO4、KClO3、Ca(ClO)2、K2Cr2O7等氧化剂代替MnO2制取氯气,反应不需加热且反应速率较快
①2KMnO4+16HCl(浓)===2MnCl2+2KCl+5Cl2↑+8H2O
②KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O
③Ca(ClO)2+4HCl(浓)===CaCl2+2Cl2↑+2H2O
④K2Cr2O7+14HCl(浓)===2CrCl3+2KCl+3Cl2↑+7H2O
2MnO4-+16H++10Cl- ===2Mn2++5Cl2↑+8H2O
ClO3-+6H++5Cl-===3Cl2↑+3H2O
ClO-+2H++Cl-===Cl2↑+H2O
Cr2O72-+14H+ + 6Cl- ===2Cr3++3Cl2↑+7H2O
在三支试管中分别加入2~3mL稀盐酸、NaCl溶液、Na2CO3溶液,然后各滴入几滴AgNO3溶液,观察现象。再分别加入少量稀硝酸,观察现象。
实验2-9
氯离子的检验
实验试剂 实验现象 反应原理
稀盐酸
NaCl溶液
Na2CO3溶液
产生白色沉淀,
沉淀不溶解
HCl+AgNO3=AgCl↓+HNO3
产生白色沉淀,
沉淀不溶解
NaCl+AgNO3=AgCl↓+NaNO3
产生白色沉淀,
后沉淀溶解,产生气泡
Ag2CO3+2HNO3=CO2↑+H2O+2AgNO3
Ag++Cl-===AgCl↓
Ag++Cl-===AgCl↓
Na2CO3+2AgNO3=Ag2CO3↓+2NaNO3
2Ag++CO32-===Ag2CO3↓
Ag2CO3+2H+===CO2↑+H2O
氯离子的检验
氯离子的检验
1.检验原理
Ag++Cl-===AgCl↓
2.检验步骤
取少量待测液于试管中,先加入稀硝酸酸化,再加入硝酸应溶液,若白色沉淀生成,说明溶液中含有Cl-。
或者硝酸酸化的硝酸银溶液
1.实验室利用如图所示装置制备氯气,图中涉及气体发生、除杂、干燥、收集、尾气处理装置,其中错误的是( )
A.①②③ B.①②④ C.②③④ D.①③④
C
(1)烧杯中盛放的液体是___________,其作用是___________,水槽中盛放的液体是 ___ ________。
(2)简述操作过程:(从氯气已经产生开始)在收集氯气之前,
应_______________;当氯气纯度合乎要求时,应___________________;当氯气收集完毕时,应________________。
2.下图表示在没有通风橱时制取纯净的氯气设计的装置图,图中A、B是可控制的弹簧铁夹。
NaOH溶液
吸收多余的Cl2
饱和食盐水
打开B夹,关闭A夹
打开A夹,关闭B夹
打开B夹,关闭A夹
3.检验某溶液中是否含有Cl-,正确的操作是( )
A.取样,滴加AgNO3溶液,看是否有白色沉淀生成
B.取样,先加盐酸酸化,再加AgNO3溶液,看是否有白色沉淀生成
C.取样,先加稀硝酸酸化,再加入AgNO3溶液,看是否有白色沉淀生成
D.取样,加少量AgNO3溶液,有白色沉淀生成,再加稀盐酸,看白色沉淀是否消失
C
4.为确定某溶液中的离子组成,进行如下实验:
①取少量溶液加入稀盐酸至溶液呈酸性,产生使澄清石灰水变浑浊的无色无味气体
②在①溶液中再滴加Ba(NO3)2溶液,产生白色沉淀
③取②上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀根据实验现象,下列推断正确的是( )
A.一定有CO32- B.一定有Cl-
C.一定有SO42- D.一定有HCO3-
C
氯气的
实验室制法
01
氯离子的检验
02
存在与用途
MnO2+4H++2Cl- Cl2↑+Mn2++2H2O
△
Ag++Cl-===AgCl↓
新人教版 化学 必修一
氯气的实验室制法
01
氯离子的检验
02
氯气的实验室制法
1.原理
MnO2+4HCl(浓) Cl2↑+MnCl2+2H2O
△
浓盐酸与二氧化锰加热制取氯气
MnO2+4H++2Cl- Cl2↑+Mn2++2H2O
△
氯气的实验室制法
2.装置
发生装置
除杂装置
收集装置
尾气处理装置
MnO2+4HCl(浓) Cl2↑+MnCl2+2H2O
△
依据反应物的状态与反应条件选择
固液常温型
固固加热型
固液加热型
液液加热型
氯气的实验室制法
2.装置
发生装置
除杂装置
收集装置
尾气处理装置
依据生成物的密度和水溶性选择
排饱和食盐水
向上排空气法
向下排空气法
排水法
Cl2密度大于空气,可溶于水
氯气的实验室制法
2.装置
发生装置
除杂装置
收集装置
尾气处理装置
MnO2+4HCl(浓) Cl2↑+MnCl2+2H2O
△
HCl、H2O(g)
除H2O(g)
除HCl
NaOH溶液
除去多余的Cl2
Cl2的实验室制法
氯气的实验室制法
3.氯气的验满方法
湿润的蓝色石蕊试纸先变红后变褪色,则收集满
观察集气瓶口呈黄绿色,则收集满
湿润的淀粉-KI试纸在集气瓶口变蓝,则收集满
原理:Cl2 + 2KI === I2 + 2KCl,置换出的I2遇淀粉变蓝
氯气的实验室制法
4.注意事项
实验结束后,先使反应停止并排出装置中残留的Cl2,
再拆卸装置,避免污染空气。
必须用浓盐酸,浓盐酸中部分Cl-的化合价升高,被氧化,
MnO2与稀盐酸不反应
为了减少制得的Cl2中HCl的含量,加热温度不宜过高,
以减少HCl的挥发。
尾气吸收时,不能用澄清石灰水吸收Cl2,因为溶液中Ca(OH)2浓度小,吸收不完全
氯气的实验室制法
知识拓展
快速制Cl2的方法
用KMnO4、KClO3、Ca(ClO)2、K2Cr2O7等氧化剂代替MnO2制取氯气,反应不需加热且反应速率较快
①2KMnO4+16HCl(浓)===2MnCl2+2KCl+5Cl2↑+8H2O
②KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O
③Ca(ClO)2+4HCl(浓)===CaCl2+2Cl2↑+2H2O
④K2Cr2O7+14HCl(浓)===2CrCl3+2KCl+3Cl2↑+7H2O
2MnO4-+16H++10Cl- ===2Mn2++5Cl2↑+8H2O
ClO3-+6H++5Cl-===3Cl2↑+3H2O
ClO-+2H++Cl-===Cl2↑+H2O
Cr2O72-+14H+ + 6Cl- ===2Cr3++3Cl2↑+7H2O
在三支试管中分别加入2~3mL稀盐酸、NaCl溶液、Na2CO3溶液,然后各滴入几滴AgNO3溶液,观察现象。再分别加入少量稀硝酸,观察现象。
实验2-9
氯离子的检验
实验试剂 实验现象 反应原理
稀盐酸
NaCl溶液
Na2CO3溶液
产生白色沉淀,
沉淀不溶解
HCl+AgNO3=AgCl↓+HNO3
产生白色沉淀,
沉淀不溶解
NaCl+AgNO3=AgCl↓+NaNO3
产生白色沉淀,
后沉淀溶解,产生气泡
Ag2CO3+2HNO3=CO2↑+H2O+2AgNO3
Ag++Cl-===AgCl↓
Ag++Cl-===AgCl↓
Na2CO3+2AgNO3=Ag2CO3↓+2NaNO3
2Ag++CO32-===Ag2CO3↓
Ag2CO3+2H+===CO2↑+H2O
氯离子的检验
氯离子的检验
1.检验原理
Ag++Cl-===AgCl↓
2.检验步骤
取少量待测液于试管中,先加入稀硝酸酸化,再加入硝酸应溶液,若白色沉淀生成,说明溶液中含有Cl-。
或者硝酸酸化的硝酸银溶液
1.实验室利用如图所示装置制备氯气,图中涉及气体发生、除杂、干燥、收集、尾气处理装置,其中错误的是( )
A.①②③ B.①②④ C.②③④ D.①③④
C
(1)烧杯中盛放的液体是___________,其作用是___________,水槽中盛放的液体是 ___ ________。
(2)简述操作过程:(从氯气已经产生开始)在收集氯气之前,
应_______________;当氯气纯度合乎要求时,应___________________;当氯气收集完毕时,应________________。
2.下图表示在没有通风橱时制取纯净的氯气设计的装置图,图中A、B是可控制的弹簧铁夹。
NaOH溶液
吸收多余的Cl2
饱和食盐水
打开B夹,关闭A夹
打开A夹,关闭B夹
打开B夹,关闭A夹
3.检验某溶液中是否含有Cl-,正确的操作是( )
A.取样,滴加AgNO3溶液,看是否有白色沉淀生成
B.取样,先加盐酸酸化,再加AgNO3溶液,看是否有白色沉淀生成
C.取样,先加稀硝酸酸化,再加入AgNO3溶液,看是否有白色沉淀生成
D.取样,加少量AgNO3溶液,有白色沉淀生成,再加稀盐酸,看白色沉淀是否消失
C
4.为确定某溶液中的离子组成,进行如下实验:
①取少量溶液加入稀盐酸至溶液呈酸性,产生使澄清石灰水变浑浊的无色无味气体
②在①溶液中再滴加Ba(NO3)2溶液,产生白色沉淀
③取②上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀根据实验现象,下列推断正确的是( )
A.一定有CO32- B.一定有Cl-
C.一定有SO42- D.一定有HCO3-
C
氯气的
实验室制法
01
氯离子的检验
02
存在与用途
MnO2+4H++2Cl- Cl2↑+Mn2++2H2O
△
Ag++Cl-===AgCl↓
