人教版高中化学必修第一册第三章铁金属材料3.1.1铁的单质、氧化物、氢氧化物教学课件
文档属性
| 名称 | 人教版高中化学必修第一册第三章铁金属材料3.1.1铁的单质、氧化物、氢氧化物教学课件 |

|
|
| 格式 | ppt | ||
| 文件大小 | 6.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-11 19:43:53 | ||
图片预览







文档简介
(共27张PPT)
铁的单质、氧化物、氢氧化物
第1课时
第一节 铁及其化合物
第三章 铁 金属材料
情景引入
FeSO4·7H2O
(绿矾)
FeCl3·6H2O
铁粉
FeSO4溶液
FeCl3溶液
实验室中的铁元素
生活中的铁元素
铁锅
涂料 Fe2O3
补铁保健品
硫酸亚铁
乳酸亚铁等
人体中的铁元素
铁是人体必需的微量元素中含量最多的一种(约4~5克)
缺铁会导致人的记忆能力、免疫能力和对温度的适应能力等生理功能下降
1.铁的存在和冶炼
(1)存在
目标一 铁的单质
陨铁(Fe)
黄铁矿(FeS2)
赤铁矿(Fe2O3)
磁铁矿(Fe3O4)
游离态
0
+2
+3
+2、+3
铁元素在地壳中的含量排在第四位,仅次于氧、硅、铝,是含量第二多的金属元素。
(2)冶炼
Fe2O3+3CO===2Fe+3CO2
高温
用还原的方法把铁从铁矿石中提炼出来
古代炼铁
化合态
2.铁的物理性质
铁有延展性、导热性、导电性,但其导电性不如铜和铝,铁还能被磁体吸引,其熔、沸点较高。
目标一 铁的单质
为什么铁片是银白色,而铁粉却是黑色?
提示 金属小颗粒能反射光线。而小颗粒的分布是非常混乱的,所以不能像镜面一样把入射光线定向地反射回去。入射光线进到金属小颗粒中,就像进了“迷魂阵”,从一个小颗粒反射到另一个颗粒,这样反射过来又反射回去,光线越来越弱,很少按入射方向返回去,因此看上去是黑色的。
思考
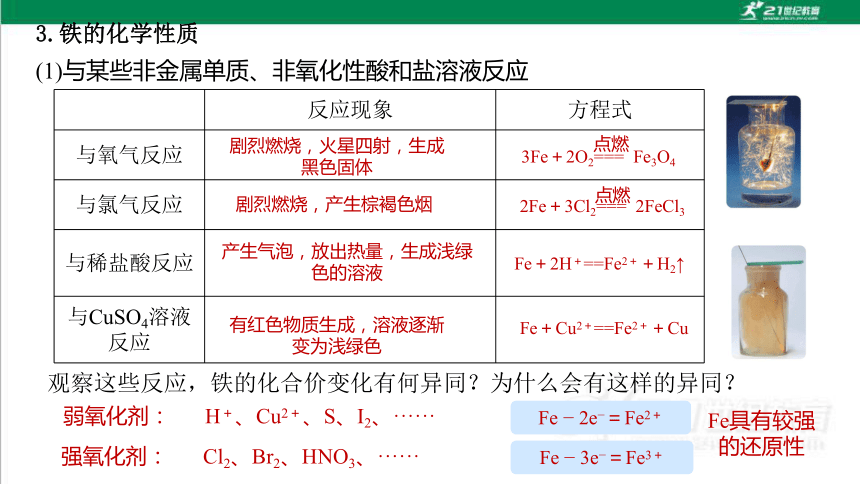
3.铁的化学性质
(1)与某些非金属单质、非氧化性酸和盐溶液反应
反应现象 方程式
与氧气反应
与氯气反应
与稀盐酸反应
与CuSO4溶液反应
剧烈燃烧,火星四射,生成黑色固体
剧烈燃烧,产生棕褐色烟
产生气泡,放出热量,生成浅绿色的溶液
有红色物质生成,溶液逐渐变为浅绿色
Fe+Cu2+==Fe2++Cu
Fe+2H+==Fe2++H2↑
3Fe+2O2=== Fe3O4
点燃
2Fe+3Cl2=== 2FeCl3
点燃
观察这些反应,铁的化合价变化有何异同?为什么会有这样的异同?
Fe 2e =Fe2+
Fe 3e =Fe3+
强氧化剂:
弱氧化剂:
Cl2、Br2、HNO3、······
H+、Cu2+、S、I2、······
Fe具有较强的还原性
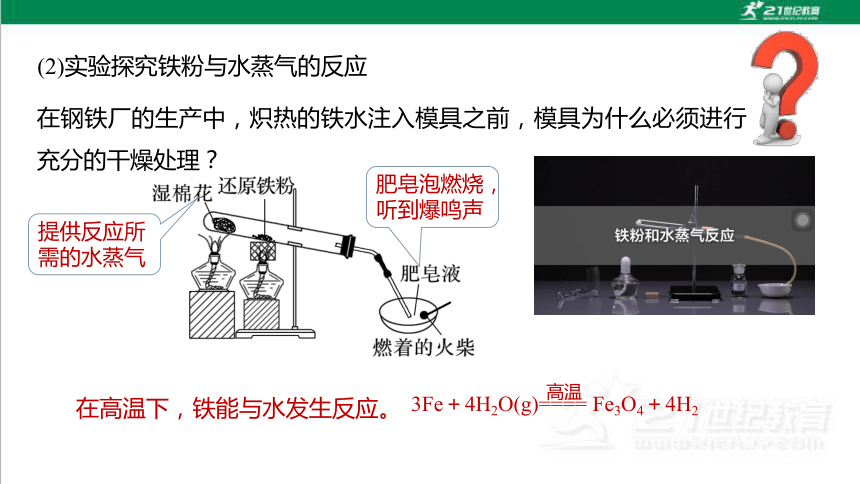
(2)实验探究铁粉与水蒸气的反应
在钢铁厂的生产中,炽热的铁水注入模具之前,模具为什么必须进行充分的干燥处理?
在高温下,铁能与水发生反应。
3Fe+4H2O(g)==== Fe3O4+4H2
高温
提供反应所需的水蒸气
肥皂泡燃烧,听到爆鸣声
金属与水反应的规律
1.K、Ca、Na等可以和冷水作用,生成可溶性碱和氢气。
2.Mg、Al很难与冷水反应,但是可与沸水迅速反应,生成难溶性碱和氢气。
3.Zn、Fe、Sn、Pb要和高温水蒸气反应,生成不溶性氧化物和氢气。
4.Cu、Hg、Ag、Pt、Au则不与水作用。
归纳总结
小结:
金属活动性顺序表中,金属越活泼,越容易与水反应,反应越剧烈。
判断正误
(1)由于铁单质性质比较活泼,所以自然界中没有游离态的铁单质( )
(2)铁与AgNO3、ZnCl2等盐溶液均能发生反应生成Fe2+( )
(3)分离铁粉与铜粉的混合物时,只能用化学方法( )
(4)1 mol Fe与水蒸气高温下反应转移 mol e-( )
×
练习1
×
×
√
某些化合物可由两种单质加热直接反应生成。下列化合物不符合上述条件的是
A.FeS B.FeCl2 C.FeCl3 D.Fe3O4
练习2
√
Fe和Cl2反应生成FeCl3而不是FeCl2。
情景引入
红砖和青砖都是日常生活中常见的建筑材料。
两者颜色不同是其中所含的铁的氧化物不同,你认为红砖和青砖中分别含有什么氧化物呢?
红砖中含的是Fe2O3;青砖中含的是Fe3O4
将用黏土制成的砖坯置于窑内,先用大火将砖坯从外向内烧透,停火,使砖和窑体慢慢冷却下来,在这个过程中,由于空气充足,砖坯中的铁元素被氧化成Fe2O3(棕红色)使砖呈现红色。
思考:
为什么不是氧化亚铁呢?
氧化亚铁不稳定
烧制砖瓦时,向窑内添加大量的煤炭后封窑1天,从窑顶向下慢慢浇水7天,水蒸气和窑内高温的炭发生化学反应产生大量的还原气体(H2和CO)他们把Fe2O3又逐渐还原成为Fe3O4而制得青砖。
氧化亚铁(FeO) 氧化铁(Fe2O3) 四氧化三铁(Fe3O4)
俗称 — 铁红 磁性氧化铁
颜色、状态 黑色粉末 红棕色粉末 黑色晶体(有磁性)
溶解性 不溶于水
类别 碱性氧化物 碱性氧化物 不是碱性氧化物
铁的价态 +2 +3 +2、+3
与H+反应的离子方程式 FeO+2H+===
Fe2++H2O 6H++Fe2O3===
2Fe3++3H2O Fe3O4+8H+===2Fe3++Fe2++4H2O
稳定性 6FeO+O2 2Fe3O4 稳定 稳定
与CO、C、H2反应 生成单质铁及CO2或H2O
用途 Fe2O3常用作油漆、涂料、油墨和橡胶的红色颜料,赤铁矿(主要成分是Fe2O3)是炼铁的原料
1.铁的氧化物
目标二 铁的氧化物和氢氧化物
2.铁的氢氧化物
(1)铁的氢氧化物的制备
反应原理:Fe(OH)3与Fe(OH)2分别由相应的可溶性盐与可溶性碱反应而制得。
Fe(OH)2 Fe(OH)3
操作
现象 产生白色絮状沉淀,迅速变为灰绿色,最终变为红褐色沉淀 生成红褐色沉淀
离子方程式 Fe2++2OH-===Fe(OH)2↓;4Fe(OH)2+O2+H2O===4Fe(OH)3 Fe3++3OH-===Fe(OH)3↓
实验结论 Fe(OH)2很不稳定,极易转化为Fe(OH)3
如图是制备氢氧化亚铁的改进装置,思考并回答下列问题:
(1)配制NaOH和FeSO4溶液的蒸馏水要经过__________,
目的是________________。
(2)在FeSO4溶液表面覆盖一层苯(一种有机溶剂,难溶于水,
密度比水小)的作用是__________________________________
______。
(3)将吸有NaOH溶液的长滴管伸入FeSO4溶液液面以下,其目的是__________
______________________。
思考
加热煮沸
赶走溶解的氧气
隔绝空气,防止生成的氢氧化亚铁被
氧化
防止滴加
NaOH溶液时带入空气
(2)Fe(OH)2和Fe(OH)3的比较
Fe(OH)2 Fe(OH)3
颜色、状态 白色固体 红褐色固体
溶解性 不溶于水 不溶于水
与非氧化性强酸反应的离子方程式 Fe(OH)2+2H+=== Fe2++2H2O Fe(OH)3+3H+===Fe3++3H2O
稳定性 Fe(OH)2 FeO+H2O(隔绝空气) 2Fe(OH)3 Fe2O3+3H2O
判断正误
(1)磁铁矿的主要成分是Fe3O4( )
(2)FeO在空气中加热生成Fe2O3( )
(3)Fe3O4中铁的化合价有+2和+3价,是一种混合物( )
(4)Fe(OH)3不能利用化合反应生成( )
(5)因为Fe(OH)2易被氧化,所以在制备时要隔绝空气( )
√
练习1
×
×
×
√
下列有关铁的化合物的说法不正确的是
A.Fe(OH)2不稳定,具有较强的氧化性
B.FeO、Fe2O3均为碱性氧化物,均可与盐酸反应
C.Fe(OH)3可通过化合反应得到,Fe(OH)2则不能
D.Fe3O4为磁性氧化铁,其中铁的化合价为+2和+3
练习2
√
Fe(OH)2中的Fe2+具有还原性,可被空气中的O2氧化为Fe(OH)3,A项错误;
FeO、Fe2O3均为碱性氧化物,故具有碱性氧化物的通性,都能与盐酸反应,B项正确;
Fe(OH)2只能通过复分解反应得到,Fe(OH)3可由Fe(OH)2与O2、H2O发生化合反应得到,C项正确;
Fe3O4俗称磁性氧化铁,其组成可表示为FeO·Fe2O3,Fe元素的化合价为+2和+3,D项正确。
1.下列说法正确的是
A.我国在战国中期就开始使用铁制品
B.自然界中的铁元素只存在于化合物中
C.铁能与所有金属的盐溶液反应生成亚铁盐和金属
D.高炉炼铁是用还原剂将铁从它的化合物中还原出来
√
1
2
3
自我测试
我国目前发现最早的人工冶铁制品是春秋初年秦国的铜柄铁剑,A项错误;
陨铁中的Fe以单质形态存在,B项错误;
Fe只能将金属活动性比它弱的金属从其盐溶液中置换出来,C项错误;
高炉炼铁是用CO等还原剂把Fe从铁矿石中还原出来,D项正确。
1
2
3
自我测试
2.用如图所示装置进行Fe与水蒸气反应的实验,下列有关说法不正确的是
A.装置A的作用是为实验提供持续不断的水
蒸气
B.装置B中反应的化学方程式是2Fe+3H2O(g)
Fe2O3+3H2
C.装置C中加入的固体干燥剂可能是碱石灰
D.点燃装置D处的气体前必须检验气体的纯度
√
自我测试
1
2
3
装置A将液态H2O转化为水蒸气,与装置B中的铁粉在高温下发生反应,A项正确;
铁粉与H2O(g)在高温下发生反应,生成Fe3O4和H2,B项错误;
自我测试
1
2
3
因生成的H2中含有较多的水蒸气,故需要用碱石灰等不与H2反应的干燥剂进行干燥,C项正确;
不纯的H2在点燃时可能会发生爆炸,故在点燃H2前必须检验其纯度,D项正确。
3.如图所示装置可用来制取Fe(OH)2并观察其在空气中被氧化的颜色变化。实验时必须使用铁屑、稀硫酸和NaOH溶液。
(1)在试管Ⅰ中加入的试剂是_____________。
(2)在试管Ⅱ中加入的试剂是___________。
稀硫酸、铁屑
自我测试
1
2
3
NaOH溶液
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和试管Ⅱ中加入试剂,塞紧塞子后的实验步骤是_________________________________________________________
______________。
打开止水夹a,待试管Ⅰ中反应生成的氢气排尽装置中的空气后,再关闭止水夹a
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是_____________________________________________
____________________。
(5)实验完毕,拔去试管Ⅱ中的橡胶塞,放入一部分空气,此时试管Ⅱ中发生反应的化学方程式为_______________
_________________。
自我测试
1
2
3
试管Ⅰ中反应生成的H2充满了试管Ⅰ和试管Ⅱ,且外界空气不容易进入
4Fe(OH)2+2H2O
铁的单质、氧化物、氢氧化物
第1课时
第一节 铁及其化合物
第三章 铁 金属材料
情景引入
FeSO4·7H2O
(绿矾)
FeCl3·6H2O
铁粉
FeSO4溶液
FeCl3溶液
实验室中的铁元素
生活中的铁元素
铁锅
涂料 Fe2O3
补铁保健品
硫酸亚铁
乳酸亚铁等
人体中的铁元素
铁是人体必需的微量元素中含量最多的一种(约4~5克)
缺铁会导致人的记忆能力、免疫能力和对温度的适应能力等生理功能下降
1.铁的存在和冶炼
(1)存在
目标一 铁的单质
陨铁(Fe)
黄铁矿(FeS2)
赤铁矿(Fe2O3)
磁铁矿(Fe3O4)
游离态
0
+2
+3
+2、+3
铁元素在地壳中的含量排在第四位,仅次于氧、硅、铝,是含量第二多的金属元素。
(2)冶炼
Fe2O3+3CO===2Fe+3CO2
高温
用还原的方法把铁从铁矿石中提炼出来
古代炼铁
化合态
2.铁的物理性质
铁有延展性、导热性、导电性,但其导电性不如铜和铝,铁还能被磁体吸引,其熔、沸点较高。
目标一 铁的单质
为什么铁片是银白色,而铁粉却是黑色?
提示 金属小颗粒能反射光线。而小颗粒的分布是非常混乱的,所以不能像镜面一样把入射光线定向地反射回去。入射光线进到金属小颗粒中,就像进了“迷魂阵”,从一个小颗粒反射到另一个颗粒,这样反射过来又反射回去,光线越来越弱,很少按入射方向返回去,因此看上去是黑色的。
思考
3.铁的化学性质
(1)与某些非金属单质、非氧化性酸和盐溶液反应
反应现象 方程式
与氧气反应
与氯气反应
与稀盐酸反应
与CuSO4溶液反应
剧烈燃烧,火星四射,生成黑色固体
剧烈燃烧,产生棕褐色烟
产生气泡,放出热量,生成浅绿色的溶液
有红色物质生成,溶液逐渐变为浅绿色
Fe+Cu2+==Fe2++Cu
Fe+2H+==Fe2++H2↑
3Fe+2O2=== Fe3O4
点燃
2Fe+3Cl2=== 2FeCl3
点燃
观察这些反应,铁的化合价变化有何异同?为什么会有这样的异同?
Fe 2e =Fe2+
Fe 3e =Fe3+
强氧化剂:
弱氧化剂:
Cl2、Br2、HNO3、······
H+、Cu2+、S、I2、······
Fe具有较强的还原性
(2)实验探究铁粉与水蒸气的反应
在钢铁厂的生产中,炽热的铁水注入模具之前,模具为什么必须进行充分的干燥处理?
在高温下,铁能与水发生反应。
3Fe+4H2O(g)==== Fe3O4+4H2
高温
提供反应所需的水蒸气
肥皂泡燃烧,听到爆鸣声
金属与水反应的规律
1.K、Ca、Na等可以和冷水作用,生成可溶性碱和氢气。
2.Mg、Al很难与冷水反应,但是可与沸水迅速反应,生成难溶性碱和氢气。
3.Zn、Fe、Sn、Pb要和高温水蒸气反应,生成不溶性氧化物和氢气。
4.Cu、Hg、Ag、Pt、Au则不与水作用。
归纳总结
小结:
金属活动性顺序表中,金属越活泼,越容易与水反应,反应越剧烈。
判断正误
(1)由于铁单质性质比较活泼,所以自然界中没有游离态的铁单质( )
(2)铁与AgNO3、ZnCl2等盐溶液均能发生反应生成Fe2+( )
(3)分离铁粉与铜粉的混合物时,只能用化学方法( )
(4)1 mol Fe与水蒸气高温下反应转移 mol e-( )
×
练习1
×
×
√
某些化合物可由两种单质加热直接反应生成。下列化合物不符合上述条件的是
A.FeS B.FeCl2 C.FeCl3 D.Fe3O4
练习2
√
Fe和Cl2反应生成FeCl3而不是FeCl2。
情景引入
红砖和青砖都是日常生活中常见的建筑材料。
两者颜色不同是其中所含的铁的氧化物不同,你认为红砖和青砖中分别含有什么氧化物呢?
红砖中含的是Fe2O3;青砖中含的是Fe3O4
将用黏土制成的砖坯置于窑内,先用大火将砖坯从外向内烧透,停火,使砖和窑体慢慢冷却下来,在这个过程中,由于空气充足,砖坯中的铁元素被氧化成Fe2O3(棕红色)使砖呈现红色。
思考:
为什么不是氧化亚铁呢?
氧化亚铁不稳定
烧制砖瓦时,向窑内添加大量的煤炭后封窑1天,从窑顶向下慢慢浇水7天,水蒸气和窑内高温的炭发生化学反应产生大量的还原气体(H2和CO)他们把Fe2O3又逐渐还原成为Fe3O4而制得青砖。
氧化亚铁(FeO) 氧化铁(Fe2O3) 四氧化三铁(Fe3O4)
俗称 — 铁红 磁性氧化铁
颜色、状态 黑色粉末 红棕色粉末 黑色晶体(有磁性)
溶解性 不溶于水
类别 碱性氧化物 碱性氧化物 不是碱性氧化物
铁的价态 +2 +3 +2、+3
与H+反应的离子方程式 FeO+2H+===
Fe2++H2O 6H++Fe2O3===
2Fe3++3H2O Fe3O4+8H+===2Fe3++Fe2++4H2O
稳定性 6FeO+O2 2Fe3O4 稳定 稳定
与CO、C、H2反应 生成单质铁及CO2或H2O
用途 Fe2O3常用作油漆、涂料、油墨和橡胶的红色颜料,赤铁矿(主要成分是Fe2O3)是炼铁的原料
1.铁的氧化物
目标二 铁的氧化物和氢氧化物
2.铁的氢氧化物
(1)铁的氢氧化物的制备
反应原理:Fe(OH)3与Fe(OH)2分别由相应的可溶性盐与可溶性碱反应而制得。
Fe(OH)2 Fe(OH)3
操作
现象 产生白色絮状沉淀,迅速变为灰绿色,最终变为红褐色沉淀 生成红褐色沉淀
离子方程式 Fe2++2OH-===Fe(OH)2↓;4Fe(OH)2+O2+H2O===4Fe(OH)3 Fe3++3OH-===Fe(OH)3↓
实验结论 Fe(OH)2很不稳定,极易转化为Fe(OH)3
如图是制备氢氧化亚铁的改进装置,思考并回答下列问题:
(1)配制NaOH和FeSO4溶液的蒸馏水要经过__________,
目的是________________。
(2)在FeSO4溶液表面覆盖一层苯(一种有机溶剂,难溶于水,
密度比水小)的作用是__________________________________
______。
(3)将吸有NaOH溶液的长滴管伸入FeSO4溶液液面以下,其目的是__________
______________________。
思考
加热煮沸
赶走溶解的氧气
隔绝空气,防止生成的氢氧化亚铁被
氧化
防止滴加
NaOH溶液时带入空气
(2)Fe(OH)2和Fe(OH)3的比较
Fe(OH)2 Fe(OH)3
颜色、状态 白色固体 红褐色固体
溶解性 不溶于水 不溶于水
与非氧化性强酸反应的离子方程式 Fe(OH)2+2H+=== Fe2++2H2O Fe(OH)3+3H+===Fe3++3H2O
稳定性 Fe(OH)2 FeO+H2O(隔绝空气) 2Fe(OH)3 Fe2O3+3H2O
判断正误
(1)磁铁矿的主要成分是Fe3O4( )
(2)FeO在空气中加热生成Fe2O3( )
(3)Fe3O4中铁的化合价有+2和+3价,是一种混合物( )
(4)Fe(OH)3不能利用化合反应生成( )
(5)因为Fe(OH)2易被氧化,所以在制备时要隔绝空气( )
√
练习1
×
×
×
√
下列有关铁的化合物的说法不正确的是
A.Fe(OH)2不稳定,具有较强的氧化性
B.FeO、Fe2O3均为碱性氧化物,均可与盐酸反应
C.Fe(OH)3可通过化合反应得到,Fe(OH)2则不能
D.Fe3O4为磁性氧化铁,其中铁的化合价为+2和+3
练习2
√
Fe(OH)2中的Fe2+具有还原性,可被空气中的O2氧化为Fe(OH)3,A项错误;
FeO、Fe2O3均为碱性氧化物,故具有碱性氧化物的通性,都能与盐酸反应,B项正确;
Fe(OH)2只能通过复分解反应得到,Fe(OH)3可由Fe(OH)2与O2、H2O发生化合反应得到,C项正确;
Fe3O4俗称磁性氧化铁,其组成可表示为FeO·Fe2O3,Fe元素的化合价为+2和+3,D项正确。
1.下列说法正确的是
A.我国在战国中期就开始使用铁制品
B.自然界中的铁元素只存在于化合物中
C.铁能与所有金属的盐溶液反应生成亚铁盐和金属
D.高炉炼铁是用还原剂将铁从它的化合物中还原出来
√
1
2
3
自我测试
我国目前发现最早的人工冶铁制品是春秋初年秦国的铜柄铁剑,A项错误;
陨铁中的Fe以单质形态存在,B项错误;
Fe只能将金属活动性比它弱的金属从其盐溶液中置换出来,C项错误;
高炉炼铁是用CO等还原剂把Fe从铁矿石中还原出来,D项正确。
1
2
3
自我测试
2.用如图所示装置进行Fe与水蒸气反应的实验,下列有关说法不正确的是
A.装置A的作用是为实验提供持续不断的水
蒸气
B.装置B中反应的化学方程式是2Fe+3H2O(g)
Fe2O3+3H2
C.装置C中加入的固体干燥剂可能是碱石灰
D.点燃装置D处的气体前必须检验气体的纯度
√
自我测试
1
2
3
装置A将液态H2O转化为水蒸气,与装置B中的铁粉在高温下发生反应,A项正确;
铁粉与H2O(g)在高温下发生反应,生成Fe3O4和H2,B项错误;
自我测试
1
2
3
因生成的H2中含有较多的水蒸气,故需要用碱石灰等不与H2反应的干燥剂进行干燥,C项正确;
不纯的H2在点燃时可能会发生爆炸,故在点燃H2前必须检验其纯度,D项正确。
3.如图所示装置可用来制取Fe(OH)2并观察其在空气中被氧化的颜色变化。实验时必须使用铁屑、稀硫酸和NaOH溶液。
(1)在试管Ⅰ中加入的试剂是_____________。
(2)在试管Ⅱ中加入的试剂是___________。
稀硫酸、铁屑
自我测试
1
2
3
NaOH溶液
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和试管Ⅱ中加入试剂,塞紧塞子后的实验步骤是_________________________________________________________
______________。
打开止水夹a,待试管Ⅰ中反应生成的氢气排尽装置中的空气后,再关闭止水夹a
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是_____________________________________________
____________________。
(5)实验完毕,拔去试管Ⅱ中的橡胶塞,放入一部分空气,此时试管Ⅱ中发生反应的化学方程式为_______________
_________________。
自我测试
1
2
3
试管Ⅰ中反应生成的H2充满了试管Ⅰ和试管Ⅱ,且外界空气不容易进入
4Fe(OH)2+2H2O
