人教版高中化学必修第一册第三章铁金属材料3.2.2物质的量在化学方程式计算中的应用教学课件
文档属性
| 名称 | 人教版高中化学必修第一册第三章铁金属材料3.2.2物质的量在化学方程式计算中的应用教学课件 |

|
|
| 格式 | ppt | ||
| 文件大小 | 487.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-11 19:44:12 | ||
图片预览






文档简介
(共16张PPT)
第三章 铁 金属材料
第二节金属材料
第2课时
—物质的量在化学方程式计算中的应用
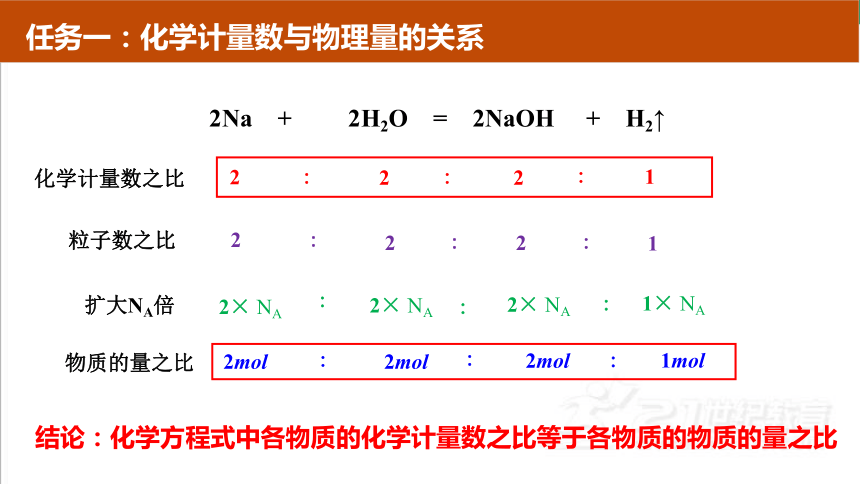
2Na + 2H2O = 2NaOH + H2↑
化学计量数之比
扩大NA倍
物质的量之比
2mol
2mol
2mol
1mol
∶
∶
∶
结论:化学方程式中各物质的化学计量数之比等于各物质的物质的量之比
2
1
∶
∶
2
2
∶
粒子数之比
2× NA
2× NA
2× NA
1× NA
∶
∶
2
1
∶
∶
2
2
∶
∶
任务一:化学计量数与物理量的关系
【例1】250ml 2mol/L的硫酸与足量的铁屑完全反应。计算:
(1)参加反应的铁屑的物质的量;(2)生成H2的体积(标准状况)。
计算出参加反应的H2SO4的物质的量:
n(H2SO4)=c(H2SO4)×V=2mol/L×0.25L=0.5mol
反应方程式:Fe + H2SO4 = FeSO4 + H2↑
1 1
n(Fe) 0.5mol
1 n(Fe)
1 0.5mol
=
n(Fe)=0.5 mol
任务二:物质的量在化学方程式计算中的应用
比例式法(单一体系)
【例1】250ml 2mol/L的硫酸与足量的铁屑完全反应。计算:
(1)参加反应的铁屑的物质的量;(2)生成H2的体积(标准状况)。
Fe + H2SO4 = FeSO4 + H2↑
1mol 22.4L
0.5mol V(H2)
1mol 22.4L
0.5mol V(H2)
=
V(H2)=11.2 L
上下一致,左右相当
比例式法(单一体系)
任务二:物质的量在化学方程式计算中的应用
任务二:物质的量在化学方程式计算中的应用
应用比例式法计算的基本步骤
(1)写出有关的化学方程式
(2)找到已知量与未知量
(3)列出比例式
(4)求解
【练习】把5.4 g Al 放入足量氢氧化钠溶液中完全反应,计算生成
氢气的体积(标准状况)?
n=
m
M
=
5.4 g
27 g/mol
=0.2mol
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2 3
0.2mol n(H2)
n(H2)= 0.3 mol
V(H2)= n(H2) × Vm
=6.72 L
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2 mol 67.2L
0.2mol V(H2)
V(H2)= 6.72L
法二:
法一:
任务二:物质的量在化学方程式计算中的应用
2 0.2mol
3 n(H2)
=
2mol 67.2L
0.2mol V(H2)
=
【例2】把5.1g镁铝合金的粉末放入过量的盐酸中,得到5.6LH2(标准状况)
试计算:(1)该合金中铝的质量分数;(2)该合金中铝和镁的物质的量之比。
n(H2)=5.6L÷22.4L/mol=0.25mol
解:设合金中镁的物质的量为x,铝的物质的量为y。
Mg +2HCl=MgCl 2 + H2↑
2Al +6HCl=2AlCl 3 +3H2↑
x ×24 +y×27= 5.1
x + y = 0.25
3
2
解得: x =y=0.1mol
(1)铝的质量分数为:
0.1 mol×27g/mol
5.1 g
×100%=52.9%
(2)n(Al):n(Mg)=1:1
任务二:物质的量在化学方程式计算中的应用
比例式法(混合体系)
任务三:化学计算的常用方法
【练习】把1.1 g铁、铝混合物溶于200 mL 5 mol·L-1盐酸中,反应后盐酸的浓度变为
4.6 mol·L-1 (溶液体积变化忽略不计)。求:
(1)反应中消耗HCl的物质的量。(2)该混合物中铝、铁的物质的量。
解(1)消耗HCl的物质的量:0.2 L×5 mol·L-1-0.2 L×4.6 mol·L-1=0.08 mol
(2)设Al、Fe的物质的量分别为x、y
2Al+6HCl=2AlCl3+3H2↑
Fe+2HCl=FeCl2+H2↑
x ×27 +y×56= 1.1
3x + 2 y = 0.08
解得:x=0.02 mol,y=0.01 mol
n(Al)=0.02 mol;n(Fe)=0.01 mol
任务二:物质的量在化学方程式计算中的应用
注意:
(2)两种物质的混合计算可用方程组法。
(1)书写格式规范化:在根据化学方程式计算的过程中,各物理量、物质名称、公式等尽量用符号表示,且数据的运算要公式化并带单位。
(3)在运用有关化学方程式的计算解决问题时,除了涉及有关物质的量外,还经常涉及到物质的量浓度、体积等物理量,就需要进行必要的换算,换算的核心就是物质的量。
任务二:物质的量在化学方程式计算中的应用
关系式法
【例3】把一定量的CO还原Fe2O3生成的CO2通入到澄清石灰水中,
得10 g沉淀,那么参加反应的CO的质量是多少?
3CO+Fe2O3 = 2Fe+3CO2 CO2+Ca(OH)2 = CaCO3↓+H2O
高温
3 3
1 1
则关系式为: 3CO~3CO2~3CaCO3
即 CO~CaCO3
28 100
m(CO) 10 g
m(CO)=2.8 g
28 m(CO)
100 10 g
=
【例4】铁粉可与高温水蒸气反应,若反应后得到的干燥固体的质量比反应前铁粉的质量增加了32g,则参加反应的铁粉的物质的量是多少?
3Fe+4H2O=Fe3O4+4H2
高温
3mol 64g
n(Fe) 32g
m
3mol 64g
n(Fe) 32g
=
n(Fe)=1.5 mol
任务三:化学计算的常用方法
差量法
【例5】将一定量的Cl2通入一定浓度的NaOH溶液中,两者恰好完全反应(已知反应过程放热),生成物中含有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量与反应时间的变化关系如图所示。生成物中Cl- 的物质的量为多少?原NaOH溶液中溶质的物质的量为多少?
解:由图可知,n(ClO-)=0.06mol n(ClO3-)=0.03mol
ClO- 和ClO3-均为氧化产物,转移电子总物质的量为n(ClO-)+5 n(ClO3-)=0.21mol,
Cl- 为还原产物,由电子守恒可得n(Cl-)=0.21mol 。
n(Na+)= n(NaCl)+ n(NaClO)+ n(NaClO3) = 0.3mol,
由元素守恒可得原NaOH溶液中n(NaOH) =0.3mol
任务三:化学计算的常用方法
守恒法
任务三:化学计算的常用方法
【例6】若某溶液中仅存在Ca2+、Al3+、SO42-、Cl-四种离子,已知Ca2+、Al3+、SO42-粒子数比为2:1:1,则Al3+和Cl-的个数比为多少?
解:Ca2+、Al3+、SO42-粒子数比为2:1:1,设物质的量分别为2mol、1mol、1mol
根据电荷守恒有:2n(Ca2+)+3n(Al3+)=2n(SO42-)+ n(Cl-)
即2×2mol+3×1mol=2×1mol+n(Cl-)
n(Cl-)=5mol
则Al3+和Cl-的个数比为1:5
守恒法
应用原理 (1)元素守恒:反应前后原子的种类和个数保持不变
(2)电荷守恒:电解质溶液中,阳离子所带的正电荷数等于阴离子所带的夫电荷数
(3)得失电子守恒:氧化还原反应中,氧化剂得电子数等于还原剂失电子数
守恒法的应用原理
任务三:化学计算的常用方法
任务三:化学计算的常用方法
【例7】某混合金属可能由Mg、Al、Fe、Zn中的任两种组成,取该混合金属10g与足量稀盐酸反应制得氢气1g,则该混合金属中一定含哪种金属?
极端假设法
①若10g全为Mg:
②若10g全为Al:
③若10g全为Fe:
④若10g全为Zn:
m(H2)=
10
24
×2g=
5
6
g
m(H2)=
10
18
×2g=
10
9
g
m(H2)=
10
56
×2g=
5
14
g
m(H2)=
10
65
×2g=
4
13
g
只有10g全为Al时,生成的氢气才比1 g多,其他都比1 g少,所以该混合金属中肯定有Al
小结
物质的量在化学计算中的应用
化学方程式计算的基础
化学方程式计算的基本步骤
化学计算的常用方法
比例式法
关系式法
差量法
守恒法
极值法
第三章 铁 金属材料
第二节金属材料
第2课时
—物质的量在化学方程式计算中的应用
2Na + 2H2O = 2NaOH + H2↑
化学计量数之比
扩大NA倍
物质的量之比
2mol
2mol
2mol
1mol
∶
∶
∶
结论:化学方程式中各物质的化学计量数之比等于各物质的物质的量之比
2
1
∶
∶
2
2
∶
粒子数之比
2× NA
2× NA
2× NA
1× NA
∶
∶
2
1
∶
∶
2
2
∶
∶
任务一:化学计量数与物理量的关系
【例1】250ml 2mol/L的硫酸与足量的铁屑完全反应。计算:
(1)参加反应的铁屑的物质的量;(2)生成H2的体积(标准状况)。
计算出参加反应的H2SO4的物质的量:
n(H2SO4)=c(H2SO4)×V=2mol/L×0.25L=0.5mol
反应方程式:Fe + H2SO4 = FeSO4 + H2↑
1 1
n(Fe) 0.5mol
1 n(Fe)
1 0.5mol
=
n(Fe)=0.5 mol
任务二:物质的量在化学方程式计算中的应用
比例式法(单一体系)
【例1】250ml 2mol/L的硫酸与足量的铁屑完全反应。计算:
(1)参加反应的铁屑的物质的量;(2)生成H2的体积(标准状况)。
Fe + H2SO4 = FeSO4 + H2↑
1mol 22.4L
0.5mol V(H2)
1mol 22.4L
0.5mol V(H2)
=
V(H2)=11.2 L
上下一致,左右相当
比例式法(单一体系)
任务二:物质的量在化学方程式计算中的应用
任务二:物质的量在化学方程式计算中的应用
应用比例式法计算的基本步骤
(1)写出有关的化学方程式
(2)找到已知量与未知量
(3)列出比例式
(4)求解
【练习】把5.4 g Al 放入足量氢氧化钠溶液中完全反应,计算生成
氢气的体积(标准状况)?
n=
m
M
=
5.4 g
27 g/mol
=0.2mol
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2 3
0.2mol n(H2)
n(H2)= 0.3 mol
V(H2)= n(H2) × Vm
=6.72 L
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2 mol 67.2L
0.2mol V(H2)
V(H2)= 6.72L
法二:
法一:
任务二:物质的量在化学方程式计算中的应用
2 0.2mol
3 n(H2)
=
2mol 67.2L
0.2mol V(H2)
=
【例2】把5.1g镁铝合金的粉末放入过量的盐酸中,得到5.6LH2(标准状况)
试计算:(1)该合金中铝的质量分数;(2)该合金中铝和镁的物质的量之比。
n(H2)=5.6L÷22.4L/mol=0.25mol
解:设合金中镁的物质的量为x,铝的物质的量为y。
Mg +2HCl=MgCl 2 + H2↑
2Al +6HCl=2AlCl 3 +3H2↑
x ×24 +y×27= 5.1
x + y = 0.25
3
2
解得: x =y=0.1mol
(1)铝的质量分数为:
0.1 mol×27g/mol
5.1 g
×100%=52.9%
(2)n(Al):n(Mg)=1:1
任务二:物质的量在化学方程式计算中的应用
比例式法(混合体系)
任务三:化学计算的常用方法
【练习】把1.1 g铁、铝混合物溶于200 mL 5 mol·L-1盐酸中,反应后盐酸的浓度变为
4.6 mol·L-1 (溶液体积变化忽略不计)。求:
(1)反应中消耗HCl的物质的量。(2)该混合物中铝、铁的物质的量。
解(1)消耗HCl的物质的量:0.2 L×5 mol·L-1-0.2 L×4.6 mol·L-1=0.08 mol
(2)设Al、Fe的物质的量分别为x、y
2Al+6HCl=2AlCl3+3H2↑
Fe+2HCl=FeCl2+H2↑
x ×27 +y×56= 1.1
3x + 2 y = 0.08
解得:x=0.02 mol,y=0.01 mol
n(Al)=0.02 mol;n(Fe)=0.01 mol
任务二:物质的量在化学方程式计算中的应用
注意:
(2)两种物质的混合计算可用方程组法。
(1)书写格式规范化:在根据化学方程式计算的过程中,各物理量、物质名称、公式等尽量用符号表示,且数据的运算要公式化并带单位。
(3)在运用有关化学方程式的计算解决问题时,除了涉及有关物质的量外,还经常涉及到物质的量浓度、体积等物理量,就需要进行必要的换算,换算的核心就是物质的量。
任务二:物质的量在化学方程式计算中的应用
关系式法
【例3】把一定量的CO还原Fe2O3生成的CO2通入到澄清石灰水中,
得10 g沉淀,那么参加反应的CO的质量是多少?
3CO+Fe2O3 = 2Fe+3CO2 CO2+Ca(OH)2 = CaCO3↓+H2O
高温
3 3
1 1
则关系式为: 3CO~3CO2~3CaCO3
即 CO~CaCO3
28 100
m(CO) 10 g
m(CO)=2.8 g
28 m(CO)
100 10 g
=
【例4】铁粉可与高温水蒸气反应,若反应后得到的干燥固体的质量比反应前铁粉的质量增加了32g,则参加反应的铁粉的物质的量是多少?
3Fe+4H2O=Fe3O4+4H2
高温
3mol 64g
n(Fe) 32g
m
3mol 64g
n(Fe) 32g
=
n(Fe)=1.5 mol
任务三:化学计算的常用方法
差量法
【例5】将一定量的Cl2通入一定浓度的NaOH溶液中,两者恰好完全反应(已知反应过程放热),生成物中含有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量与反应时间的变化关系如图所示。生成物中Cl- 的物质的量为多少?原NaOH溶液中溶质的物质的量为多少?
解:由图可知,n(ClO-)=0.06mol n(ClO3-)=0.03mol
ClO- 和ClO3-均为氧化产物,转移电子总物质的量为n(ClO-)+5 n(ClO3-)=0.21mol,
Cl- 为还原产物,由电子守恒可得n(Cl-)=0.21mol 。
n(Na+)= n(NaCl)+ n(NaClO)+ n(NaClO3) = 0.3mol,
由元素守恒可得原NaOH溶液中n(NaOH) =0.3mol
任务三:化学计算的常用方法
守恒法
任务三:化学计算的常用方法
【例6】若某溶液中仅存在Ca2+、Al3+、SO42-、Cl-四种离子,已知Ca2+、Al3+、SO42-粒子数比为2:1:1,则Al3+和Cl-的个数比为多少?
解:Ca2+、Al3+、SO42-粒子数比为2:1:1,设物质的量分别为2mol、1mol、1mol
根据电荷守恒有:2n(Ca2+)+3n(Al3+)=2n(SO42-)+ n(Cl-)
即2×2mol+3×1mol=2×1mol+n(Cl-)
n(Cl-)=5mol
则Al3+和Cl-的个数比为1:5
守恒法
应用原理 (1)元素守恒:反应前后原子的种类和个数保持不变
(2)电荷守恒:电解质溶液中,阳离子所带的正电荷数等于阴离子所带的夫电荷数
(3)得失电子守恒:氧化还原反应中,氧化剂得电子数等于还原剂失电子数
守恒法的应用原理
任务三:化学计算的常用方法
任务三:化学计算的常用方法
【例7】某混合金属可能由Mg、Al、Fe、Zn中的任两种组成,取该混合金属10g与足量稀盐酸反应制得氢气1g,则该混合金属中一定含哪种金属?
极端假设法
①若10g全为Mg:
②若10g全为Al:
③若10g全为Fe:
④若10g全为Zn:
m(H2)=
10
24
×2g=
5
6
g
m(H2)=
10
18
×2g=
10
9
g
m(H2)=
10
56
×2g=
5
14
g
m(H2)=
10
65
×2g=
4
13
g
只有10g全为Al时,生成的氢气才比1 g多,其他都比1 g少,所以该混合金属中肯定有Al
小结
物质的量在化学计算中的应用
化学方程式计算的基础
化学方程式计算的基本步骤
化学计算的常用方法
比例式法
关系式法
差量法
守恒法
极值法
