人教版高中化学必修第一册第三章铁金属材料3.3整理与提升教学课件
文档属性
| 名称 | 人教版高中化学必修第一册第三章铁金属材料3.3整理与提升教学课件 |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-11 19:45:03 | ||
图片预览






文档简介
(共27张PPT)
第三章 铁 金属材料
3.3 整理与提升
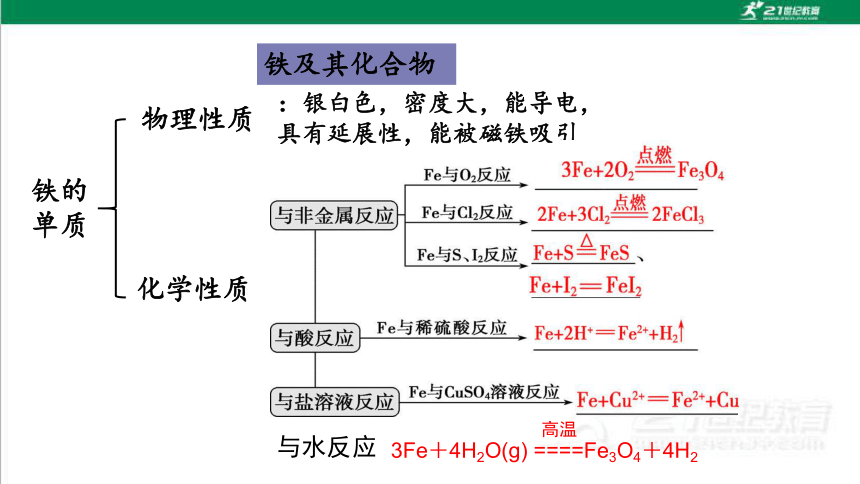
铁的
单质
物理性质
化学性质
铁及其化合物
:银白色,密度大,能导电,
具有延展性,能被磁铁吸引
与水反应
3Fe+4H2O(g) ====Fe3O4+4H2
高温
【总结】
在一定条件下,铁作为还原剂能与某些非金属单质、酸和盐溶液反应。
(1)铁与氧化性较弱的氧化剂(如盐酸、硫酸铜等)反应,铁原子失去2个电子生成+2价铁的化合物。
(2)铁与氧化性较强的氧化剂(如氯气等)反应,铁原子则失去3个电子生成+3价铁的化合物。
(3)红热的铁能与水蒸气发生反应,生成四氧化三铁和氢气。
1.下列关于铁的叙述,错误的是( )
A.纯净的铁是光亮的银白色金属
B.铁能被磁铁吸引,在磁场作用下,铁自身能产生磁场
C.铁是地壳中含量最多的金属元素,所以分布在地壳中的铁有游离态
也有化合态
D.纯铁的抗腐蚀能力强,在干燥空气中不易被氧化
C
2.某学习小组进行了下图所示的实验,实验后组员之间的交流不合理的
是( )
A.甲同学认为试管b中收集到的气体可点燃,且产生淡蓝色火焰
B.丙同学认为将少量还原性铁粉放入试管中,加适量的水,
加热也可实现该反应
C.乙同学认为试管a中生成黑色固体可能为
四氧化三铁
D.丁同学认为用盐酸溶解固体生成所得溶液有颜色
B
3.把一定量的铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+的浓度恰好相等。则已反应的Fe3+和未反应的Fe3+的物质的量之比为( )
A.1∶1 B.2∶1 C.2∶3 D.3∶2
【答案】C
4.下列物质反应后一定有+3价铁生成的是( )
①过量的Fe与Cl2反应 ②Fe与过量稀硫酸反应
③FeCl2溶液中通入少量Cl2 ④Fe和Fe2O3的混合物溶于盐酸中
A.只有① B.只有①③
C.只有①②③ D.全部
【答案】B
氧化物
氢氧
化物
两类
铁盐
氢氧化铁
氧化亚铁
四氧化三铁
氧化铁
氢氧化亚铁
亚铁盐
铁盐
铁的化合物
化学式 FeO Fe2O3 Fe3O4
俗名 - 铁红 磁性氧化铁
颜色状态 黑色粉末 红棕色粉末 黑色晶体
(有磁性)
溶解性 难溶于水 难溶于水 难溶于水
铁元素的化合价 +2 +3 +2,+3
稳定性 不稳定 稳定 稳定
类别 碱性氧化物 碱性氧化物 特殊氧化物
Fe(OH)2 Fe(OH)3
色态
水溶性
制法
稳定性
与盐酸反应
转化
白色固体
红褐色固体
不溶
不溶
Fe2++2OH-=Fe(OH)2↓
Fe(OH)2+2H+=Fe2++2H2O
Fe(OH)3+3H+=Fe3+3H2O
Fe3++3OH-=Fe(OH)3↓
2Fe(OH)3==Fe2O3+3H2O
△
Fe(OH)2、 Fe(OH)3
Fe(OH)2==FeO+H2O
△
Fe3+ 盐:黄色,可以被还原为Fe2+
Fe + 2Fe3+ = 3Fe2+
检验:滴加KSCN溶液,显红色
Fe3+ + 3SCN- = Fe(SCN)3
Fe2+盐:浅绿色,可以被氧化为Fe3+
Cl2 + 2Fe2+ = 2Fe3+ + 2Cl-
Fe2+
Fe3+
Fe、Cu、*I-、 *S2-
浅绿色
棕黄色
Cl2 、 O2 、 HNO3、 *KMnO4
两类
铁盐
铁及其化合物
1.Fe3+的氧化性
含有Fe3+的溶液呈黄色,Fe3+处于铁的高价态,
遇Fe、Cu、HI、H2S等均表现氧化性。
(1)Fe3+与S2-、I-、HS-、SO32-等具有较强还原性的离子不能大量共存。
(2)Fe3+可腐蚀印刷电路板上的铜箔,反应的离子方程式
Cu+2Fe3+===Cu2++2Fe2+
2.Fe2+的氧化性和还原性
含有Fe2+的溶液呈浅绿色,Fe2+处于铁的中间价态,既有氧化性,又有还原性,以还原性为主,如遇Br2、Cl2、H2O2、NO3-(H+)等均表现还原性。
Fe2+的酸性溶液与H2O2反应的离子方程式:
2Fe2++H2O2+2H+===2Fe3++2H2O
3.应用
(1)判断离子共存
Fe2+与氧化性离子NO3-(H+)、ClO-、MnO4-;
Fe3+与还原性离子S2-、I-、SO32-;
因发生氧化还原反应不能大量共存。
(2)除杂
溶液 杂质 除杂方法
FeCl2 FeCl3 加过量铁粉后过滤
FeCl3 FeCl2 加足量氯水或H2O2溶液
FeCl2 CuCl2 加过量铁粉后过滤
【思考】
为什么实验室配制FeSO4溶液常加入少量铁粉?
防止亚铁离子被氧化,2Fe3++Fe=3Fe2+
【小结】Fe3+、Fe2+的检验方法:
1.用KSCN溶液和氯水
2.用NaOH溶液
3.含Fe2+、Fe3+的混合溶液中Fe2+、Fe3+的检验
混合溶液滴加KSCN溶液变红色,说明含有Fe3+
混合溶液滴加酸性KMnO4溶液紫红色褪去,说明含有Fe2+
1.关于氧化铁、氧化亚铁、四氧化三铁三种氧化物的下列说法中不正确的是( )
A.铁元素化合价不完全相同
B.氧元素的化合价完全相同
C.氧化亚铁俗称铁红,为红棕色固体
D.铁在氧气中燃烧的产物为黑色固体
【答案】C
2.铁是生活中应用最广泛的金属,下列有关铁元素的说法正确的是( )
A.Fe3+水溶液呈红褐色,Fe2+水溶液呈浅绿色
B.Fe3+的溶液中滴入含KSCN的溶液,立即出现红色沉淀
C.Fe3+具有氧化性,Fe2+具有还原性
D.铁粉可以和水蒸气在高温下反应生成Fe2O3
【答案】C
3.要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时最佳顺序为( )
①加入适量氯水 ②加入足量的KMnO4溶液 ③加入少量KSCN溶液
A.①③ B.③② C.③① D.①②③
【答案】C
4.向盛有氯化铁溶液的烧杯中加入过量的铜粉,反应结束后,溶液中大量存在的金属离子是( )
A.Fe2+、Fe3+ B.Fe2+、Cu2+
C.Fe3+、Cu2+ D.Cu+、Cu2+
【答案】B
金属材料包括纯金属和它们的合金,日常使用的金属材料,大多数属于合金。
1.合金的概念
由纯金属(或金属与非金属)制得的金属材料。
2.合金的一般性质
(1)硬度:合金的硬度及机械加工性能一般高于各成分金属。
(2)熔点:合金的熔点一般低于各成分金属。
金属材料
3.铁合金
3.铝和铝合金
铝是两性金属
氧化铝是两性
氧化物。
2Al+2NaOH+2H2O ==2NaAlO2+3H2 ↑
2Al + 6HCl == 2AlCl3 + 3H2 ↑
Al2O3+2NaOH=2NaAlO2+H2O
Al2O3+6HCl=2AlCl3+3H2O
铝合金——目前用途广泛的合金之一
(1)成分元素:除铝外,主要合金元素有铜、硅、镁、锌、锰,次要合金元素有镍、铁、钛、铬、锂等。
(2)主要特性:铝合金密度低,但强度比较高,接近或超过优质钢,塑性好,可加工成各种型材,具有优良的导电性、导热性和抗蚀性
(3)主要用途:用于汽车、飞机、火箭、船舶制造及建筑用门窗,工业上广泛使用,使用量仅次于钢。
【思考】铝制餐具不宜长期存放酸、碱性食物原因是什么?
Al和Al2O3均易与酸、碱反应。
4.新型合金
新型储氢合金材料的研究和开发将为氢气作为能源的实际应用起到重要的推动作用。此外,钛合金、耐热合金和形状记忆合金等新型合金广泛应用于航空航天、生物工程和电子工业等领域。
1.关于合金性质的说法中,错误的是 ( )
A.多数合金的硬度一般比其各成分金属的硬度高
B.多数合金的熔点一般比其各成分金属的熔点低
C.合金的物理性质一般与其各成分金属的的物理性质不同
D.合金的化学性质一般与其各成分金属的的化学性质不同
【答案】D
2、下列各种物质既能与强酸反应,又能与强碱反应的是 ( )。
①Al ②AlCl3 ③Na2CO3 ④Al2O3 ⑤NaHCO3
A.①③⑤ B.②③④
C.①③④ D.①④⑤
D
3.工业生产中常将两种金属在同一容器中加热使其熔化,冷却后得到具有金属特性的熔合物——合金。试根据下表所列金属的熔点和沸点的数据(其它条件均已满足),判断哪种金属不易跟其它金属制得合金___________(填代号,双选)。
A.Zn B.Fe C.W D.Ag
【答案】AC
金属 Fe Cu Zn Ag Au W
熔点(℃) 1535 1083 419.5 960.8 1063 3380
沸点(℃) 3000 2595 907 2212 2707 5637
物质是由原子、分子、离子等粒子构成的,
物质之间的化学反应也是粒子按照一定的数目关系进行的。
化学方程式中的化学计量系数可以明确表示出化学反应中粒子之间数目关系。
2Na + 2H2O === 2NaOH + H2↑
化学计量系数 2 ∶ 2 ∶ 2 ∶ 1
扩大倍2NA倍 2NA∶ 2NA ∶ 2NA ∶1NA
物质的量 2 mol 2 mol ∶ 2 mol ∶1 mol
结论:
化学方程式中各物质的化学计量数之比等于粒子个数之比,也等于各物质的物质的量之比,对于有气体参与的反应还等于体积之比。
进行物质的量应用于化学方程式的计算时,须按以下步骤进行:
①写出有关反应方程式
②找出相关物质的化学计量数之比
③对应化学计量数,找出相关物质的物质的量的关系
④根据物质的量的关系,按照比例相等的模式进行计算
上下单位一致,左右关系对应
计算方法:
①关系法
②守恒法
③差量法
以物质的量为中心的相关计算
1.两份铝屑,第一份与足量盐酸反应,第二份与足量氢氧化钠溶液反应,产生的氢气的体积比为1∶2(同温同压下),则第一份与第二份铝屑的质量比为( )
A.1∶3 B.1∶2 C.1∶1 D.2∶1
【答案】B
2.m g某二价金属M溶于足量盐酸中,标况下放出氢气n L,则金属M的相对原子质量为 ( )
A.n/m B.2m/n
C.n /(22.4 m) D.22.4m/n
【答案】D
3.向500 mL NaOH溶液中投入10.8 g Al,二者恰好完全反应后,
2Al+2NaOH+2H2O===2NaAlO2+3H2↑。则:
(1)Al的物质的量为________。
(2)参加反应的NaOH的物质的量为________,
NaOH溶液的物质的量浓度为________。
(3)生成标准状况下H2的体积为________。
【答案】(1)0.4 mol (2)0.4 mol 0.8 mol/L
(3)13.44 L
第三章 铁 金属材料
3.3 整理与提升
铁的
单质
物理性质
化学性质
铁及其化合物
:银白色,密度大,能导电,
具有延展性,能被磁铁吸引
与水反应
3Fe+4H2O(g) ====Fe3O4+4H2
高温
【总结】
在一定条件下,铁作为还原剂能与某些非金属单质、酸和盐溶液反应。
(1)铁与氧化性较弱的氧化剂(如盐酸、硫酸铜等)反应,铁原子失去2个电子生成+2价铁的化合物。
(2)铁与氧化性较强的氧化剂(如氯气等)反应,铁原子则失去3个电子生成+3价铁的化合物。
(3)红热的铁能与水蒸气发生反应,生成四氧化三铁和氢气。
1.下列关于铁的叙述,错误的是( )
A.纯净的铁是光亮的银白色金属
B.铁能被磁铁吸引,在磁场作用下,铁自身能产生磁场
C.铁是地壳中含量最多的金属元素,所以分布在地壳中的铁有游离态
也有化合态
D.纯铁的抗腐蚀能力强,在干燥空气中不易被氧化
C
2.某学习小组进行了下图所示的实验,实验后组员之间的交流不合理的
是( )
A.甲同学认为试管b中收集到的气体可点燃,且产生淡蓝色火焰
B.丙同学认为将少量还原性铁粉放入试管中,加适量的水,
加热也可实现该反应
C.乙同学认为试管a中生成黑色固体可能为
四氧化三铁
D.丁同学认为用盐酸溶解固体生成所得溶液有颜色
B
3.把一定量的铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+的浓度恰好相等。则已反应的Fe3+和未反应的Fe3+的物质的量之比为( )
A.1∶1 B.2∶1 C.2∶3 D.3∶2
【答案】C
4.下列物质反应后一定有+3价铁生成的是( )
①过量的Fe与Cl2反应 ②Fe与过量稀硫酸反应
③FeCl2溶液中通入少量Cl2 ④Fe和Fe2O3的混合物溶于盐酸中
A.只有① B.只有①③
C.只有①②③ D.全部
【答案】B
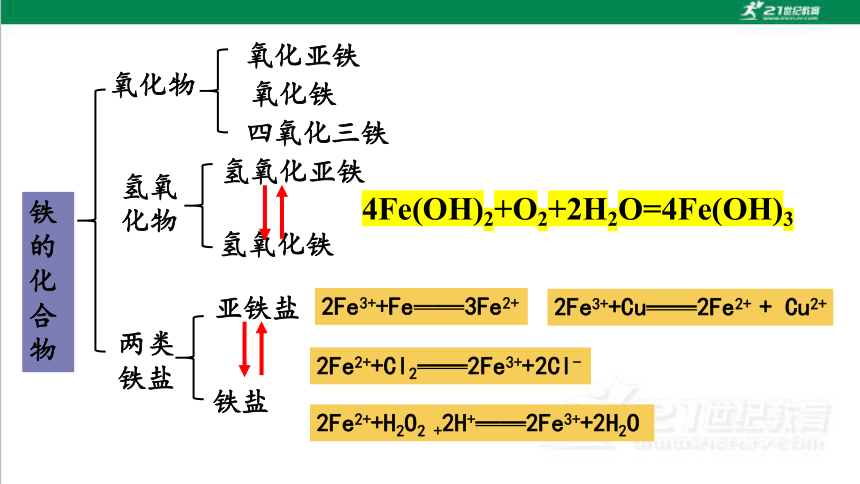
氧化物
氢氧
化物
两类
铁盐
氢氧化铁
氧化亚铁
四氧化三铁
氧化铁
氢氧化亚铁
亚铁盐
铁盐
铁的化合物
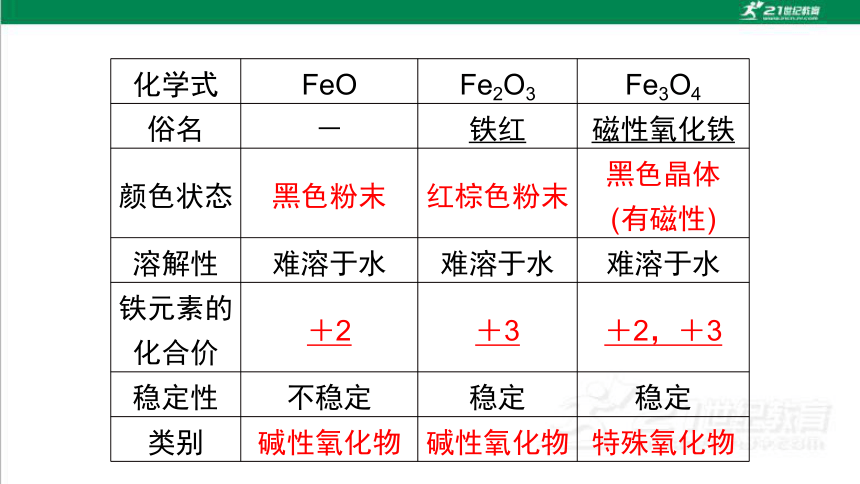
化学式 FeO Fe2O3 Fe3O4
俗名 - 铁红 磁性氧化铁
颜色状态 黑色粉末 红棕色粉末 黑色晶体
(有磁性)
溶解性 难溶于水 难溶于水 难溶于水
铁元素的化合价 +2 +3 +2,+3
稳定性 不稳定 稳定 稳定
类别 碱性氧化物 碱性氧化物 特殊氧化物
Fe(OH)2 Fe(OH)3
色态
水溶性
制法
稳定性
与盐酸反应
转化
白色固体
红褐色固体
不溶
不溶
Fe2++2OH-=Fe(OH)2↓
Fe(OH)2+2H+=Fe2++2H2O
Fe(OH)3+3H+=Fe3+3H2O
Fe3++3OH-=Fe(OH)3↓
2Fe(OH)3==Fe2O3+3H2O
△
Fe(OH)2、 Fe(OH)3
Fe(OH)2==FeO+H2O
△
Fe3+ 盐:黄色,可以被还原为Fe2+
Fe + 2Fe3+ = 3Fe2+
检验:滴加KSCN溶液,显红色
Fe3+ + 3SCN- = Fe(SCN)3
Fe2+盐:浅绿色,可以被氧化为Fe3+
Cl2 + 2Fe2+ = 2Fe3+ + 2Cl-
Fe2+
Fe3+
Fe、Cu、*I-、 *S2-
浅绿色
棕黄色
Cl2 、 O2 、 HNO3、 *KMnO4
两类
铁盐
铁及其化合物
1.Fe3+的氧化性
含有Fe3+的溶液呈黄色,Fe3+处于铁的高价态,
遇Fe、Cu、HI、H2S等均表现氧化性。
(1)Fe3+与S2-、I-、HS-、SO32-等具有较强还原性的离子不能大量共存。
(2)Fe3+可腐蚀印刷电路板上的铜箔,反应的离子方程式
Cu+2Fe3+===Cu2++2Fe2+
2.Fe2+的氧化性和还原性
含有Fe2+的溶液呈浅绿色,Fe2+处于铁的中间价态,既有氧化性,又有还原性,以还原性为主,如遇Br2、Cl2、H2O2、NO3-(H+)等均表现还原性。
Fe2+的酸性溶液与H2O2反应的离子方程式:
2Fe2++H2O2+2H+===2Fe3++2H2O
3.应用
(1)判断离子共存
Fe2+与氧化性离子NO3-(H+)、ClO-、MnO4-;
Fe3+与还原性离子S2-、I-、SO32-;
因发生氧化还原反应不能大量共存。
(2)除杂
溶液 杂质 除杂方法
FeCl2 FeCl3 加过量铁粉后过滤
FeCl3 FeCl2 加足量氯水或H2O2溶液
FeCl2 CuCl2 加过量铁粉后过滤
【思考】
为什么实验室配制FeSO4溶液常加入少量铁粉?
防止亚铁离子被氧化,2Fe3++Fe=3Fe2+
【小结】Fe3+、Fe2+的检验方法:
1.用KSCN溶液和氯水
2.用NaOH溶液
3.含Fe2+、Fe3+的混合溶液中Fe2+、Fe3+的检验
混合溶液滴加KSCN溶液变红色,说明含有Fe3+
混合溶液滴加酸性KMnO4溶液紫红色褪去,说明含有Fe2+
1.关于氧化铁、氧化亚铁、四氧化三铁三种氧化物的下列说法中不正确的是( )
A.铁元素化合价不完全相同
B.氧元素的化合价完全相同
C.氧化亚铁俗称铁红,为红棕色固体
D.铁在氧气中燃烧的产物为黑色固体
【答案】C
2.铁是生活中应用最广泛的金属,下列有关铁元素的说法正确的是( )
A.Fe3+水溶液呈红褐色,Fe2+水溶液呈浅绿色
B.Fe3+的溶液中滴入含KSCN的溶液,立即出现红色沉淀
C.Fe3+具有氧化性,Fe2+具有还原性
D.铁粉可以和水蒸气在高温下反应生成Fe2O3
【答案】C
3.要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时最佳顺序为( )
①加入适量氯水 ②加入足量的KMnO4溶液 ③加入少量KSCN溶液
A.①③ B.③② C.③① D.①②③
【答案】C
4.向盛有氯化铁溶液的烧杯中加入过量的铜粉,反应结束后,溶液中大量存在的金属离子是( )
A.Fe2+、Fe3+ B.Fe2+、Cu2+
C.Fe3+、Cu2+ D.Cu+、Cu2+
【答案】B
金属材料包括纯金属和它们的合金,日常使用的金属材料,大多数属于合金。
1.合金的概念
由纯金属(或金属与非金属)制得的金属材料。
2.合金的一般性质
(1)硬度:合金的硬度及机械加工性能一般高于各成分金属。
(2)熔点:合金的熔点一般低于各成分金属。
金属材料
3.铁合金
3.铝和铝合金
铝是两性金属
氧化铝是两性
氧化物。
2Al+2NaOH+2H2O ==2NaAlO2+3H2 ↑
2Al + 6HCl == 2AlCl3 + 3H2 ↑
Al2O3+2NaOH=2NaAlO2+H2O
Al2O3+6HCl=2AlCl3+3H2O
铝合金——目前用途广泛的合金之一
(1)成分元素:除铝外,主要合金元素有铜、硅、镁、锌、锰,次要合金元素有镍、铁、钛、铬、锂等。
(2)主要特性:铝合金密度低,但强度比较高,接近或超过优质钢,塑性好,可加工成各种型材,具有优良的导电性、导热性和抗蚀性
(3)主要用途:用于汽车、飞机、火箭、船舶制造及建筑用门窗,工业上广泛使用,使用量仅次于钢。
【思考】铝制餐具不宜长期存放酸、碱性食物原因是什么?
Al和Al2O3均易与酸、碱反应。
4.新型合金
新型储氢合金材料的研究和开发将为氢气作为能源的实际应用起到重要的推动作用。此外,钛合金、耐热合金和形状记忆合金等新型合金广泛应用于航空航天、生物工程和电子工业等领域。
1.关于合金性质的说法中,错误的是 ( )
A.多数合金的硬度一般比其各成分金属的硬度高
B.多数合金的熔点一般比其各成分金属的熔点低
C.合金的物理性质一般与其各成分金属的的物理性质不同
D.合金的化学性质一般与其各成分金属的的化学性质不同
【答案】D
2、下列各种物质既能与强酸反应,又能与强碱反应的是 ( )。
①Al ②AlCl3 ③Na2CO3 ④Al2O3 ⑤NaHCO3
A.①③⑤ B.②③④
C.①③④ D.①④⑤
D
3.工业生产中常将两种金属在同一容器中加热使其熔化,冷却后得到具有金属特性的熔合物——合金。试根据下表所列金属的熔点和沸点的数据(其它条件均已满足),判断哪种金属不易跟其它金属制得合金___________(填代号,双选)。
A.Zn B.Fe C.W D.Ag
【答案】AC
金属 Fe Cu Zn Ag Au W
熔点(℃) 1535 1083 419.5 960.8 1063 3380
沸点(℃) 3000 2595 907 2212 2707 5637
物质是由原子、分子、离子等粒子构成的,
物质之间的化学反应也是粒子按照一定的数目关系进行的。
化学方程式中的化学计量系数可以明确表示出化学反应中粒子之间数目关系。
2Na + 2H2O === 2NaOH + H2↑
化学计量系数 2 ∶ 2 ∶ 2 ∶ 1
扩大倍2NA倍 2NA∶ 2NA ∶ 2NA ∶1NA
物质的量 2 mol 2 mol ∶ 2 mol ∶1 mol
结论:
化学方程式中各物质的化学计量数之比等于粒子个数之比,也等于各物质的物质的量之比,对于有气体参与的反应还等于体积之比。
进行物质的量应用于化学方程式的计算时,须按以下步骤进行:
①写出有关反应方程式
②找出相关物质的化学计量数之比
③对应化学计量数,找出相关物质的物质的量的关系
④根据物质的量的关系,按照比例相等的模式进行计算
上下单位一致,左右关系对应
计算方法:
①关系法
②守恒法
③差量法
以物质的量为中心的相关计算
1.两份铝屑,第一份与足量盐酸反应,第二份与足量氢氧化钠溶液反应,产生的氢气的体积比为1∶2(同温同压下),则第一份与第二份铝屑的质量比为( )
A.1∶3 B.1∶2 C.1∶1 D.2∶1
【答案】B
2.m g某二价金属M溶于足量盐酸中,标况下放出氢气n L,则金属M的相对原子质量为 ( )
A.n/m B.2m/n
C.n /(22.4 m) D.22.4m/n
【答案】D
3.向500 mL NaOH溶液中投入10.8 g Al,二者恰好完全反应后,
2Al+2NaOH+2H2O===2NaAlO2+3H2↑。则:
(1)Al的物质的量为________。
(2)参加反应的NaOH的物质的量为________,
NaOH溶液的物质的量浓度为________。
(3)生成标准状况下H2的体积为________。
【答案】(1)0.4 mol (2)0.4 mol 0.8 mol/L
(3)13.44 L
