人教版高中化学必修第一册第四章物质结构元素周期律4.2.1元素性质的周期性变化规律教学课件
文档属性
| 名称 | 人教版高中化学必修第一册第四章物质结构元素周期律4.2.1元素性质的周期性变化规律教学课件 |

|
|
| 格式 | ppt | ||
| 文件大小 | 3.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-11 00:00:00 | ||
图片预览







文档简介
(共30张PPT)
第四章
物质结构 元素周期律
第二节
元素周期律
镓的故事
布瓦博德朗
门捷列夫
1875年发现一种新元素,将其命名为镓(纪念法国)
并公布了所测镓的主要性质
比重为4.70
您所说的镓就是我四年前所预言的“类铝”
它的比重应该为5.9左右
请您再测一下吧
镓的比重是 5.94
思考:门捷列夫是依靠什么规律神奇的预言镓的性质吗?
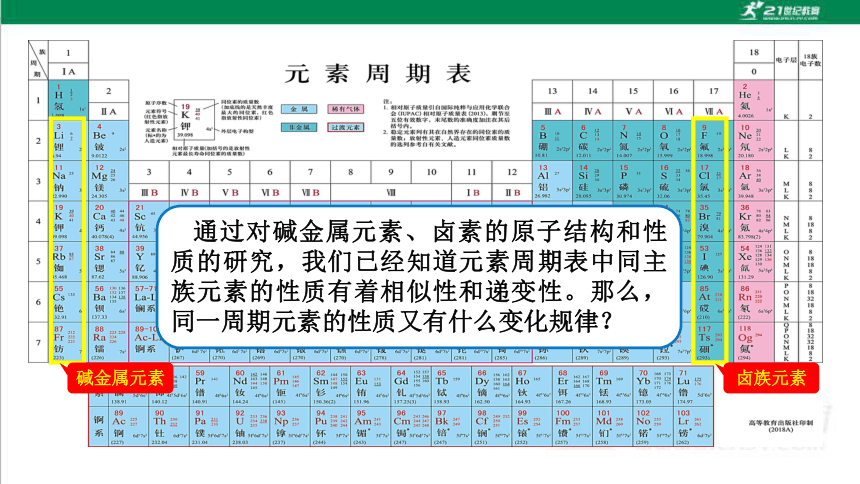
碱金属元素
卤族元素
通过对碱金属元素、卤素的原子结构和性质的研究,我们已经知道元素周期表中同主族元素的性质有着相似性和递变性。那么,同一周期元素的性质又有什么变化规律?
PART
01
PART
02
第1课时
元素性质的周期性变化规律
结合有关数据和实验事实,认识原子核外电子排布、原子半径、主要化合价等随元素原子序数递增而呈现周期性变化的规律。
以第三周期元素为例,认识同周期元素的金属性、非金属性随元素原子序数递增而呈现周期性变化的规律,构建元素周期律。
最外层电子数1→2
最外层电子数1→8
最外层电子数1→8
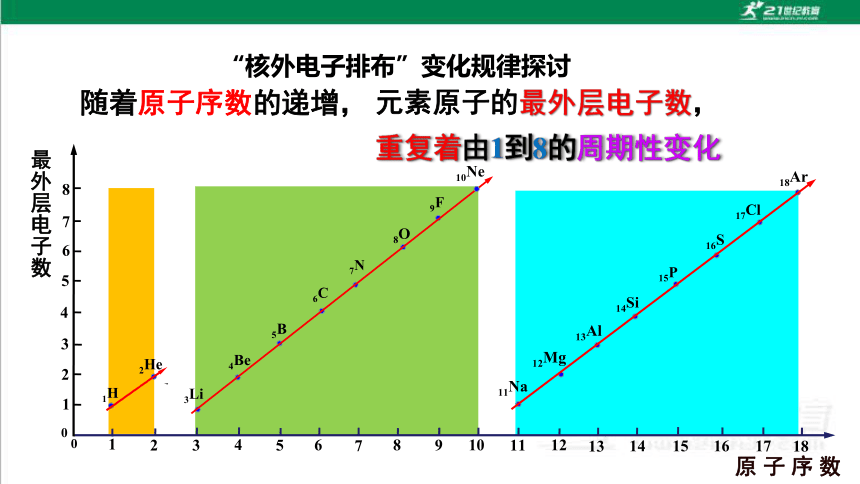
同周期由左向右元素的原子最外层电子数逐渐增加(1→8)
“核外电子排布”变化规律探讨
最外层电子数
随着原子序数的递增,
元素原子的最外层电子数,
重复着由1到8的周期性变化
【分析引入】
结构
性质
决定
反应
最外层电子数
呈现周期性变化
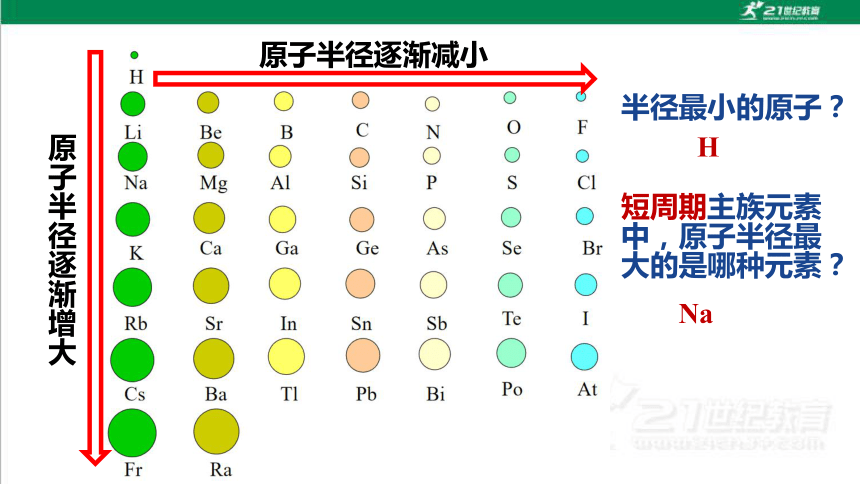
原子半径逐渐减小
原子半径逐渐减小
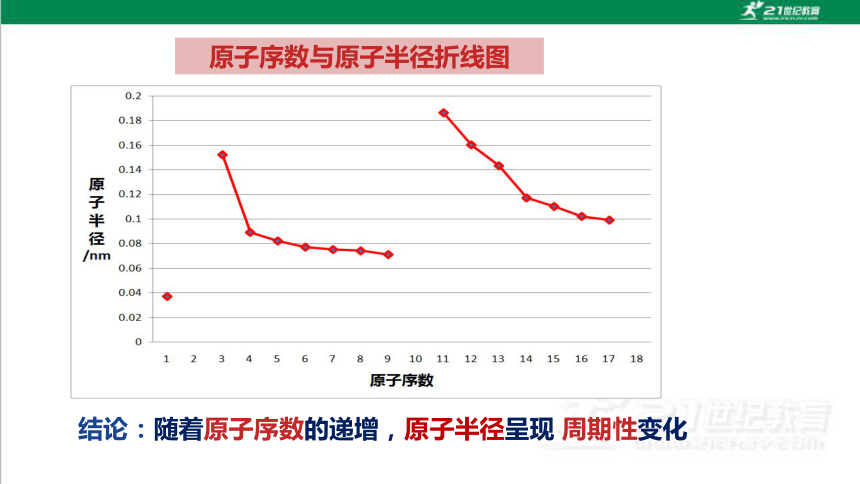
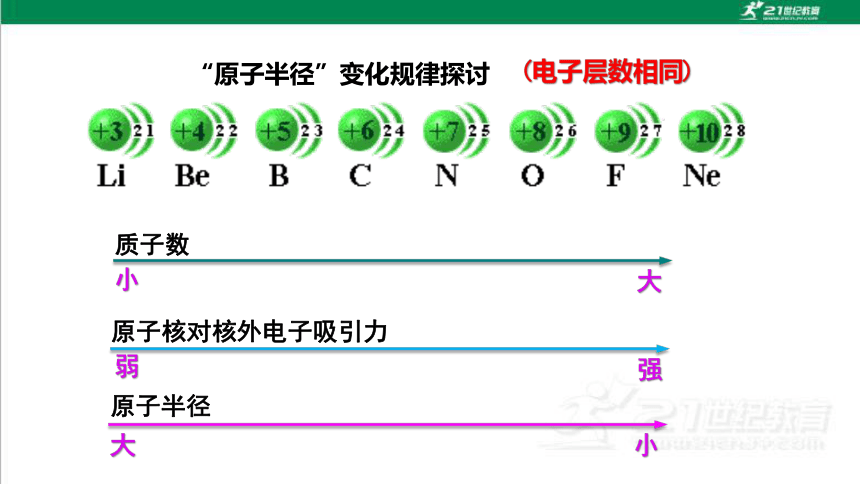
同周期由左向右元素的原子半径逐渐减小(不包括稀有气体)
原子序数与原子半径折线图
结论:随着原子序数的递增,原子半径呈现 周期性变化
原子半径逐渐增大
原子半径逐渐减小
半径最小的原子?
短周期主族元素中,原子半径最大的是哪种元素?
Na
H
“原子半径”变化规律探讨
原子核对核外电子吸引力
(电子层数相同)
质子数
原子半径
弱
强
小
大
小
大
微粒半径的比较
思考:粒子半径受哪些因素制约?
一看电子层数:
电子层数越多,原子半径越大
原子半径的变化规律
同周期: 从左→右,原子半径逐渐减小
同主族: 从上→下,原子半径逐渐增大
二看核电荷数:
核电荷数越大,半径越小
(序大径小)
三看核外电子数:
核外电子数越多,半径越大。
注意:第二周期的Li比第三周期的S、Cl等原子半径大。
小结
当堂巩固
<
<
<
>
>
>
>
>
>
>
正价:+1→+5,负价:-4 →-1
正价:+1→+7,负价:-4 →-1
同周期由左向右元素的最高正价逐渐升高(+1→+7,O和F无最高正价);
元素的最低负价逐渐升高(-4 → -1)
“元素主要化合价”变化规律
最高正价:重复着由+1到+7的周期性变化
最低负价: 重复着由-4到-1的周期性变化
O一般无正价
F无正价
随着原子序数的递增
原子的核外电子排布
原子半径
化合价
呈现周期性的变化
随着原子序数的增加,元素原子的半径、元素的主要化合价为什么呈现周期性变化?出现这种变化的根本原因是什么?
随着元素原子序数的递增,
原子核外电子排布呈周期性变化。
(实质、根本原因)
规律小结
根据第三周期元素原子核外电子排布规律,推测该周期元素金属性和非金属性具有怎样的变化规律。
Na、Mg、Al、Si、P、S、Cl
失电子能力( ),得电子能力( )
金属性( ),非金属性( )
减弱
增强
减弱
增强
如何设计实验证明三者金属性的强弱?
Na、Mg、Al、Si、P、S、Cl
比较金属单质与水(或酸)反应难易
比较最高价氧化物的水化物的碱性强弱
金属单质与水(或酸)反应的难易程度
判断元素金属性强弱:
钠、镁单质与水反应
Mg + 2H2O Mg(OH)2 + H2↑
金属性:Na > Mg
镁、铝与盐酸反应
金属性:Mg > Al
判断元素金属性强弱:
最高价氧化物对应的水化物——氢氧化物的碱性强弱。
比较Mg(OH)2和Al(OH)3的碱性强弱
【获取信息】
Al(OH)3在酸或强碱溶液中都可以溶解,表明它既能与酸反应,又能与强碱溶液反应。反应如下:
Al(OH)3 + 3H+ = Al3+ + 3H2O
Al(OH)3 + OH- = AlO2- + 2H2O
比较Mg(OH)2和Al(OH)3的碱性强弱
NaOH Mg(OH)2 Al(OH)3
强碱 中强碱 两性氢氧化物
结论:金属性Na>Mg>Al
Na Mg Al
与水反应 与冷水反应 剧烈反应 反应缓慢 ——
与热水反应 —— 反应加快 ——
与盐酸的反应 —— 剧烈反应 反应较快
最高价氧化物
对应水化物碱性 NaOH
强碱 Mg(OH)2
中强碱 Al(OH)3
两性氢氧化物
结论
金属性:Na>Mg>Al
碱性强弱:
NaOH>Mg(OH)2>Al(OH)3
小结
Na 、Mg 、 Al金属性的比较
如何设计实验证明四者非金属性的强弱?
Na、Mg、Al、Si、P、S、Cl
比较非金属单质与氢气反应的难易
比较非金属氢化物的稳定性
比较最高价氧化物的水化物的酸性强弱
“金属性与非金属性”变化规律探讨
【任务四】
资料卡片
非金属元素 Si P S Cl
最高价
含氧酸 H2SiO3
(硅酸) H3PO4
(磷酸) H2SO4
(硫酸) HClO4
(高氯酸)
酸性强弱 弱酸 中强酸 强酸 强酸
(比硫酸强)
酸性:H2SiO3 < H3PO4 < H2SO4 < HClO4
非金属性:Si<P<S<Cl
【思维拓展】写出Si、P、S、Cl四种非金属元素对应的简单氢化物的化学式,比较氢化物的稳定性强弱。
C、N、O、F
SiH4 PH3 H2S HCl
<
<
<
CH4 NH3 H2O HF
<
<
<
11~17号元素性质的变化中得出如下的结论:
Na Mg Al Si P S Cl
金属性逐渐减弱
非金属性逐渐增强
最高价氧化物对应水化物
碱性逐渐减弱
酸性逐渐增强
归纳总结
原子结构的周期性变化
元素性质的周期性变化
元素周期律
核外电子排布呈周期性变化
原子半径呈周期性变化
主要化合价呈周期性变化
元素金属性与非金属性呈周期性变化
随着原子序数的递增而呈现周期性变化
1.(双选)下列说法能证明钾元素比镁元素金属性强的是( )
A. 金属钾与冷水剧烈反应,镁与冷水几乎没有现象。
B. KOH的碱性比Mg(OH)2强
C. 金属钾与MgCl2的水溶液反应可置换出金属镁
D. 在化学反应中,钾失去1个电子,镁失去2个电子
AB
随堂检测
2.(双选)下列说法能够证明氯元素的非金属性比硫元素强的是( )
A.氯气与氢气化合的条件比硫与氢气化合的条件更容易
B. HCl的酸性比H2S强
C. HCl的稳定性比H2S强
D. HClO3的酸性比H2SO3强
AC
单质与氢气反应的难易
气态氢化物的稳定性
不是最高价氧化物的水化物的酸性比较
随堂检测
第四章
物质结构 元素周期律
第二节
元素周期律
镓的故事
布瓦博德朗
门捷列夫
1875年发现一种新元素,将其命名为镓(纪念法国)
并公布了所测镓的主要性质
比重为4.70
您所说的镓就是我四年前所预言的“类铝”
它的比重应该为5.9左右
请您再测一下吧
镓的比重是 5.94
思考:门捷列夫是依靠什么规律神奇的预言镓的性质吗?
碱金属元素
卤族元素
通过对碱金属元素、卤素的原子结构和性质的研究,我们已经知道元素周期表中同主族元素的性质有着相似性和递变性。那么,同一周期元素的性质又有什么变化规律?
PART
01
PART
02
第1课时
元素性质的周期性变化规律
结合有关数据和实验事实,认识原子核外电子排布、原子半径、主要化合价等随元素原子序数递增而呈现周期性变化的规律。
以第三周期元素为例,认识同周期元素的金属性、非金属性随元素原子序数递增而呈现周期性变化的规律,构建元素周期律。
最外层电子数1→2
最外层电子数1→8
最外层电子数1→8
同周期由左向右元素的原子最外层电子数逐渐增加(1→8)
“核外电子排布”变化规律探讨
最外层电子数
随着原子序数的递增,
元素原子的最外层电子数,
重复着由1到8的周期性变化
【分析引入】
结构
性质
决定
反应
最外层电子数
呈现周期性变化
原子半径逐渐减小
原子半径逐渐减小
同周期由左向右元素的原子半径逐渐减小(不包括稀有气体)
原子序数与原子半径折线图
结论:随着原子序数的递增,原子半径呈现 周期性变化
原子半径逐渐增大
原子半径逐渐减小
半径最小的原子?
短周期主族元素中,原子半径最大的是哪种元素?
Na
H
“原子半径”变化规律探讨
原子核对核外电子吸引力
(电子层数相同)
质子数
原子半径
弱
强
小
大
小
大
微粒半径的比较
思考:粒子半径受哪些因素制约?
一看电子层数:
电子层数越多,原子半径越大
原子半径的变化规律
同周期: 从左→右,原子半径逐渐减小
同主族: 从上→下,原子半径逐渐增大
二看核电荷数:
核电荷数越大,半径越小
(序大径小)
三看核外电子数:
核外电子数越多,半径越大。
注意:第二周期的Li比第三周期的S、Cl等原子半径大。
小结
当堂巩固
<
<
<
>
>
>
>
>
>
>
正价:+1→+5,负价:-4 →-1
正价:+1→+7,负价:-4 →-1
同周期由左向右元素的最高正价逐渐升高(+1→+7,O和F无最高正价);
元素的最低负价逐渐升高(-4 → -1)
“元素主要化合价”变化规律
最高正价:重复着由+1到+7的周期性变化
最低负价: 重复着由-4到-1的周期性变化
O一般无正价
F无正价
随着原子序数的递增
原子的核外电子排布
原子半径
化合价
呈现周期性的变化
随着原子序数的增加,元素原子的半径、元素的主要化合价为什么呈现周期性变化?出现这种变化的根本原因是什么?
随着元素原子序数的递增,
原子核外电子排布呈周期性变化。
(实质、根本原因)
规律小结
根据第三周期元素原子核外电子排布规律,推测该周期元素金属性和非金属性具有怎样的变化规律。
Na、Mg、Al、Si、P、S、Cl
失电子能力( ),得电子能力( )
金属性( ),非金属性( )
减弱
增强
减弱
增强
如何设计实验证明三者金属性的强弱?
Na、Mg、Al、Si、P、S、Cl
比较金属单质与水(或酸)反应难易
比较最高价氧化物的水化物的碱性强弱
金属单质与水(或酸)反应的难易程度
判断元素金属性强弱:
钠、镁单质与水反应
Mg + 2H2O Mg(OH)2 + H2↑
金属性:Na > Mg
镁、铝与盐酸反应
金属性:Mg > Al
判断元素金属性强弱:
最高价氧化物对应的水化物——氢氧化物的碱性强弱。
比较Mg(OH)2和Al(OH)3的碱性强弱
【获取信息】
Al(OH)3在酸或强碱溶液中都可以溶解,表明它既能与酸反应,又能与强碱溶液反应。反应如下:
Al(OH)3 + 3H+ = Al3+ + 3H2O
Al(OH)3 + OH- = AlO2- + 2H2O
比较Mg(OH)2和Al(OH)3的碱性强弱
NaOH Mg(OH)2 Al(OH)3
强碱 中强碱 两性氢氧化物
结论:金属性Na>Mg>Al
Na Mg Al
与水反应 与冷水反应 剧烈反应 反应缓慢 ——
与热水反应 —— 反应加快 ——
与盐酸的反应 —— 剧烈反应 反应较快
最高价氧化物
对应水化物碱性 NaOH
强碱 Mg(OH)2
中强碱 Al(OH)3
两性氢氧化物
结论
金属性:Na>Mg>Al
碱性强弱:
NaOH>Mg(OH)2>Al(OH)3
小结
Na 、Mg 、 Al金属性的比较
如何设计实验证明四者非金属性的强弱?
Na、Mg、Al、Si、P、S、Cl
比较非金属单质与氢气反应的难易
比较非金属氢化物的稳定性
比较最高价氧化物的水化物的酸性强弱
“金属性与非金属性”变化规律探讨
【任务四】
资料卡片
非金属元素 Si P S Cl
最高价
含氧酸 H2SiO3
(硅酸) H3PO4
(磷酸) H2SO4
(硫酸) HClO4
(高氯酸)
酸性强弱 弱酸 中强酸 强酸 强酸
(比硫酸强)
酸性:H2SiO3 < H3PO4 < H2SO4 < HClO4
非金属性:Si<P<S<Cl
【思维拓展】写出Si、P、S、Cl四种非金属元素对应的简单氢化物的化学式,比较氢化物的稳定性强弱。
C、N、O、F
SiH4 PH3 H2S HCl
<
<
<
CH4 NH3 H2O HF
<
<
<
11~17号元素性质的变化中得出如下的结论:
Na Mg Al Si P S Cl
金属性逐渐减弱
非金属性逐渐增强
最高价氧化物对应水化物
碱性逐渐减弱
酸性逐渐增强
归纳总结
原子结构的周期性变化
元素性质的周期性变化
元素周期律
核外电子排布呈周期性变化
原子半径呈周期性变化
主要化合价呈周期性变化
元素金属性与非金属性呈周期性变化
随着原子序数的递增而呈现周期性变化
1.(双选)下列说法能证明钾元素比镁元素金属性强的是( )
A. 金属钾与冷水剧烈反应,镁与冷水几乎没有现象。
B. KOH的碱性比Mg(OH)2强
C. 金属钾与MgCl2的水溶液反应可置换出金属镁
D. 在化学反应中,钾失去1个电子,镁失去2个电子
AB
随堂检测
2.(双选)下列说法能够证明氯元素的非金属性比硫元素强的是( )
A.氯气与氢气化合的条件比硫与氢气化合的条件更容易
B. HCl的酸性比H2S强
C. HCl的稳定性比H2S强
D. HClO3的酸性比H2SO3强
AC
单质与氢气反应的难易
气态氢化物的稳定性
不是最高价氧化物的水化物的酸性比较
随堂检测
