人教版高中化学必修第一册第四章物质结构元素周期律4.3.2共价键教学课件
文档属性
| 名称 | 人教版高中化学必修第一册第四章物质结构元素周期律4.3.2共价键教学课件 |  | |
| 格式 | ppt | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-11 19:47:08 | ||
图片预览






文档简介
(共28张PPT)
第三节 化学键
第四章 物质结构 元素周期律
第2课时
共价键
新课导入
1.为什么一分子HCl是由一个氢原子和一个氯原子构成?
而不是其他的个数比结合呢?
2.为什么氢气分子是H2而不是H3或者H4呢?
3.为什么氯气分子是Cl2而不是Cl3或者Cl4呢?
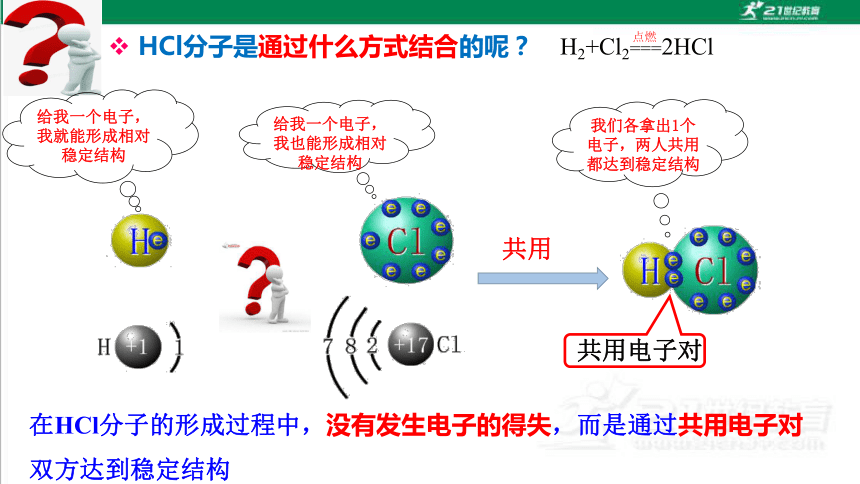
HCl分子是通过什么方式结合的呢?
共用电子对
在HCl分子的形成过程中,没有发生电子的得失,而是通过共用电子对双方达到稳定结构
给我一个电子,我就能形成相对稳定结构
给我一个电子,我也能形成相对稳定结构
共用
我们各拿出1个电子,两人共用都达到稳定结构
H2+Cl2===2HCl
点燃
原子间通过共用电子对所形成的化学键。
原子
1、概念:
2、成键粒子:
3、成键本质:
一般是非金属元素与非金属元素
4、成键元素:
原子间通过共用电子对形成的静电作用。
除NH4Cl( 铵盐)
注意:AlCl3
共价键
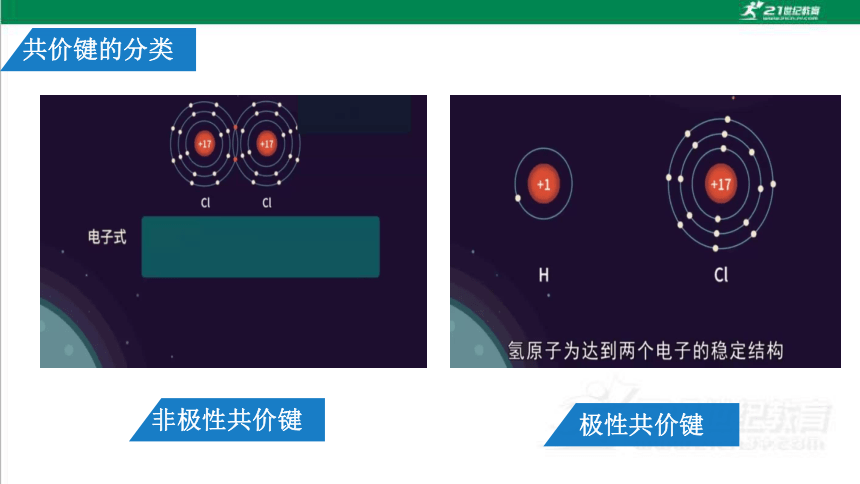
共价键的分类
·· ··
.Cl
:
H
共用电子对偏移
+1 -1
2、极性共价键
不同种原子间
思考:怎样判断共价键是非极性键还是极性键?
A-B
Cl 原子
吸引力强
H
H
.
1、非极性共价键
共用电子对不偏移
同种原子间
A-A
吸引力
大小相等
2、H2 分子中的 共用电子对 有偏向吗?
1、HCl中为什么H显+1价 ,Cl显-1价
共价键的分类
极性共价键
非极性共价键
共价化合物
只含共价键的化合物
1.共价化合物:
常
见
类
型
①非金属氧化物:
②非金属氢化物:
③酸:
如CO2、SO2、NO2等
如NH3、H2O、H2S等
如H2SO4、HClO、HNO3等
④大多数有机物
如CH4、C2H5OH、C6H12O6等
⑤少数金属氯化物
如AlCl3等
1.共价化合物只含共价键
3.只要含有离子键的化合物一定是离子化合物
2.只含共价键的物质不一定是共价化合物,也可能是单质
如O2、N2、H2、Cl2等
4.离子化合物中一定有离子键,也可能含有共价键。
5.稀有气体单质中无化学键。
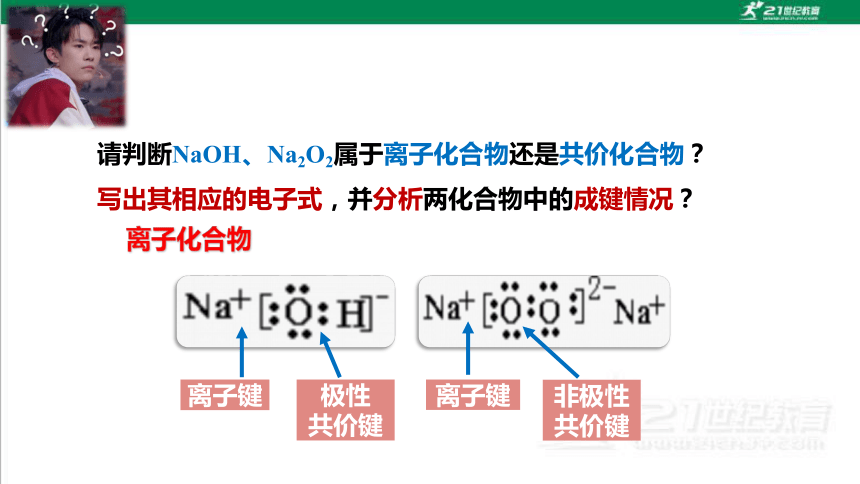
请判断NaOH、Na2O2属于离子化合物还是共价化合物?写出其相应的电子式,并分析两化合物中的成键情况?
离子键
极性
共价键
非极性共价键
离子键
离子化合物
练习
离子化合物
共价化合物
含共价键的离子化合物
NaOH
H2S
NaOH
MgCl2
KNO3
KNO3
CO2
AlCl3
NH4Cl
NH4Cl
判断下列化合物的类型
NaOH、H2S、MgCl2、H2SO4、KNO3、CO2、NH4Cl、AlCl3
H2SO4
【例题1】下列物质中存在共价键的是 ;
属于共价化合物的是 。
H2、MgO、Cl2、CO2、HF、NaOH、H2O、Na2SO4、NH4Cl
答案:(1)H2、MgO、Cl2、CO2、HF、NaOH、H2O、Na2SO4、NH4Cl
(2)CO2、HF、H2O、
例题
例题
①H2O ②CaCl2 ③MgCl2 ④H2SO4 ⑤NaOH ⑥CO2 ⑦CaO ⑧Br2 ⑨NH3 ⑩Ar
含有共价键的是___________
含有离子键的是___________
属于共价化合物的是___________
属于离子化合物的是___________
【例题2】按要求填空:
答案:(1)①④⑤⑥⑧⑨
(2)①④⑥⑨
(3)②③⑤⑦
(4)②③⑤⑦
电子式
一对共用电子对
两对共用电子对
三对共用电子对
..
:Cl
..
:
..
Cl
..
:
..
H Cl
..
..
..
H H
..
如:H2、Cl2、HCl
如:CO2
..
..
O C O
..
..
..
..
..
..
如:N2
N
N
规律:①缺少几个电子达到稳定结构,就拿出几个电子共用。
②不加中括号[ ],不标正负电荷数
共价键的形成过程表示
★ H2 的形成:
H ·
★ HCl分子的形成:
··
· Cl
··
:
· H
+
→
H ·
+
→
Cl
··
··
H
··
··
H H
··
★ 氨分子的形成:
3 H·
+
→
· N
··
·
·
﹕
H N
﹕
﹕
﹕
H
H
1.左合右不合
2.没有电子得失,即没有弧形箭头
课堂练习
H
H
H2:_______
O2:________
O
O
N2:________
Cl
Cl
Cl2:________
N
N
HCl:________
H
Cl
H2O:________
H
O
H
NH3:________
N
H
H
H
CH4:________
C
H
H
H
H
HClO:________
CO2:________
C
O
O
H
O
Cl
H2O2:________
H
O
O
H
①每个原子一般达到相对稳定结构
②不加中括号[ ],不标正负电荷数
③一般缺几个电子拿出几个共用
微点拨
结构式
结构式:在化学上,常用一根短线“—”表示一对共用电子,其余电子一律省去,这样的式子叫做结构式。
电子式
结构式
H-Cl
O=C=O
O
H H
分子式
HCl H2O CO2 N2
分别用“-、=、≡”表示一对、二对和三对共用电子对
N N
N
N
微点拨
只适用于只含共价键的物质
球棍模型
球棍模型可以形象的展示出分子的空间结构和成键情况。
优点:
分子 电子式 结构式 分子结构模型(球棍模型)
H2
O2
N2
Cl2
HCl
H:H
O
:
:
O
:
:
:
:
N
…
:
N
:
…
Cl
:
:
:
.
Cl
:
:
:
.
H-H
O=O
N≡N
Cl-Cl
直线形
直线形
直线形
直线形
H×
Cl
:
:
:
.
H-Cl
直线形
表4-6 一些以共价键形成的分子及其结构
分子 电子式 结构式 分子结构模型(球棍模型)
H2O
CO2
NH3
CH4
:
:
H
O
H
.
×
.
×
:
O
C
O
:
××
:
:
:
××
:
.
×
H
N
:
H
H
.
×
.
×
.
×
.
×
H
C
H
H
.
×
.
×
H
H-O-H
O=C=O
H-N-H
H∣
H-C-H
H
H
∣
∣
V字形
直线形
三角锥形
正四面体形
效果检测
1.判断正误(正确的打“√”,错误的打“×”。
(1)非金属元素间一定形成共价键。 ( )
(2)共价键只存在于共价化合物中。 ( )
(3)所有物质中均存在共价键。 ( )
(4)共价化合物中一定存在共价键,可能存在离了键。( )
(5)HI 是一种比 HCl 酸性强的强酸,可用电子式表示其
形成过程: 。( )
(6)非金属元素的两个原子之间一定形成共价键,但多个原子间也
可能形成离子键。 ( )
×
×
×
×
×
√
化学键
(1) 化学键
(2) 化学键的分类
离子键
共价键
非极性键
极性键
相邻原子间的强烈相互作用
稀有气体没有化学键
相同元素
不同元素
分子间作用力
分子间作用力
(1)存在:分子之间
分子间存在的将分子聚集在一起的作用力。
(2)强弱:比化学键弱
化学键(强烈)
1、范德华力:
(3)主要影响:
物质的熔沸点和溶解度
组成和结构相似的物质,相对分子质量越大,分子间作用力越大、熔沸点越高。
分子间作用力
卤素单质的熔、沸点与相对分子质量的关系
熔点、沸点:I2>Br2> Cl2> F2
分子间作用力
C族元素的氢化物的熔、沸点与相对分子质量的关系
熔点、沸点:PbH4>SnH4>GeH4> SiH4> CH4
分子间作用力
请预测下列物质的熔沸点高低变化。
1) CH4 SiH4 GeH4 SnH4
2) HF、HCl、HBr、HI
3) H2O、 H2S 、H2Se、 H2Te
4) NH3、PH3、AsH3、SbH3
一些氢化物的沸点
反常?
氢键的存在
分子间作用力
特殊的分子间作用力
1. 强弱: 化学键>氢键>分子间作用力
主要存在 F、O、N直接与H相连的结构中
2. 主要影响:熔沸点和溶解度
1)使物质的熔沸点升高
(如HF、H2O、NH3)
2)使某些物质在水中的溶解度增大
(如NH3极易溶于水)
2、氢键:
分子间有氢键,分子就开挂
熔沸点升高, 溶解度增大
氢键叫键不是键
课堂总结
第三节 化学键
第四章 物质结构 元素周期律
第2课时
共价键
新课导入
1.为什么一分子HCl是由一个氢原子和一个氯原子构成?
而不是其他的个数比结合呢?
2.为什么氢气分子是H2而不是H3或者H4呢?
3.为什么氯气分子是Cl2而不是Cl3或者Cl4呢?
HCl分子是通过什么方式结合的呢?
共用电子对
在HCl分子的形成过程中,没有发生电子的得失,而是通过共用电子对双方达到稳定结构
给我一个电子,我就能形成相对稳定结构
给我一个电子,我也能形成相对稳定结构
共用
我们各拿出1个电子,两人共用都达到稳定结构
H2+Cl2===2HCl
点燃
原子间通过共用电子对所形成的化学键。
原子
1、概念:
2、成键粒子:
3、成键本质:
一般是非金属元素与非金属元素
4、成键元素:
原子间通过共用电子对形成的静电作用。
除NH4Cl( 铵盐)
注意:AlCl3
共价键
共价键的分类
·· ··
.Cl
:
H
共用电子对偏移
+1 -1
2、极性共价键
不同种原子间
思考:怎样判断共价键是非极性键还是极性键?
A-B
Cl 原子
吸引力强
H
H
.
1、非极性共价键
共用电子对不偏移
同种原子间
A-A
吸引力
大小相等
2、H2 分子中的 共用电子对 有偏向吗?
1、HCl中为什么H显+1价 ,Cl显-1价
共价键的分类
极性共价键
非极性共价键
共价化合物
只含共价键的化合物
1.共价化合物:
常
见
类
型
①非金属氧化物:
②非金属氢化物:
③酸:
如CO2、SO2、NO2等
如NH3、H2O、H2S等
如H2SO4、HClO、HNO3等
④大多数有机物
如CH4、C2H5OH、C6H12O6等
⑤少数金属氯化物
如AlCl3等
1.共价化合物只含共价键
3.只要含有离子键的化合物一定是离子化合物
2.只含共价键的物质不一定是共价化合物,也可能是单质
如O2、N2、H2、Cl2等
4.离子化合物中一定有离子键,也可能含有共价键。
5.稀有气体单质中无化学键。
请判断NaOH、Na2O2属于离子化合物还是共价化合物?写出其相应的电子式,并分析两化合物中的成键情况?
离子键
极性
共价键
非极性共价键
离子键
离子化合物
练习
离子化合物
共价化合物
含共价键的离子化合物
NaOH
H2S
NaOH
MgCl2
KNO3
KNO3
CO2
AlCl3
NH4Cl
NH4Cl
判断下列化合物的类型
NaOH、H2S、MgCl2、H2SO4、KNO3、CO2、NH4Cl、AlCl3
H2SO4
【例题1】下列物质中存在共价键的是 ;
属于共价化合物的是 。
H2、MgO、Cl2、CO2、HF、NaOH、H2O、Na2SO4、NH4Cl
答案:(1)H2、MgO、Cl2、CO2、HF、NaOH、H2O、Na2SO4、NH4Cl
(2)CO2、HF、H2O、
例题
例题
①H2O ②CaCl2 ③MgCl2 ④H2SO4 ⑤NaOH ⑥CO2 ⑦CaO ⑧Br2 ⑨NH3 ⑩Ar
含有共价键的是___________
含有离子键的是___________
属于共价化合物的是___________
属于离子化合物的是___________
【例题2】按要求填空:
答案:(1)①④⑤⑥⑧⑨
(2)①④⑥⑨
(3)②③⑤⑦
(4)②③⑤⑦
电子式
一对共用电子对
两对共用电子对
三对共用电子对
..
:Cl
..
:
..
Cl
..
:
..
H Cl
..
..
..
H H
..
如:H2、Cl2、HCl
如:CO2
..
..
O C O
..
..
..
..
..
..
如:N2
N
N
规律:①缺少几个电子达到稳定结构,就拿出几个电子共用。
②不加中括号[ ],不标正负电荷数
共价键的形成过程表示
★ H2 的形成:
H ·
★ HCl分子的形成:
··
· Cl
··
:
· H
+
→
H ·
+
→
Cl
··
··
H
··
··
H H
··
★ 氨分子的形成:
3 H·
+
→
· N
··
·
·
﹕
H N
﹕
﹕
﹕
H
H
1.左合右不合
2.没有电子得失,即没有弧形箭头
课堂练习
H
H
H2:_______
O2:________
O
O
N2:________
Cl
Cl
Cl2:________
N
N
HCl:________
H
Cl
H2O:________
H
O
H
NH3:________
N
H
H
H
CH4:________
C
H
H
H
H
HClO:________
CO2:________
C
O
O
H
O
Cl
H2O2:________
H
O
O
H
①每个原子一般达到相对稳定结构
②不加中括号[ ],不标正负电荷数
③一般缺几个电子拿出几个共用
微点拨
结构式
结构式:在化学上,常用一根短线“—”表示一对共用电子,其余电子一律省去,这样的式子叫做结构式。
电子式
结构式
H-Cl
O=C=O
O
H H
分子式
HCl H2O CO2 N2
分别用“-、=、≡”表示一对、二对和三对共用电子对
N N
N
N
微点拨
只适用于只含共价键的物质
球棍模型
球棍模型可以形象的展示出分子的空间结构和成键情况。
优点:
分子 电子式 结构式 分子结构模型(球棍模型)
H2
O2
N2
Cl2
HCl
H:H
O
:
:
O
:
:
:
:
N
…
:
N
:
…
Cl
:
:
:
.
Cl
:
:
:
.
H-H
O=O
N≡N
Cl-Cl
直线形
直线形
直线形
直线形
H×
Cl
:
:
:
.
H-Cl
直线形
表4-6 一些以共价键形成的分子及其结构
分子 电子式 结构式 分子结构模型(球棍模型)
H2O
CO2
NH3
CH4
:
:
H
O
H
.
×
.
×
:
O
C
O
:
××
:
:
:
××
:
.
×
H
N
:
H
H
.
×
.
×
.
×
.
×
H
C
H
H
.
×
.
×
H
H-O-H
O=C=O
H-N-H
H∣
H-C-H
H
H
∣
∣
V字形
直线形
三角锥形
正四面体形
效果检测
1.判断正误(正确的打“√”,错误的打“×”。
(1)非金属元素间一定形成共价键。 ( )
(2)共价键只存在于共价化合物中。 ( )
(3)所有物质中均存在共价键。 ( )
(4)共价化合物中一定存在共价键,可能存在离了键。( )
(5)HI 是一种比 HCl 酸性强的强酸,可用电子式表示其
形成过程: 。( )
(6)非金属元素的两个原子之间一定形成共价键,但多个原子间也
可能形成离子键。 ( )
×
×
×
×
×
√
化学键
(1) 化学键
(2) 化学键的分类
离子键
共价键
非极性键
极性键
相邻原子间的强烈相互作用
稀有气体没有化学键
相同元素
不同元素
分子间作用力
分子间作用力
(1)存在:分子之间
分子间存在的将分子聚集在一起的作用力。
(2)强弱:比化学键弱
化学键(强烈)
1、范德华力:
(3)主要影响:
物质的熔沸点和溶解度
组成和结构相似的物质,相对分子质量越大,分子间作用力越大、熔沸点越高。
分子间作用力
卤素单质的熔、沸点与相对分子质量的关系
熔点、沸点:I2>Br2> Cl2> F2
分子间作用力
C族元素的氢化物的熔、沸点与相对分子质量的关系
熔点、沸点:PbH4>SnH4>GeH4> SiH4> CH4
分子间作用力
请预测下列物质的熔沸点高低变化。
1) CH4 SiH4 GeH4 SnH4
2) HF、HCl、HBr、HI
3) H2O、 H2S 、H2Se、 H2Te
4) NH3、PH3、AsH3、SbH3
一些氢化物的沸点
反常?
氢键的存在
分子间作用力
特殊的分子间作用力
1. 强弱: 化学键>氢键>分子间作用力
主要存在 F、O、N直接与H相连的结构中
2. 主要影响:熔沸点和溶解度
1)使物质的熔沸点升高
(如HF、H2O、NH3)
2)使某些物质在水中的溶解度增大
(如NH3极易溶于水)
2、氢键:
分子间有氢键,分子就开挂
熔沸点升高, 溶解度增大
氢键叫键不是键
课堂总结
