人教版高中化学必修第一册第一章物质及其变化1.3.2氧化剂和还原剂教学课件
文档属性
| 名称 | 人教版高中化学必修第一册第一章物质及其变化1.3.2氧化剂和还原剂教学课件 |

|
|
| 格式 | ppt | ||
| 文件大小 | 399.5KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-11 00:00:00 | ||
图片预览


文档简介
(共11张PPT)
第2课时 氧化剂和还原剂
第三节 氧化还原反应
第一章 物质及其变化
学习目标
掌握比较氧化性、还原性强弱的方法。
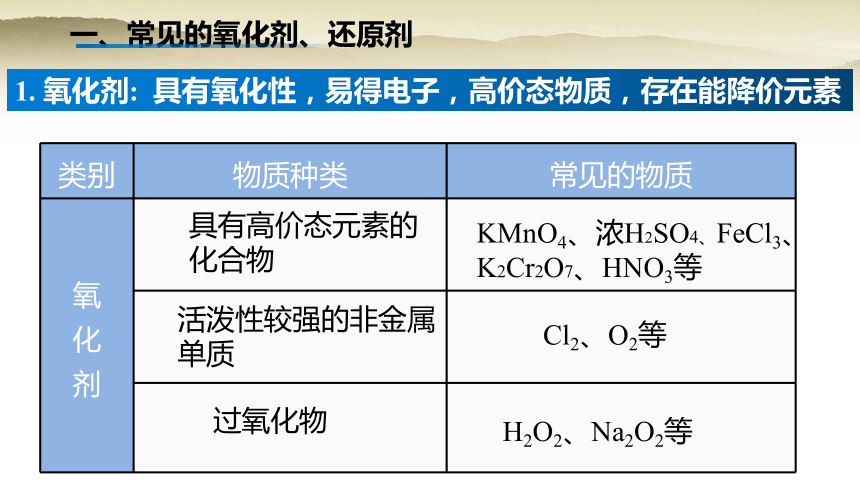
1. 氧化剂: 具有氧化性,易得电子,高价态物质,存在能降价元素
类别 物质种类 常见的物质
氧
化
剂
具有高价态元素的化合物
KMnO4、浓H2SO4、FeCl3、K2Cr2O7、HNO3等
活泼性较强的非金属单质
Cl2、O2等
过氧化物
H2O2、Na2O2等
一、常见的氧化剂、还原剂
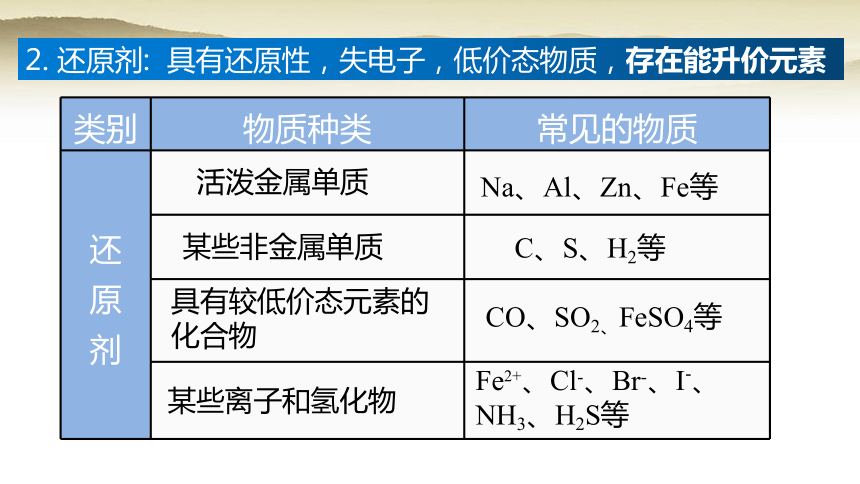
2. 还原剂: 具有还原性,失电子,低价态物质,存在能升价元素
类别 物质种类 常见的物质
还
原
剂
活泼金属单质
Na、Al、Zn、Fe等
某些非金属单质
C、S、H2等
具有较低价态元素的化合物
CO、SO2、FeSO4等
某些离子和氢化物
Fe2+、Cl-、Br-、I-、NH3、H2S等
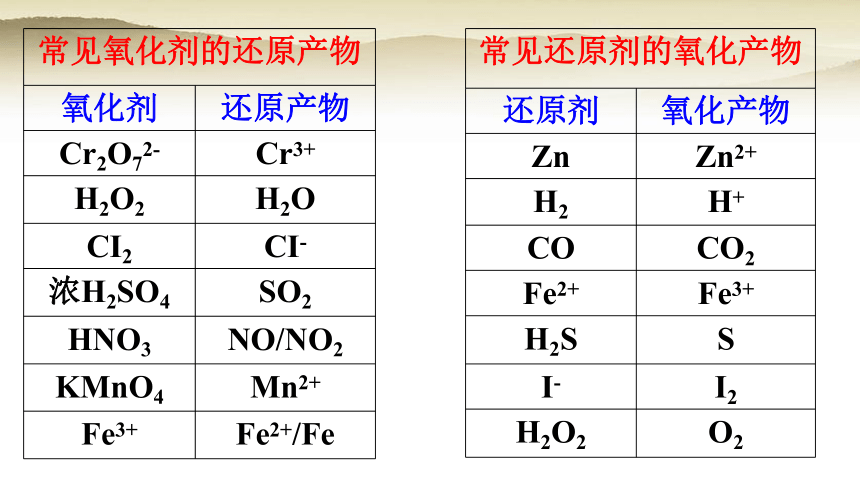
常见氧化剂的还原产物
氧化剂 还原产物
Cr2O72- Cr3+
H2O2 H2O
CI2 CI-
浓H2SO4 SO2
HNO3 NO/NO2
KMnO4 Mn2+
Fe3+ Fe2+/Fe
常见还原剂的氧化产物
还原剂 氧化产物
Zn Zn2+
H2 H+
CO CO2
Fe2+ Fe3+
H2S S
I- I2
H2O2 O2
氧化性:
氧化剂 > 氧化产物
还原剂 > 还原产物
还原性:
氧化剂+还原剂===氧化产物+还原产物
例:Cl2 + 2NaBr === 2NaCl + Br2
>
氧化性:
Cl2
Br2
还原性:
NaBr
NaCl
>
1. 根据反应方程式判断
核心
二、氧化性和还原性的强弱比较
2. 根据元素活动性顺序表判断
金属
金属单质的还原性越强,对应阳离子的氧化性越弱。
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag
单质的还原性逐渐减弱
K+ Ca2+ Na+ Mg2+ Al3+ Zn2+ Fe2+ Sn2+ Pb2+ (H+) Cu2+ (Fe3+) Hg2+ Ag+
阴离子的氧化性逐渐增强
非金属
非金属单质的氧化性越强,对应阴离子的还原性越弱。
F2 CI2 Br2 l2 S
单质的氧化性逐渐减弱
阴离子的还原性逐渐增强
F- CI- Br- l- S2-
①2KMnO4+16HCl(浓) === 2KCl+2MnCl2+5Cl2↑+8H2O
②MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
可判断氧化性:KMnO4____MnO2。
>
3. 根据反应条件比较
①2Fe+3Cl2 2FeCl3
②Fe+S FeS
可判断氧化性:氯气____硫。
>
4. 根据变价元素被氧化或被还原的程度比较
总结
一、常见的氧化剂、还原剂
二、氧化性与还原性的比较
1.通过反应方程式:两剂大于两产物(核心)
2.元素活动性顺序:单质性质越强,对应离子性质越弱
3.反应条件:条件越简单,反应越易进行,性质越强
4.同物质同条件,被不同氧化剂氧化程度越大,氧化剂的氧化性越强(还原剂同理)
第2课时 氧化剂和还原剂
第三节 氧化还原反应
第一章 物质及其变化
学习目标
掌握比较氧化性、还原性强弱的方法。
1. 氧化剂: 具有氧化性,易得电子,高价态物质,存在能降价元素
类别 物质种类 常见的物质
氧
化
剂
具有高价态元素的化合物
KMnO4、浓H2SO4、FeCl3、K2Cr2O7、HNO3等
活泼性较强的非金属单质
Cl2、O2等
过氧化物
H2O2、Na2O2等
一、常见的氧化剂、还原剂
2. 还原剂: 具有还原性,失电子,低价态物质,存在能升价元素
类别 物质种类 常见的物质
还
原
剂
活泼金属单质
Na、Al、Zn、Fe等
某些非金属单质
C、S、H2等
具有较低价态元素的化合物
CO、SO2、FeSO4等
某些离子和氢化物
Fe2+、Cl-、Br-、I-、NH3、H2S等
常见氧化剂的还原产物
氧化剂 还原产物
Cr2O72- Cr3+
H2O2 H2O
CI2 CI-
浓H2SO4 SO2
HNO3 NO/NO2
KMnO4 Mn2+
Fe3+ Fe2+/Fe
常见还原剂的氧化产物
还原剂 氧化产物
Zn Zn2+
H2 H+
CO CO2
Fe2+ Fe3+
H2S S
I- I2
H2O2 O2
氧化性:
氧化剂 > 氧化产物
还原剂 > 还原产物
还原性:
氧化剂+还原剂===氧化产物+还原产物
例:Cl2 + 2NaBr === 2NaCl + Br2
>
氧化性:
Cl2
Br2
还原性:
NaBr
NaCl
>
1. 根据反应方程式判断
核心
二、氧化性和还原性的强弱比较
2. 根据元素活动性顺序表判断
金属
金属单质的还原性越强,对应阳离子的氧化性越弱。
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag
单质的还原性逐渐减弱
K+ Ca2+ Na+ Mg2+ Al3+ Zn2+ Fe2+ Sn2+ Pb2+ (H+) Cu2+ (Fe3+) Hg2+ Ag+
阴离子的氧化性逐渐增强
非金属
非金属单质的氧化性越强,对应阴离子的还原性越弱。
F2 CI2 Br2 l2 S
单质的氧化性逐渐减弱
阴离子的还原性逐渐增强
F- CI- Br- l- S2-
①2KMnO4+16HCl(浓) === 2KCl+2MnCl2+5Cl2↑+8H2O
②MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
可判断氧化性:KMnO4____MnO2。
>
3. 根据反应条件比较
①2Fe+3Cl2 2FeCl3
②Fe+S FeS
可判断氧化性:氯气____硫。
>
4. 根据变价元素被氧化或被还原的程度比较
总结
一、常见的氧化剂、还原剂
二、氧化性与还原性的比较
1.通过反应方程式:两剂大于两产物(核心)
2.元素活动性顺序:单质性质越强,对应离子性质越弱
3.反应条件:条件越简单,反应越易进行,性质越强
4.同物质同条件,被不同氧化剂氧化程度越大,氧化剂的氧化性越强(还原剂同理)
