人教版高中化学必修第一册第一章物质及其变化1.3.3氧化还原反应的规律与配平教学课件
文档属性
| 名称 | 人教版高中化学必修第一册第一章物质及其变化1.3.3氧化还原反应的规律与配平教学课件 |  | |
| 格式 | ppt | ||
| 文件大小 | 372.5KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-11 19:48:28 | ||
图片预览





文档简介
(共12张PPT)
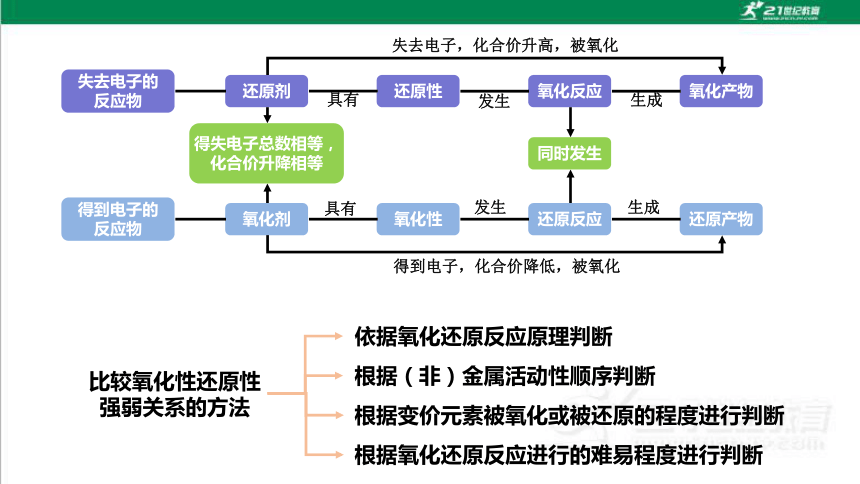
失去电子的反应物
得到电子的反应物
还原剂
还原性
氧化反应
氧化产物
氧化剂
氧化性
还原反应
还原产物
得失电子总数相等,化合价升降相等
同时发生
具有
发生
生成
失去电子,化合价升高,被氧化
具有
发生
生成
得到电子,化合价降低,被氧化
比较氧化性还原性
强弱关系的方法
依据氧化还原反应原理判断
根据(非)金属活动性顺序判断
根据变价元素被氧化或被还原的程度进行判断
根据氧化还原反应进行的难易程度进行判断
三、氧化还原反应的规律与配平
1.电子守恒
氧化剂得电子总数=还原剂失电子总数
化合价降低总数=化合价升高总数
应用:①有关氧化还原反应的计算
②配平氧化还原反应方程式
含1.2×1020个Na2SO3的溶液恰好被含4×1019个K2Cr2O7的溶液氧化为Na2SO4,则元素Cr在被还原的产物中的化合价是( )
A.+6 B.+3 C.+2 D.0
B
S+KOH(浓) →K2S+K2SO3+H2O
MnO2+HCl→MnCl2+Cl2↑+H2O
氧化反应:Na2SO3→Na2SO4 ↑2×1.2×1020
还原反应:K2Cr2O7→2(Cr ) ↓(6-x)×2×4×1019
2. 强弱规律
氧化剂+还原剂→还原产物+氧化产物
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
较强还原性的还原剂跟较强氧化性的氧化剂反应,生成弱氧化性的氧化产物和弱还原性的还原产物。
应用:比较粒子氧化性或还原性强弱;
判断氧化还原反应在一定条件下能否发生;
选择合适的氧化剂或还原剂制备物质。
根据下列反应:
H2SO3 + I2 + H2O == 2HI + H2SO4
2FeCl3 + 2HI == 2FeCl2 + 2HCl + I2
3FeCl2+4HNO3==2FeCl3 + NO↑+ 2H2O +Fe(NO3)3
判断有关物质还原性由强到弱的顺序是( )
A.H2SO3> I- >Fe2+>NO B. I- >Fe2+>H2SO3> NO
C.Fe2+>I->H2SO3>NO D. NO>Fe2+>H2SO3> I-
A
已知:X2、Y2、Z2、W2四种物质的氧化强弱顺序为W2>Z2>X2>Y2,
下列氧化还原反应能发生的是( )
A.2NaW+Z2=2NaZ+W2 B.2NaX+Z2=2NaZ+X2
C.2NaY+W2=2NaW+Y2 D.2NaZ+X2=2NaX+Z2
BC
3.价态规律
对于同种元素不同价态的原子而言,
最高价态只具有氧化性;
最低价态只具有还原性;
中间价态既具有氧化性又具有还原性。
应用:判断物质的氧化性、还原性
强调:金属单质只有还原性,大多数非金属单质既有氧化性又有还原性。
注:根据价态只能从理论上分析出该物质的氧化性、还原性,
至于强与弱,能否在反应中表现出来,还得具体物质具体分析。
化合价 -2 0 +4 +6
代表物 H2S S SO2 H2SO4(浓)
S元素的性质 还原性 既有氧化性又有还原性 氧化性
下列物质中,按只有氧化性、只有还原性、既有氧化性又有还原性的顺序排列的一组是( )
A.F2、K、HCl B.Cl2、Al、H2
C.NO2、Na、Br2 D.O2、SO2、H2O
A
4.先后规律
当一种氧化剂与多种还原剂在一起时,则氧化剂先将还原性强的还原剂氧化,然后再将还原性弱的还原剂氧化;
反之,当一种还原剂与多种氧化剂在一起时,则还原剂先将氧化性强的氧化剂还原,然后再将氧化性弱的氧化剂还原。
即“强者先行”
应用:判断氧化还原反应的先后顺序
在含有Cu(NO3)2、Mg(NO3)2和AgNO3的溶液中加入适量的锌粉,首先置换出来的是( )
A.Mg B.Cu C.Ag D.H2
C
5.归中规律
不同价态的同种元素,其较高价态和较低价态均转化为中间价态,不会交错升降。
“只靠拢,不交叉”
在反应 KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O中,氧化产物与还原产物的质量之比为( )
A.1:6 B.6:1 C.1:5 D.5:1
D
6. 难易规律
越易失电子的物质,失电子后就越难得电子。
越易得电子的物质,得电子后就越难失电子。
难失电子的物质一定易得电子。( )
×
金属单质在反应中只具有还原性( )
非金属单质在反应中只具有氧化性( )
含高价元素的化合物一定具有强氧化性( )
阳离子只有氧化性,阴离子只有还原性( )
√
×
×
×
强氧化剂与强还原剂相遇一定能发生氧化还原反应。( )
×
判断正误
失去电子的反应物
得到电子的反应物
还原剂
还原性
氧化反应
氧化产物
氧化剂
氧化性
还原反应
还原产物
得失电子总数相等,化合价升降相等
同时发生
具有
发生
生成
失去电子,化合价升高,被氧化
具有
发生
生成
得到电子,化合价降低,被氧化
比较氧化性还原性
强弱关系的方法
依据氧化还原反应原理判断
根据(非)金属活动性顺序判断
根据变价元素被氧化或被还原的程度进行判断
根据氧化还原反应进行的难易程度进行判断
三、氧化还原反应的规律与配平
1.电子守恒
氧化剂得电子总数=还原剂失电子总数
化合价降低总数=化合价升高总数
应用:①有关氧化还原反应的计算
②配平氧化还原反应方程式
含1.2×1020个Na2SO3的溶液恰好被含4×1019个K2Cr2O7的溶液氧化为Na2SO4,则元素Cr在被还原的产物中的化合价是( )
A.+6 B.+3 C.+2 D.0
B
S+KOH(浓) →K2S+K2SO3+H2O
MnO2+HCl→MnCl2+Cl2↑+H2O
氧化反应:Na2SO3→Na2SO4 ↑2×1.2×1020
还原反应:K2Cr2O7→2(Cr ) ↓(6-x)×2×4×1019
2. 强弱规律
氧化剂+还原剂→还原产物+氧化产物
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
较强还原性的还原剂跟较强氧化性的氧化剂反应,生成弱氧化性的氧化产物和弱还原性的还原产物。
应用:比较粒子氧化性或还原性强弱;
判断氧化还原反应在一定条件下能否发生;
选择合适的氧化剂或还原剂制备物质。
根据下列反应:
H2SO3 + I2 + H2O == 2HI + H2SO4
2FeCl3 + 2HI == 2FeCl2 + 2HCl + I2
3FeCl2+4HNO3==2FeCl3 + NO↑+ 2H2O +Fe(NO3)3
判断有关物质还原性由强到弱的顺序是( )
A.H2SO3> I- >Fe2+>NO B. I- >Fe2+>H2SO3> NO
C.Fe2+>I->H2SO3>NO D. NO>Fe2+>H2SO3> I-
A
已知:X2、Y2、Z2、W2四种物质的氧化强弱顺序为W2>Z2>X2>Y2,
下列氧化还原反应能发生的是( )
A.2NaW+Z2=2NaZ+W2 B.2NaX+Z2=2NaZ+X2
C.2NaY+W2=2NaW+Y2 D.2NaZ+X2=2NaX+Z2
BC
3.价态规律
对于同种元素不同价态的原子而言,
最高价态只具有氧化性;
最低价态只具有还原性;
中间价态既具有氧化性又具有还原性。
应用:判断物质的氧化性、还原性
强调:金属单质只有还原性,大多数非金属单质既有氧化性又有还原性。
注:根据价态只能从理论上分析出该物质的氧化性、还原性,
至于强与弱,能否在反应中表现出来,还得具体物质具体分析。
化合价 -2 0 +4 +6
代表物 H2S S SO2 H2SO4(浓)
S元素的性质 还原性 既有氧化性又有还原性 氧化性
下列物质中,按只有氧化性、只有还原性、既有氧化性又有还原性的顺序排列的一组是( )
A.F2、K、HCl B.Cl2、Al、H2
C.NO2、Na、Br2 D.O2、SO2、H2O
A
4.先后规律
当一种氧化剂与多种还原剂在一起时,则氧化剂先将还原性强的还原剂氧化,然后再将还原性弱的还原剂氧化;
反之,当一种还原剂与多种氧化剂在一起时,则还原剂先将氧化性强的氧化剂还原,然后再将氧化性弱的氧化剂还原。
即“强者先行”
应用:判断氧化还原反应的先后顺序
在含有Cu(NO3)2、Mg(NO3)2和AgNO3的溶液中加入适量的锌粉,首先置换出来的是( )
A.Mg B.Cu C.Ag D.H2
C
5.归中规律
不同价态的同种元素,其较高价态和较低价态均转化为中间价态,不会交错升降。
“只靠拢,不交叉”
在反应 KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O中,氧化产物与还原产物的质量之比为( )
A.1:6 B.6:1 C.1:5 D.5:1
D
6. 难易规律
越易失电子的物质,失电子后就越难得电子。
越易得电子的物质,得电子后就越难失电子。
难失电子的物质一定易得电子。( )
×
金属单质在反应中只具有还原性( )
非金属单质在反应中只具有氧化性( )
含高价元素的化合物一定具有强氧化性( )
阳离子只有氧化性,阴离子只有还原性( )
√
×
×
×
强氧化剂与强还原剂相遇一定能发生氧化还原反应。( )
×
判断正误
