人教版高中化学必修第一册第一章物质及其变化1.2.1电解质的电离教学课件
文档属性
| 名称 | 人教版高中化学必修第一册第一章物质及其变化1.2.1电解质的电离教学课件 |

|
|
| 格式 | ppt | ||
| 文件大小 | 12.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-11 00:00:00 | ||
图片预览








文档简介
(共26张PPT)
第一章 物质及其变化
第二节 离子反应 第1课时 电解质的电离
/核心素养学习目标/
一、素养新要求
1. 了解电解质的概念。
2.学会书写电解质的电离方程式。
3.理解酸、碱、盐在水溶液中的电离及导电性。
新课导入
任务一 物质导电性实验
【实验1—2】在三个烧杯中分别加入干燥的NaCl固体、 KNO3固体和蒸馏水,如图所示连接装置,将石墨电极依次放入三个烧杯中,分别接通电源,观察并记录现象。
取上述烧杯中的NaCl固体、 KNO3固体各少许,分别加入另外两个盛有蒸馏水的烧杯中,用玻璃棒搅拌,使固体完全溶解形成溶液。如图所示,将石墨电极依次放入NaCl溶液、 KNO3溶液中,分别接通电源,观察现象。
图1-9试验物质的导电性
样品 KNO3
固体 NaCl
固体 蒸馏水 NaCl
溶液 KNO3
溶液 熔融KNO3、NaCl固体 熔融的
蔗糖
灯泡现象
结论
不亮
不亮
不亮
亮
亮
不导电
不导电
不导电
导电
导电
亮
不导电
不亮
不导电
提醒:严格的说蒸馏水也能导电,但导电能力非常弱,用上述的实验装置无法测出。(蒸馏水几乎不导电)
【补充:熔融盐导电】
【实验1—2】
任务一 物质导电性实验
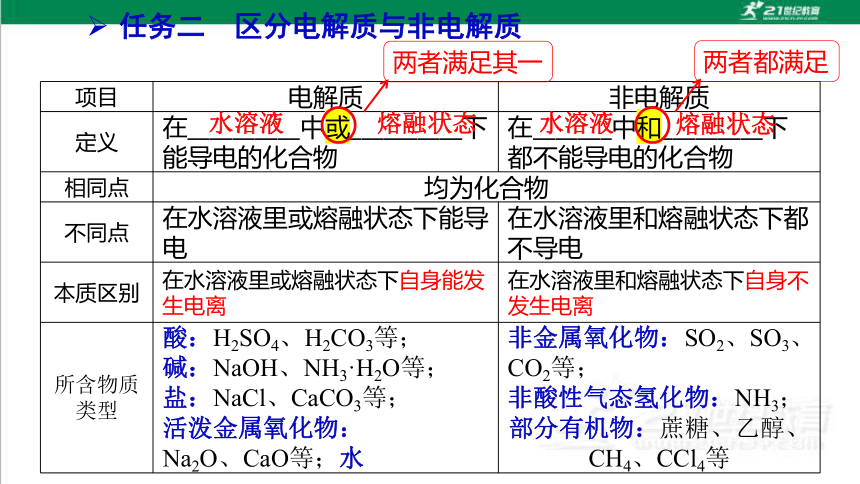
任务二 区分电解质与非电解质
项目 电解质 非电解质
定义 在__________中或__________下能导电的化合物 在_______中和_________下都不能导电的化合物
相同点 均为化合物
不同点 在水溶液里或熔融状态下能导电 在水溶液里和熔融状态下都不导电
本质区别 在水溶液里或熔融状态下自身能发生电离 在水溶液里和熔融状态下自身不发生电离
所含物质
类型 酸:H2SO4、H2CO3等;
碱:NaOH、NH3·H2O等;
盐:NaCl、CaCO3等;
活泼金属氧化物:
Na2O、CaO等;水 非金属氧化物:SO2、SO3、CO2等;
非酸性气态氢化物:NH3;
部分有机物:蔗糖、乙醇、CH4、CCl4等
水溶液
熔融状态
水溶液
熔融状态
两者满足其一
两者都满足
学以致用
湿手能够触电,或雨水中因电器意外漏电造成触电的,是因为手上出汗,有NaCl存在,形成了电解质溶液,导电能力增强。
所以大家一定不能用湿用插拔用电器!
[定义辨析]判断正误,并说明理由。
(1)能导电的物质一定是电解质( )
(2)电解质一定能导电( )
(3)一个物质不是电解质就是非电解质吗( )
(4)BaSO4、AgCl不溶于水,水溶液也不导电,是非电解质( )
(5)CO2、NH3溶于水可导电是电解质。( )
×
×
×
×
×
不一定,如铁、铝等金属单质
不一定,如固态NaCl、液态HCl等
如单质和混合物,电解质或非电解质必须是化合物。
难熔盐熔融状态能导电,仍然是电解质!!!
CO2、SO2、NH3、SO3等是非电解质,它们与水反应生成的产物
H2CO3、H2SO3、NH3·H2O、H2SO4自身能电离,是电解质。
错误,电解质一定是指自身电离生成离子的化合物。
一看:是不是化合物;(单质、混合物既不是电解质也不是非电解)
二看:是不是导电;(熔融或水溶液中)
三看:是不是自身电离。
速判方法
电解质:在水溶液或熔融态下能够导电的化合物
【定义辨析】
(2)电解质溶液的导电能力强弱与溶液的浓度和离子所带电荷有关。
注意:(1)
学习评价
1、以下物质:
①BaSO4 ②CO2 ③NH3 ④Ca(OH)2 ⑤HCl ⑥盐酸 ⑦NaOH溶液 ⑧O2 ⑨空气 ⑩熔融NaCl Na2O 乙醇 Cu 碳棒 葡萄糖
(3)既不是电解质,也不是非电解质:
(4)能导电:
(1)属于电解质: ;
(2)属于非电解质: ;
①④⑤⑩
②③
⑥⑦⑨⑧
⑥⑦⑩
任务三 微观辨析,探究电解质导电的原因
电子的定向移动
Na+和Cl-规则的紧密的排列,相互紧密吸引离子不能自由移动,故不导电
分析
NaCl水溶液导电
任务三 微观辨析,探究电解质导电的原因
电离:物质溶于水后或受热熔化时,解离成能够自由移动的离子的过程。
分析:当NaCl固体受热熔化时,离子的运动随温度升高而加快,克服了离子间的相互作用,产生了能够自由移动的Na+和Cl-
任务三 微观辨析,探究电解质导电的原因
思考与讨论为什么蔗糖溶液和酒精溶液不导电?
结论:蔗糖分子和酒精分子溶于水时,没有产生可以自由移动的阴阳离子。
2、电离方程式:用来表示电解质电离过程的式子。
NaCl =
Na+ + Cl-
KNO3 =
K+ + NO3-
遵循质量守恒、电荷守恒
原子团不能拆开写
微提醒
任务三 微观辨析,探究电解质导电的原因
学习评价
1、完成下列物质的电离方程式。
HCl= H2SO4=
HNO3=
NaOH= KOH=
Ba(OH)2=
Na2CO3= BaCl2=
CuSO4= AgNO3=
Fe2(SO4)3= Na2SO4=
KNO3= NH4Cl=
H++Cl-
2H++SO42-
H++NO3-
Na++OH-
K++OH-
Ba2++2OH-
NH4++Cl-
2Na++CO32-
2Fe3++3SO42-
Cu2++SO42-
Ba2++2Cl-
Ag++NO3-
2Na++SO42-
K++NO3-
酸:凡电离时生成的阳离子全部是H+的化合物。
碱:凡电离时生成的阴离子全部是OH-离子的化合物。
盐:凡电离时生成金属离子(包括NH4+)和酸根离子(包括酸式酸根离子)的化合物。
典例精讲
【例】NaHSO4通常为晶体,易溶于水,它溶于水时电离出三种不同的离子,溶液显酸性。NaHSO4受热熔化时只能电离出两种不同的离子。
(1)NaHSO4在水溶液中的电离方程式为 。
(2)NaHSO4在熔融状态下的电离方程式为 。
(3)下列说法中正确的是 (填字母)。
a.NaHSO4属于酸
b.NaHSO4属于盐
c. NaHSO4溶液能与Zn反应生成氢气
bc
NaHSO4==Na++H++SO42-
NaHSO4 ==== Na++HSO4-
熔融
在水中电离时,弱酸的酸式酸根不可拆,强酸拆。
熔融状态电离时,均不可拆!
微点拨
NaHSO3 =
NaHCO3 =
Na+ + HCO3-
Na+ + HSO3-
电解质的电离
电离方程式
定义和书写
概念辨析
电解质和非电解质
强电解质和弱电解质
在水溶液中是否能够完全电离
表示电解质电离的式子
二守恒:质量守恒和电荷守恒
书写要求:左边写电解质的化学式,右边写电离出的离子
课堂总结
×
×
×
×
×
×
×
√
√
√
2.下列各选项中,前者属于电解质,后者属于非电解质的是( )
A.二氧化碳、BaSO4 B.盐酸、蔗糖
C.KNO3、酒精 D.NaOH、氯气
答案:C
3.下列关于电解质的叙述正确的是( )
A.溶于水后得到的溶液能导电的物质
B.熔融态(或液态)能导电的物质
C.电解质能导电是因为电解质在电流作用下发生了电离
D.在水溶液中或熔融状态下能够导电的化合物
答案:D
答案:B
5.[2022·合肥高一检测]物质M在水溶液中发生电离:M===X2++2Y-,下列判断正确的是( )
A.M可能是酸
B.X2+一定是金属离子
C.Y-一定是OH-
D.M一定属于盐
答案:B
6.(1)判断下列物质在相应条件下能否电离,并说明理由:
①液态HCl:______,____________________________________;
②熔融状态下的NaCl:____,____________________;
③固体KOH:______,
_________________________________________________________。
不能
HCl是酸,液态时不电离,只在水溶液中电离
能
能电离出Na+和Cl-
不能
KOH在固态时,K+和OH-通过静电作用按一定规律紧密排列,不能自由移动
(2)写出下列物质在水溶液中的电离方程式:
①H2SO4_______________________;
②Ca(OH)2______________________;
③K2SO4________________________;
④NH4NO3_______________________。
Ca(OH)2=Ca2++2OH-
①:化合物(单质、混合物既不是电解质也不是非电解质)
②:导电(熔融或水溶液中)
③:自身电离。
速判方法
导电能力:强弱与离子的浓度和离子所带电荷数有关。
电离方程式:
①方程式两侧原子/电荷种类及数目相等
②原子团不能拆写
1、以下物质:
①BaSO4 ②CO2 ③NH3 ④Ca(OH)2 ⑤HCl ⑥盐酸 ⑦NaOH溶液 ⑧O2 ⑨空气 ⑩熔融NaCl Na2O 乙醇 Cu 碳棒 葡萄糖
(酸、碱、盐、水、部分金属氧化物等)
(部分有机化合物、非金属氧化物等。)
(3)既不是电解质,也不是非电解质:
(4)能导电:
(1)属于电解质: ;
(2)属于非电解质: ;
①④⑤⑩
②③
⑥⑦⑨⑧
⑥⑦⑩
[提升1]
[提升2] (1)写出下列物质在水溶液中的电离方程式。
①KOH:________________________________;
②KHSO4:_______________________________;
③Fe2(SO4)3:_____________________________;
④Na2CO3:______________________________;
⑤HNO3:_______________________________。
KOH=K++OH-
酸:电离时阳离子全部是H+的化合物。
碱:电离阴离子全部是OH-离子的化合物。
盐:凡电离时生成金属离子(包括NH4+)和酸根离子(包括酸式酸根离子)的化合物。
“=”强电解质,“ ”弱电解质(弱碱一步,弱酸分步电离)
原子守恒、电荷守恒
弱酸酸根不拆,强酸拆。熔融状态电离时,均不可拆!
小结:电离方程式书写
弱酸如H2CO3、CH3COOH等
弱碱如Cu(OH)2、NH3 H2O 等
第一章 物质及其变化
第二节 离子反应 第1课时 电解质的电离
/核心素养学习目标/
一、素养新要求
1. 了解电解质的概念。
2.学会书写电解质的电离方程式。
3.理解酸、碱、盐在水溶液中的电离及导电性。
新课导入
任务一 物质导电性实验
【实验1—2】在三个烧杯中分别加入干燥的NaCl固体、 KNO3固体和蒸馏水,如图所示连接装置,将石墨电极依次放入三个烧杯中,分别接通电源,观察并记录现象。
取上述烧杯中的NaCl固体、 KNO3固体各少许,分别加入另外两个盛有蒸馏水的烧杯中,用玻璃棒搅拌,使固体完全溶解形成溶液。如图所示,将石墨电极依次放入NaCl溶液、 KNO3溶液中,分别接通电源,观察现象。
图1-9试验物质的导电性
样品 KNO3
固体 NaCl
固体 蒸馏水 NaCl
溶液 KNO3
溶液 熔融KNO3、NaCl固体 熔融的
蔗糖
灯泡现象
结论
不亮
不亮
不亮
亮
亮
不导电
不导电
不导电
导电
导电
亮
不导电
不亮
不导电
提醒:严格的说蒸馏水也能导电,但导电能力非常弱,用上述的实验装置无法测出。(蒸馏水几乎不导电)
【补充:熔融盐导电】
【实验1—2】
任务一 物质导电性实验
任务二 区分电解质与非电解质
项目 电解质 非电解质
定义 在__________中或__________下能导电的化合物 在_______中和_________下都不能导电的化合物
相同点 均为化合物
不同点 在水溶液里或熔融状态下能导电 在水溶液里和熔融状态下都不导电
本质区别 在水溶液里或熔融状态下自身能发生电离 在水溶液里和熔融状态下自身不发生电离
所含物质
类型 酸:H2SO4、H2CO3等;
碱:NaOH、NH3·H2O等;
盐:NaCl、CaCO3等;
活泼金属氧化物:
Na2O、CaO等;水 非金属氧化物:SO2、SO3、CO2等;
非酸性气态氢化物:NH3;
部分有机物:蔗糖、乙醇、CH4、CCl4等
水溶液
熔融状态
水溶液
熔融状态
两者满足其一
两者都满足
学以致用
湿手能够触电,或雨水中因电器意外漏电造成触电的,是因为手上出汗,有NaCl存在,形成了电解质溶液,导电能力增强。
所以大家一定不能用湿用插拔用电器!
[定义辨析]判断正误,并说明理由。
(1)能导电的物质一定是电解质( )
(2)电解质一定能导电( )
(3)一个物质不是电解质就是非电解质吗( )
(4)BaSO4、AgCl不溶于水,水溶液也不导电,是非电解质( )
(5)CO2、NH3溶于水可导电是电解质。( )
×
×
×
×
×
不一定,如铁、铝等金属单质
不一定,如固态NaCl、液态HCl等
如单质和混合物,电解质或非电解质必须是化合物。
难熔盐熔融状态能导电,仍然是电解质!!!
CO2、SO2、NH3、SO3等是非电解质,它们与水反应生成的产物
H2CO3、H2SO3、NH3·H2O、H2SO4自身能电离,是电解质。
错误,电解质一定是指自身电离生成离子的化合物。
一看:是不是化合物;(单质、混合物既不是电解质也不是非电解)
二看:是不是导电;(熔融或水溶液中)
三看:是不是自身电离。
速判方法
电解质:在水溶液或熔融态下能够导电的化合物
【定义辨析】
(2)电解质溶液的导电能力强弱与溶液的浓度和离子所带电荷有关。
注意:(1)
学习评价
1、以下物质:
①BaSO4 ②CO2 ③NH3 ④Ca(OH)2 ⑤HCl ⑥盐酸 ⑦NaOH溶液 ⑧O2 ⑨空气 ⑩熔融NaCl Na2O 乙醇 Cu 碳棒 葡萄糖
(3)既不是电解质,也不是非电解质:
(4)能导电:
(1)属于电解质: ;
(2)属于非电解质: ;
①④⑤⑩
②③
⑥⑦⑨⑧
⑥⑦⑩
任务三 微观辨析,探究电解质导电的原因
电子的定向移动
Na+和Cl-规则的紧密的排列,相互紧密吸引离子不能自由移动,故不导电
分析
NaCl水溶液导电
任务三 微观辨析,探究电解质导电的原因
电离:物质溶于水后或受热熔化时,解离成能够自由移动的离子的过程。
分析:当NaCl固体受热熔化时,离子的运动随温度升高而加快,克服了离子间的相互作用,产生了能够自由移动的Na+和Cl-
任务三 微观辨析,探究电解质导电的原因
思考与讨论为什么蔗糖溶液和酒精溶液不导电?
结论:蔗糖分子和酒精分子溶于水时,没有产生可以自由移动的阴阳离子。
2、电离方程式:用来表示电解质电离过程的式子。
NaCl =
Na+ + Cl-
KNO3 =
K+ + NO3-
遵循质量守恒、电荷守恒
原子团不能拆开写
微提醒
任务三 微观辨析,探究电解质导电的原因
学习评价
1、完成下列物质的电离方程式。
HCl= H2SO4=
HNO3=
NaOH= KOH=
Ba(OH)2=
Na2CO3= BaCl2=
CuSO4= AgNO3=
Fe2(SO4)3= Na2SO4=
KNO3= NH4Cl=
H++Cl-
2H++SO42-
H++NO3-
Na++OH-
K++OH-
Ba2++2OH-
NH4++Cl-
2Na++CO32-
2Fe3++3SO42-
Cu2++SO42-
Ba2++2Cl-
Ag++NO3-
2Na++SO42-
K++NO3-
酸:凡电离时生成的阳离子全部是H+的化合物。
碱:凡电离时生成的阴离子全部是OH-离子的化合物。
盐:凡电离时生成金属离子(包括NH4+)和酸根离子(包括酸式酸根离子)的化合物。
典例精讲
【例】NaHSO4通常为晶体,易溶于水,它溶于水时电离出三种不同的离子,溶液显酸性。NaHSO4受热熔化时只能电离出两种不同的离子。
(1)NaHSO4在水溶液中的电离方程式为 。
(2)NaHSO4在熔融状态下的电离方程式为 。
(3)下列说法中正确的是 (填字母)。
a.NaHSO4属于酸
b.NaHSO4属于盐
c. NaHSO4溶液能与Zn反应生成氢气
bc
NaHSO4==Na++H++SO42-
NaHSO4 ==== Na++HSO4-
熔融
在水中电离时,弱酸的酸式酸根不可拆,强酸拆。
熔融状态电离时,均不可拆!
微点拨
NaHSO3 =
NaHCO3 =
Na+ + HCO3-
Na+ + HSO3-
电解质的电离
电离方程式
定义和书写
概念辨析
电解质和非电解质
强电解质和弱电解质
在水溶液中是否能够完全电离
表示电解质电离的式子
二守恒:质量守恒和电荷守恒
书写要求:左边写电解质的化学式,右边写电离出的离子
课堂总结
×
×
×
×
×
×
×
√
√
√
2.下列各选项中,前者属于电解质,后者属于非电解质的是( )
A.二氧化碳、BaSO4 B.盐酸、蔗糖
C.KNO3、酒精 D.NaOH、氯气
答案:C
3.下列关于电解质的叙述正确的是( )
A.溶于水后得到的溶液能导电的物质
B.熔融态(或液态)能导电的物质
C.电解质能导电是因为电解质在电流作用下发生了电离
D.在水溶液中或熔融状态下能够导电的化合物
答案:D
答案:B
5.[2022·合肥高一检测]物质M在水溶液中发生电离:M===X2++2Y-,下列判断正确的是( )
A.M可能是酸
B.X2+一定是金属离子
C.Y-一定是OH-
D.M一定属于盐
答案:B
6.(1)判断下列物质在相应条件下能否电离,并说明理由:
①液态HCl:______,____________________________________;
②熔融状态下的NaCl:____,____________________;
③固体KOH:______,
_________________________________________________________。
不能
HCl是酸,液态时不电离,只在水溶液中电离
能
能电离出Na+和Cl-
不能
KOH在固态时,K+和OH-通过静电作用按一定规律紧密排列,不能自由移动
(2)写出下列物质在水溶液中的电离方程式:
①H2SO4_______________________;
②Ca(OH)2______________________;
③K2SO4________________________;
④NH4NO3_______________________。
Ca(OH)2=Ca2++2OH-
①:化合物(单质、混合物既不是电解质也不是非电解质)
②:导电(熔融或水溶液中)
③:自身电离。
速判方法
导电能力:强弱与离子的浓度和离子所带电荷数有关。
电离方程式:
①方程式两侧原子/电荷种类及数目相等
②原子团不能拆写
1、以下物质:
①BaSO4 ②CO2 ③NH3 ④Ca(OH)2 ⑤HCl ⑥盐酸 ⑦NaOH溶液 ⑧O2 ⑨空气 ⑩熔融NaCl Na2O 乙醇 Cu 碳棒 葡萄糖
(酸、碱、盐、水、部分金属氧化物等)
(部分有机化合物、非金属氧化物等。)
(3)既不是电解质,也不是非电解质:
(4)能导电:
(1)属于电解质: ;
(2)属于非电解质: ;
①④⑤⑩
②③
⑥⑦⑨⑧
⑥⑦⑩
[提升1]
[提升2] (1)写出下列物质在水溶液中的电离方程式。
①KOH:________________________________;
②KHSO4:_______________________________;
③Fe2(SO4)3:_____________________________;
④Na2CO3:______________________________;
⑤HNO3:_______________________________。
KOH=K++OH-
酸:电离时阳离子全部是H+的化合物。
碱:电离阴离子全部是OH-离子的化合物。
盐:凡电离时生成金属离子(包括NH4+)和酸根离子(包括酸式酸根离子)的化合物。
“=”强电解质,“ ”弱电解质(弱碱一步,弱酸分步电离)
原子守恒、电荷守恒
弱酸酸根不拆,强酸拆。熔融状态电离时,均不可拆!
小结:电离方程式书写
弱酸如H2CO3、CH3COOH等
弱碱如Cu(OH)2、NH3 H2O 等
