人教版高中化学必修第一册第一章物质及其变化1.4整理与提升教学课件
文档属性
| 名称 | 人教版高中化学必修第一册第一章物质及其变化1.4整理与提升教学课件 |  | |
| 格式 | ppt | ||
| 文件大小 | 46.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-11 19:49:07 | ||
图片预览





文档简介
(共68张PPT)
物质及其变化
第一章
目
录
CONTENTS
01
02
03
离子反应
物质的分类与转化
氧化还原反应
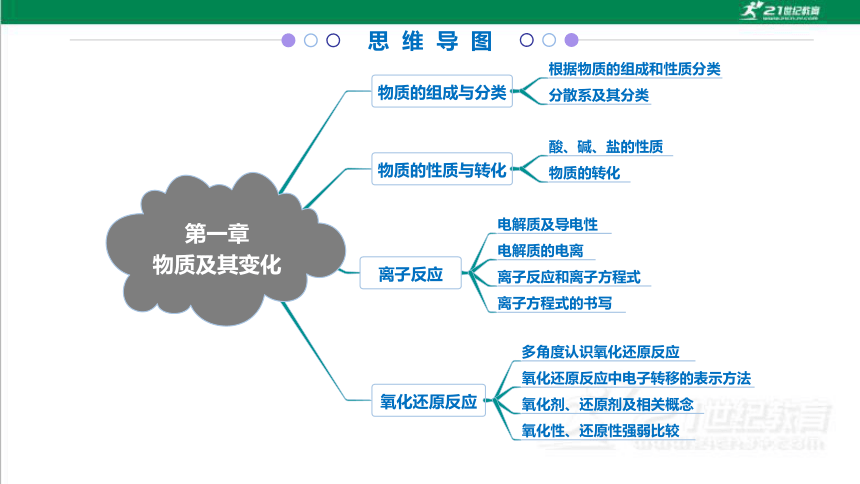
思 维 导 图
第一章
物质及其变化
物质的组成与分类
离子反应
氧化还原反应
物质的性质与转化
根据物质的组成和性质分类
分散系及其分类
酸、碱、盐的性质
物质的转化
电解质及导电性
电解质的电离
离子反应和离子方程式
离子方程式的书写
多角度认识氧化还原反应
氧化还原反应中电子转移的表示方法
氧化剂、还原剂及相关概念
氧化性、还原性强弱比较
物质的分类与转化
1
考 点 梳 理
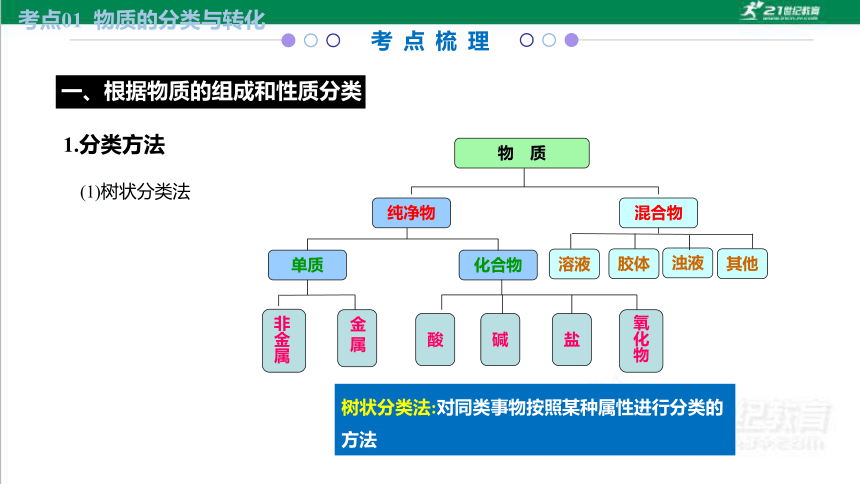
一、根据物质的组成和性质分类
考点01 物质的分类与转化
(1)树状分类法
1.分类方法
其他
物 质
纯净物
混合物
溶液
化合物
单质
盐
碱
酸
非金属
金 属
氧化物
胶体
浊液
树状分类法:对同类事物按照某种属性进行分类的方法
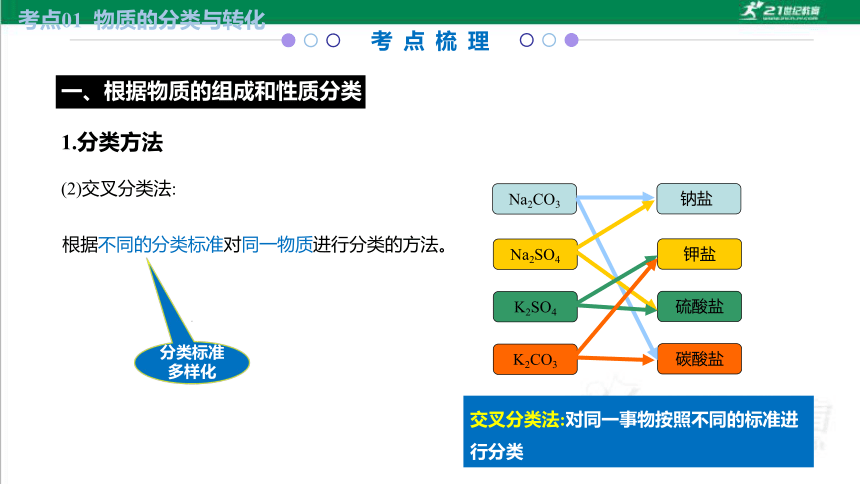
考 点 梳 理
一、根据物质的组成和性质分类
考点01 物质的分类与转化
根据不同的分类标准对同一物质进行分类的方法。
(2)交叉分类法:
分类标准
多样化
1.分类方法
Na2SO4
K2SO4
K2CO3
碳酸盐
硫酸盐
钾盐
Na2CO3
钠盐
交叉分类法:对同一事物按照不同的标准进行分类
考 点 梳 理
考点01 物质的分类与转化
一、根据物质的组成和性质分类
二、分散系 胶体
1.分散系
(1)定义:一种(或多种)物质以粒子形式分散到另一种(或多种)物质中所形成的混合物。
(2)组成:
分散质—
分散剂—
被分散的物质
起容纳分散质作用的物质
(3)分类:
按照分散质的粒子直径大小
10-9 m
溶液
10-7 m
浊液
胶体
分散质粒子直径
考 点 梳 理
考点01 物质的分类与转化
一、根据物质的组成和性质分类
二、分散系 胶体
1.分散系
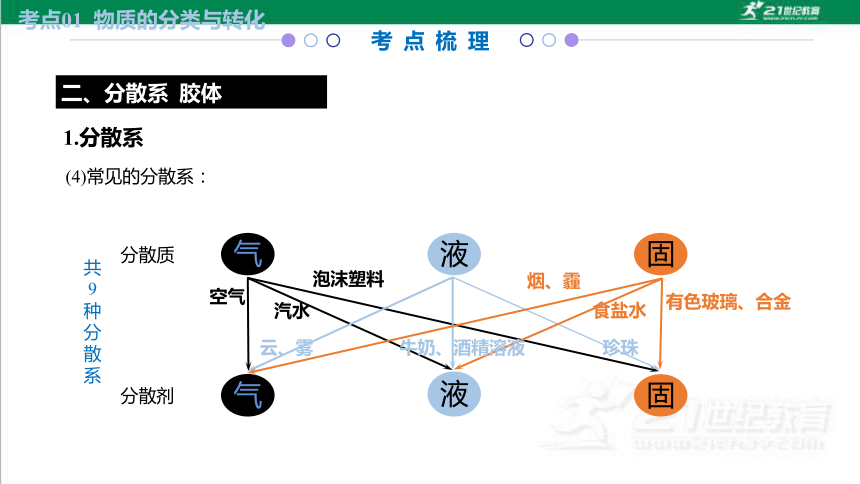
(4)常见的分散系:
分散质
分散剂
气
液
固
气
液
固
空气
云、雾
烟、霾
汽水
牛奶、酒精溶液
食盐水
泡沫塑料
珍珠
有色玻璃、合金
共 9种分散系
考 点 梳 理
考点01 物质的分类与转化
三、酸、碱、盐、氧化物的性质
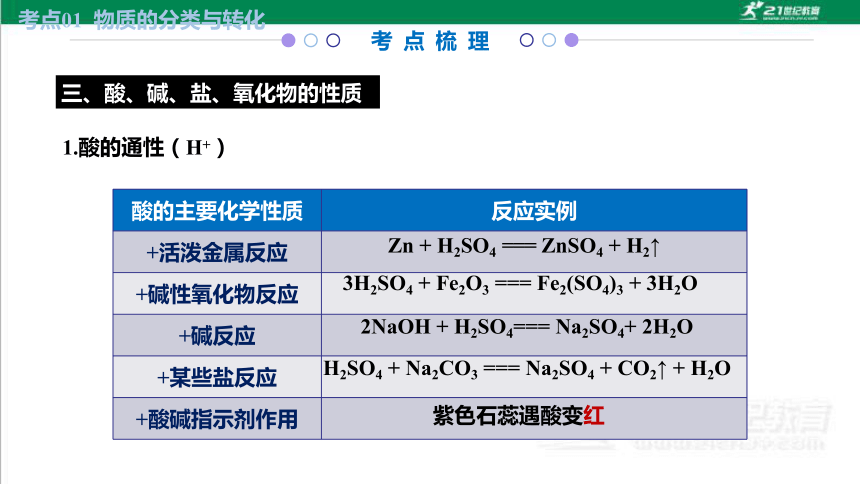
酸的主要化学性质 反应实例
+活泼金属反应
+碱性氧化物反应
+碱反应
+某些盐反应
+酸碱指示剂作用
Zn + H2SO4 === ZnSO4 + H2↑
3H2SO4 + Fe2O3 === Fe2(SO4)3 + 3H2O
2NaOH + H2SO4=== Na2SO4+ 2H2O
H2SO4 + Na2CO3 === Na2SO4 + CO2↑ + H2O
紫色石蕊遇酸变红
1.酸的通性(H+)
考 点 梳 理
考点01 物质的分类与转化
2.碱的通性(OH-)
碱的主要化学性质 反应实例
+酸性氧化物反应
+酸反应
+某些盐反应
+酸碱指示剂作用
Ca(OH)2 + CO2 === CaCO3↓ + H2O
Ca(OH)2 + 2HCl === CaCl2 + H2O
Ca(OH)2+ Na2CO3 === CaCO3↓+ 2NaOH
紫色石蕊遇碱变蓝,酚酞遇碱变红
三、酸、碱、盐、氧化物的性质
考 点 梳 理
考点01 物质的分类与转化
3.盐的通性(OH-)
盐的主要化学性质 反应实例
与碱反应
与酸反应
与某些盐的反应
三、酸、碱、盐、氧化物的性质
K2CO3+Ca(OH)2=CaCO3↓+2KOH
K2CO3+2HCl =CaCl2+H2O+CO2↑
K2CO3+CaCl2=CaCO3↓+2KCl
考 点 梳 理
考点01 物质的分类与转化
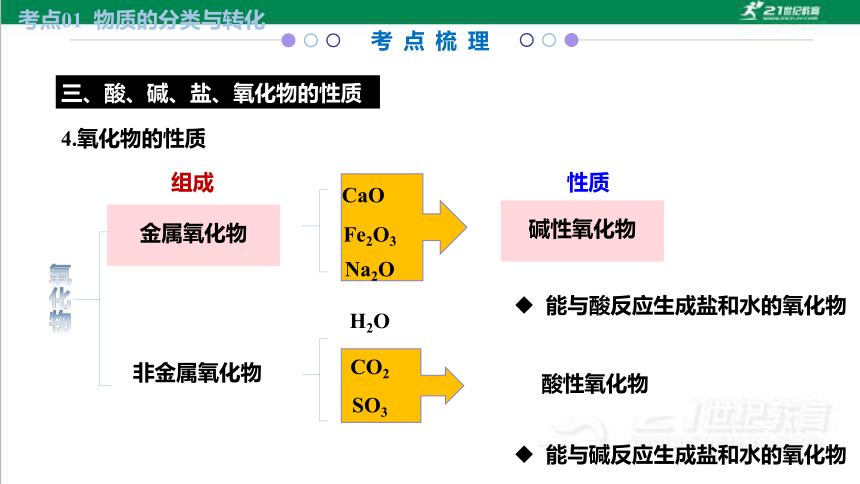
4.氧化物的性质
三、酸、碱、盐、氧化物的性质
组成
CaO
CO2
Fe2O3
Na2O
金属氧化物
非金属氧化物
能与酸反应生成盐和水的氧化物
碱性氧化物
酸性氧化物
H2O
性质
能与碱反应生成盐和水的氧化物
SO3
考 点 梳 理
考点01 物质的分类与转化
1.转化规律
四、物质的转化
金属单质
碱性氧化物
碱
盐
O2
H2O
酸或酸性氧化物
非金属单质
酸性氧化物
酸
O2
H2O
碱或碱性氧化物
盐
考 点 梳 理
考点01 物质的分类与转化
2.转化关系图
四、物质的转化
金属单质
非金属
单质
碱性氧化物
酸性氧化物
碱
酸
盐
盐
盐
盐+水
盐+碱
盐+酸
盐+盐
盐+H2
盐+金属
典 例 精 讲
考点01 物质的分类与转化
A
典 例 精 讲
考点01 物质的分类与转化
B
举 一 反 三
考点01 物质的分类与转化
D
纯净物 混合物 电解质 非电解质
A 盐酸 冰水混合物 硫酸 干冰
B 蒸馏水 五水硫酸铜 氧化铝 二氧化硫
C 胆矾 碱石灰 铁 碳酸钙
D 液氮 合金 氯化铜 蔗糖
典 例 精 讲
考点01 物质的分类与转化
C
典 例 精 讲
考点01 物质的分类与转化
C
举 一 反 三
考点01 物质的分类与转化
D
典 例 精 讲
考点01 物质的分类与转化
D
举 一 反 三
考点01 物质的分类与转化
A
典 例 精 讲
考点01 物质的分类与转化
C
举 一 反 三
考点01 物质的分类与转化
A
离子反应
2
考点02 离子反应
考 点 梳 理
一、电解质及导电性
电解质
H2SO4、HCl、HNO3等
NaOH、NH3 H2O、Fe(OH)3等
NaCl、KNO3、CaCO3等
Na2O、MgO、CaO等
CH3COOH等
电解质
考点02 离子反应
考 点 梳 理
一、电解质及导电性
导电性
物质导电的原因:具有能__________、_______的粒子。
自由移动
带电荷
自由移动的离子
自由移动的电子(金属导电)
① 金属单质
有自由移动的电子,可导电
② 电解质溶液/熔融电解质
有自由移动的离子,可导电
导电能力强弱:溶液中自由移动离子浓度;离子所带电荷数
考点02 离子反应
考 点 梳 理
二、电解质的电离
形成
自由移动的离子
微观
宏观
电解质
电解质
溶液
熔融
电解质
加水溶解
加热熔化
或
能导电
注意:电离过程不需要通电
电离
考点02 离子反应
考 点 梳 理
表示电解质电离的式子
NaCl = Na+ + Cl-
KNO3 = K+ + NO3-
Na2SO4 = 2Na+ + SO42-
HCl = H+ + Cl-
H2SO4 = 2H+ + SO42-
HNO3 = H+ + NO3-
质量守恒
电离前后原子或离子个数相等
电荷守恒
右边阴、阳离子所带电荷总数相等
符合客观事实
电离方程式
二、电解质的电离
考点02 离子反应
考 点 梳 理
离子反应
1. 定 义
有离子参加(或生成)的反应
溶液中(或熔融状态下)
2. 研究体系
3. 反应发生的条件
置换反应:活泼金属与盐酸和稀硫酸的反应
活泼金属与不活泼金属盐的反应
三、离子反应和离子方程式
考点02 离子反应
考 点 梳 理
离子反应的实质
三、离子反应和离子方程式
考点02 离子反应
考 点 梳 理
离子方程式
1. 定 义:
用实际参加反应的离子符号来表示反应的式子
Ba2+ + SO42- = BaSO4↓
非溶液中进行的反应一般不能写离子方程式
注意:
只能用化学方程式表示: H2 + CuO = Cu + H2O
△
三、离子反应和离子方程式
考点02 离子反应
考 点 梳 理
(1)“写”正确写出反应的化学方程式。
(2)“拆” 把易溶于水且易电离的物质(强酸、强碱、和大部分可溶性盐)拆写成离子形式;难溶的物质、气体和水等仍用化学式表示。
(4)“查”检查离子方程两边各元素的原子个数和电荷是否相等
(3)“删” 删去方程式两边不参加反应的离子,并将方程式化简
四、离子方程式的书写
考点02 离子反应
考 点 梳 理
离子方程式的意义
离子方程式不仅可以表示某个具体的化学反应,还可以表示同一类型的离子反应
四、离子方程式的书写
典 例 精 讲
C
考点02 离子反应
典 例 精 讲
D
考点02 离子反应
举 一 反 三
D
考点02 离子反应
典 例 精 讲
C
考点02 离子反应
典 例 精 讲
A
考点02 离子反应
举 一 反 三
D
考点02 离子反应
举 一 反 三
D
考点02 离子反应
典 例 精 讲
B
考点02 离子反应
典 例 精 讲
B
考点02 离子反应
典 例 精 讲
C
考点02 离子反应
举 一 反 三
B
考点02 离子反应
举 一 反 三
D
考点02 离子反应
氧化还原反应
3
考点03 氧化还原反应
考 点 梳 理
一、多角度认识氧化还原反应
氧化反应
还原反应
得到氧
失去氧
化合价升高
化合价降低
失电子(共用电子对偏离)
得电子(共用电子对偏向)
同时发生
得失氧
化合价变化
电子的转移
考点03 氧化还原反应
考 点 梳 理
二、氧化还原反应中电子转移的表示方法
双线桥
先标化合价,再看价变化;
起止同元素,桥上标变化。
考点03 氧化还原反应
考 点 梳 理
二、氧化还原反应中电子转移的表示方法
单线桥
考点03 氧化还原反应
考 点 梳 理
三、氧化剂、还原剂及相关概念
考点03 氧化还原反应
考 点 梳 理
三、氧化剂、还原剂及相关概念
失电子,化合价升高,被氧化,发生氧化反应
氧化剂 + 还原剂 = 还原产物 + 氧化产物
得电子,化合价降低,被还原,发生还原反应
考点03 氧化还原反应
考 点 梳 理
三、氧化剂、还原剂及相关概念
常见的氧化剂 、还原剂
氧化还原反应
氧化剂 还原剂
单质
化合物 氧化物
盐
含氧酸
其他
Na、Fe、 Al、Zn、 S 、 H2、C
MnO2、CO2 、 NO2 、H2O2、Na2O2
CO、SO2
FeCl3、KMnO4 、KClO3 、 NaClO
FeSO4、 Na2SO3 、 KI、Na2S、FeCl2
HClO、HNO3、浓硫酸
H2SO3
HCl
H2S、HCl、NH3
考点03 氧化还原反应
考 点 梳 理
四、氧化性、还原性强弱比较
失去电子的难易程度
化合价降低
化合价升高
比如还原性:Na > Al
氧化性和还原性
考点03 氧化还原反应
考 点 梳 理
四、氧化性、还原性强弱比较
强弱规律——根据根据元素的活动性顺序比较
如:Cl2+2NaBr===2NaCl+Br2
氧化性:Cl2>Br2
在反应中Cl2是_____剂,
Br2是_____产物
如:Fe+CuSO4===FeSO4+Cu
还原性:Fe>Cu
在反应中Fe是_____剂,
Cu是_____产物。
还原
还原
氧化
氧化
考点03 氧化还原反应
考 点 梳 理
四、氧化性、还原性强弱比较
强弱规律——根据氧化还原反应方程式比较
氧化剂
还原剂
还原产物
氧化产物
被氧化
被还原
>
>
如:2FeCl3+2HI=2FeCl2+2HCl+I2
氧化性:FeCl3 I2
还原性:HI FeCl2
>
>
氧化性:氧化剂 氧化产物
还原性:还原剂 还原产物
考点03 氧化还原反应
考 点 梳 理
四、氧化性、还原性强弱比较
强弱规律——根据反应进行的难易程度(反应条件)来判断
当不同氧化剂分别与同一还原剂反应时,如果氧化产物价态相同,可根据反应的难易来判断,反应越容易,该氧化剂氧化性就越强
MnO2+4HCl(浓) = MnCl2+Cl2↑+2H2O
2KMnO4+16HCl(浓) = 2KCl+2MnCl2+5Cl2↑+8H2O
△
氧化性: KMnO4> MnO2
考点03 氧化还原反应
考 点 梳 理
四、氧化性、还原性强弱比较
强弱规律——根据元素被氧化/还原的程度来判断
某还原剂被不同氧化剂氧化时,元素化合价升得越高,说明氧化剂的氧化性越强。
2Fe + 3Cl2 2FeCl3 Fe + S FeS
氧化性:_______
Cu + 2Fe3+ ==== Cu2+ + 2Fe2+ 3Zn + 2Fe3+ ==== 3Zn2+ + 2Fe
还原性:__________
点燃
Cl2 > S
Zn > Cu
△
考点03 氧化还原反应
考 点 梳 理
四、氧化性、还原性强弱比较
强弱规律——根据元素的化合价进行判断
元素处于中间价态,则既有氧化性又有还原性
元素处于低价态具有还原性,最低价态,则只具有还原性
元素处于高价态具有氧化性,最高价态,则只具有氧化性
典 例 精 讲
C
考点03 氧化还原反应
典 例 精 讲
D
考点03 氧化还原反应
举 一 反 三
A
考点03 氧化还原反应
典 例 精 讲
考点03 氧化还原反应
NaClO
Fe
Cl-
举 一 反 三
考点03 氧化还原反应
典 例 精 讲
C
考点03 氧化还原反应
举 一 反 三
C
考点03 氧化还原反应
典 例 精 讲
B
考点03 氧化还原反应
举 一 反 三
D
考点03 氧化还原反应
物质及其变化
第一章
目
录
CONTENTS
01
02
03
离子反应
物质的分类与转化
氧化还原反应
思 维 导 图
第一章
物质及其变化
物质的组成与分类
离子反应
氧化还原反应
物质的性质与转化
根据物质的组成和性质分类
分散系及其分类
酸、碱、盐的性质
物质的转化
电解质及导电性
电解质的电离
离子反应和离子方程式
离子方程式的书写
多角度认识氧化还原反应
氧化还原反应中电子转移的表示方法
氧化剂、还原剂及相关概念
氧化性、还原性强弱比较
物质的分类与转化
1
考 点 梳 理
一、根据物质的组成和性质分类
考点01 物质的分类与转化
(1)树状分类法
1.分类方法
其他
物 质
纯净物
混合物
溶液
化合物
单质
盐
碱
酸
非金属
金 属
氧化物
胶体
浊液
树状分类法:对同类事物按照某种属性进行分类的方法
考 点 梳 理
一、根据物质的组成和性质分类
考点01 物质的分类与转化
根据不同的分类标准对同一物质进行分类的方法。
(2)交叉分类法:
分类标准
多样化
1.分类方法
Na2SO4
K2SO4
K2CO3
碳酸盐
硫酸盐
钾盐
Na2CO3
钠盐
交叉分类法:对同一事物按照不同的标准进行分类
考 点 梳 理
考点01 物质的分类与转化
一、根据物质的组成和性质分类
二、分散系 胶体
1.分散系
(1)定义:一种(或多种)物质以粒子形式分散到另一种(或多种)物质中所形成的混合物。
(2)组成:
分散质—
分散剂—
被分散的物质
起容纳分散质作用的物质
(3)分类:
按照分散质的粒子直径大小
10-9 m
溶液
10-7 m
浊液
胶体
分散质粒子直径
考 点 梳 理
考点01 物质的分类与转化
一、根据物质的组成和性质分类
二、分散系 胶体
1.分散系
(4)常见的分散系:
分散质
分散剂
气
液
固
气
液
固
空气
云、雾
烟、霾
汽水
牛奶、酒精溶液
食盐水
泡沫塑料
珍珠
有色玻璃、合金
共 9种分散系
考 点 梳 理
考点01 物质的分类与转化
三、酸、碱、盐、氧化物的性质
酸的主要化学性质 反应实例
+活泼金属反应
+碱性氧化物反应
+碱反应
+某些盐反应
+酸碱指示剂作用
Zn + H2SO4 === ZnSO4 + H2↑
3H2SO4 + Fe2O3 === Fe2(SO4)3 + 3H2O
2NaOH + H2SO4=== Na2SO4+ 2H2O
H2SO4 + Na2CO3 === Na2SO4 + CO2↑ + H2O
紫色石蕊遇酸变红
1.酸的通性(H+)
考 点 梳 理
考点01 物质的分类与转化
2.碱的通性(OH-)
碱的主要化学性质 反应实例
+酸性氧化物反应
+酸反应
+某些盐反应
+酸碱指示剂作用
Ca(OH)2 + CO2 === CaCO3↓ + H2O
Ca(OH)2 + 2HCl === CaCl2 + H2O
Ca(OH)2+ Na2CO3 === CaCO3↓+ 2NaOH
紫色石蕊遇碱变蓝,酚酞遇碱变红
三、酸、碱、盐、氧化物的性质
考 点 梳 理
考点01 物质的分类与转化
3.盐的通性(OH-)
盐的主要化学性质 反应实例
与碱反应
与酸反应
与某些盐的反应
三、酸、碱、盐、氧化物的性质
K2CO3+Ca(OH)2=CaCO3↓+2KOH
K2CO3+2HCl =CaCl2+H2O+CO2↑
K2CO3+CaCl2=CaCO3↓+2KCl
考 点 梳 理
考点01 物质的分类与转化
4.氧化物的性质
三、酸、碱、盐、氧化物的性质
组成
CaO
CO2
Fe2O3
Na2O
金属氧化物
非金属氧化物
能与酸反应生成盐和水的氧化物
碱性氧化物
酸性氧化物
H2O
性质
能与碱反应生成盐和水的氧化物
SO3
考 点 梳 理
考点01 物质的分类与转化
1.转化规律
四、物质的转化
金属单质
碱性氧化物
碱
盐
O2
H2O
酸或酸性氧化物
非金属单质
酸性氧化物
酸
O2
H2O
碱或碱性氧化物
盐
考 点 梳 理
考点01 物质的分类与转化
2.转化关系图
四、物质的转化
金属单质
非金属
单质
碱性氧化物
酸性氧化物
碱
酸
盐
盐
盐
盐+水
盐+碱
盐+酸
盐+盐
盐+H2
盐+金属
典 例 精 讲
考点01 物质的分类与转化
A
典 例 精 讲
考点01 物质的分类与转化
B
举 一 反 三
考点01 物质的分类与转化
D
纯净物 混合物 电解质 非电解质
A 盐酸 冰水混合物 硫酸 干冰
B 蒸馏水 五水硫酸铜 氧化铝 二氧化硫
C 胆矾 碱石灰 铁 碳酸钙
D 液氮 合金 氯化铜 蔗糖
典 例 精 讲
考点01 物质的分类与转化
C
典 例 精 讲
考点01 物质的分类与转化
C
举 一 反 三
考点01 物质的分类与转化
D
典 例 精 讲
考点01 物质的分类与转化
D
举 一 反 三
考点01 物质的分类与转化
A
典 例 精 讲
考点01 物质的分类与转化
C
举 一 反 三
考点01 物质的分类与转化
A
离子反应
2
考点02 离子反应
考 点 梳 理
一、电解质及导电性
电解质
H2SO4、HCl、HNO3等
NaOH、NH3 H2O、Fe(OH)3等
NaCl、KNO3、CaCO3等
Na2O、MgO、CaO等
CH3COOH等
电解质
考点02 离子反应
考 点 梳 理
一、电解质及导电性
导电性
物质导电的原因:具有能__________、_______的粒子。
自由移动
带电荷
自由移动的离子
自由移动的电子(金属导电)
① 金属单质
有自由移动的电子,可导电
② 电解质溶液/熔融电解质
有自由移动的离子,可导电
导电能力强弱:溶液中自由移动离子浓度;离子所带电荷数
考点02 离子反应
考 点 梳 理
二、电解质的电离
形成
自由移动的离子
微观
宏观
电解质
电解质
溶液
熔融
电解质
加水溶解
加热熔化
或
能导电
注意:电离过程不需要通电
电离
考点02 离子反应
考 点 梳 理
表示电解质电离的式子
NaCl = Na+ + Cl-
KNO3 = K+ + NO3-
Na2SO4 = 2Na+ + SO42-
HCl = H+ + Cl-
H2SO4 = 2H+ + SO42-
HNO3 = H+ + NO3-
质量守恒
电离前后原子或离子个数相等
电荷守恒
右边阴、阳离子所带电荷总数相等
符合客观事实
电离方程式
二、电解质的电离
考点02 离子反应
考 点 梳 理
离子反应
1. 定 义
有离子参加(或生成)的反应
溶液中(或熔融状态下)
2. 研究体系
3. 反应发生的条件
置换反应:活泼金属与盐酸和稀硫酸的反应
活泼金属与不活泼金属盐的反应
三、离子反应和离子方程式
考点02 离子反应
考 点 梳 理
离子反应的实质
三、离子反应和离子方程式
考点02 离子反应
考 点 梳 理
离子方程式
1. 定 义:
用实际参加反应的离子符号来表示反应的式子
Ba2+ + SO42- = BaSO4↓
非溶液中进行的反应一般不能写离子方程式
注意:
只能用化学方程式表示: H2 + CuO = Cu + H2O
△
三、离子反应和离子方程式
考点02 离子反应
考 点 梳 理
(1)“写”正确写出反应的化学方程式。
(2)“拆” 把易溶于水且易电离的物质(强酸、强碱、和大部分可溶性盐)拆写成离子形式;难溶的物质、气体和水等仍用化学式表示。
(4)“查”检查离子方程两边各元素的原子个数和电荷是否相等
(3)“删” 删去方程式两边不参加反应的离子,并将方程式化简
四、离子方程式的书写
考点02 离子反应
考 点 梳 理
离子方程式的意义
离子方程式不仅可以表示某个具体的化学反应,还可以表示同一类型的离子反应
四、离子方程式的书写
典 例 精 讲
C
考点02 离子反应
典 例 精 讲
D
考点02 离子反应
举 一 反 三
D
考点02 离子反应
典 例 精 讲
C
考点02 离子反应
典 例 精 讲
A
考点02 离子反应
举 一 反 三
D
考点02 离子反应
举 一 反 三
D
考点02 离子反应
典 例 精 讲
B
考点02 离子反应
典 例 精 讲
B
考点02 离子反应
典 例 精 讲
C
考点02 离子反应
举 一 反 三
B
考点02 离子反应
举 一 反 三
D
考点02 离子反应
氧化还原反应
3
考点03 氧化还原反应
考 点 梳 理
一、多角度认识氧化还原反应
氧化反应
还原反应
得到氧
失去氧
化合价升高
化合价降低
失电子(共用电子对偏离)
得电子(共用电子对偏向)
同时发生
得失氧
化合价变化
电子的转移
考点03 氧化还原反应
考 点 梳 理
二、氧化还原反应中电子转移的表示方法
双线桥
先标化合价,再看价变化;
起止同元素,桥上标变化。
考点03 氧化还原反应
考 点 梳 理
二、氧化还原反应中电子转移的表示方法
单线桥
考点03 氧化还原反应
考 点 梳 理
三、氧化剂、还原剂及相关概念
考点03 氧化还原反应
考 点 梳 理
三、氧化剂、还原剂及相关概念
失电子,化合价升高,被氧化,发生氧化反应
氧化剂 + 还原剂 = 还原产物 + 氧化产物
得电子,化合价降低,被还原,发生还原反应
考点03 氧化还原反应
考 点 梳 理
三、氧化剂、还原剂及相关概念
常见的氧化剂 、还原剂
氧化还原反应
氧化剂 还原剂
单质
化合物 氧化物
盐
含氧酸
其他
Na、Fe、 Al、Zn、 S 、 H2、C
MnO2、CO2 、 NO2 、H2O2、Na2O2
CO、SO2
FeCl3、KMnO4 、KClO3 、 NaClO
FeSO4、 Na2SO3 、 KI、Na2S、FeCl2
HClO、HNO3、浓硫酸
H2SO3
HCl
H2S、HCl、NH3
考点03 氧化还原反应
考 点 梳 理
四、氧化性、还原性强弱比较
失去电子的难易程度
化合价降低
化合价升高
比如还原性:Na > Al
氧化性和还原性
考点03 氧化还原反应
考 点 梳 理
四、氧化性、还原性强弱比较
强弱规律——根据根据元素的活动性顺序比较
如:Cl2+2NaBr===2NaCl+Br2
氧化性:Cl2>Br2
在反应中Cl2是_____剂,
Br2是_____产物
如:Fe+CuSO4===FeSO4+Cu
还原性:Fe>Cu
在反应中Fe是_____剂,
Cu是_____产物。
还原
还原
氧化
氧化
考点03 氧化还原反应
考 点 梳 理
四、氧化性、还原性强弱比较
强弱规律——根据氧化还原反应方程式比较
氧化剂
还原剂
还原产物
氧化产物
被氧化
被还原
>
>
如:2FeCl3+2HI=2FeCl2+2HCl+I2
氧化性:FeCl3 I2
还原性:HI FeCl2
>
>
氧化性:氧化剂 氧化产物
还原性:还原剂 还原产物
考点03 氧化还原反应
考 点 梳 理
四、氧化性、还原性强弱比较
强弱规律——根据反应进行的难易程度(反应条件)来判断
当不同氧化剂分别与同一还原剂反应时,如果氧化产物价态相同,可根据反应的难易来判断,反应越容易,该氧化剂氧化性就越强
MnO2+4HCl(浓) = MnCl2+Cl2↑+2H2O
2KMnO4+16HCl(浓) = 2KCl+2MnCl2+5Cl2↑+8H2O
△
氧化性: KMnO4> MnO2
考点03 氧化还原反应
考 点 梳 理
四、氧化性、还原性强弱比较
强弱规律——根据元素被氧化/还原的程度来判断
某还原剂被不同氧化剂氧化时,元素化合价升得越高,说明氧化剂的氧化性越强。
2Fe + 3Cl2 2FeCl3 Fe + S FeS
氧化性:_______
Cu + 2Fe3+ ==== Cu2+ + 2Fe2+ 3Zn + 2Fe3+ ==== 3Zn2+ + 2Fe
还原性:__________
点燃
Cl2 > S
Zn > Cu
△
考点03 氧化还原反应
考 点 梳 理
四、氧化性、还原性强弱比较
强弱规律——根据元素的化合价进行判断
元素处于中间价态,则既有氧化性又有还原性
元素处于低价态具有还原性,最低价态,则只具有还原性
元素处于高价态具有氧化性,最高价态,则只具有氧化性
典 例 精 讲
C
考点03 氧化还原反应
典 例 精 讲
D
考点03 氧化还原反应
举 一 反 三
A
考点03 氧化还原反应
典 例 精 讲
考点03 氧化还原反应
NaClO
Fe
Cl-
举 一 反 三
考点03 氧化还原反应
典 例 精 讲
C
考点03 氧化还原反应
举 一 反 三
C
考点03 氧化还原反应
典 例 精 讲
B
考点03 氧化还原反应
举 一 反 三
D
考点03 氧化还原反应
