鲁科版高中化学选择性必修2第1章原子结构与元素性质1.2.1基态原子的核外电子排布教学课件
文档属性
| 名称 | 鲁科版高中化学选择性必修2第1章原子结构与元素性质1.2.1基态原子的核外电子排布教学课件 |

|
|
| 格式 | ppt | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-11 19:50:01 | ||
图片预览











文档简介
(共40张PPT)
第1课时 基态原子的核外电子排布
1.理解能量最低原理、泡利不相容原理、洪特规则。能用以上原理或规则解释l~36号元素基态原子的核外电子排布,培养宏观辨识与微观探析的化学核心素养。
2.根据基态原子的核外电子排布规律,会书写l~36号元素基态原子的核外电子排布式,形成证据推理与模型认知的化学核心素养。
知识铺垫
必备知识
正误判断
1.核外电子排布规律
(1)“一低”——电子首先排布在能量最低的电子层里。排满能量低的电子层,再排能量高的电子层。
知识铺垫
必备知识
正误判断
2.核外电子排布的表示方法
(1)原子结构示意图,如钠原子的结构示意图如下:
(2)离子结构示意图:
如Mg2+:
知识铺垫
必备知识
正误判断
1.基态原子的核外电子排布原则
知识铺垫
必备知识
正误判断
【微思考】某同学写出了下列几种基态原子的价电子轨道表示式:
请分析以上3个价电子轨道表示式是否正确,若不正确说出违背了什么原理,并写出正确的价电子轨道表示式。
知识铺垫
必备知识
正误判断
提示:(1)不正确。违背了能量最低原理,其正确的价电子轨道表示式为 。
(2)不正确。违背了泡利不相容原理,其正确的价电子轨道表示式为 。
(3)不正确。违背了洪特规则,其正确的价电子轨道表示式为 。
知识铺垫
必备知识
正误判断
2.核外电子排布的表示方法
(1)电子排布式。
①在ns、np、nd等各能级符号的右上角用数字表示出该能级中的电子数目的式子就是电子排布式。如钾原子的电子排布式可表示如下:
②电子排布式中的内层电子排布可用相应的稀有气体的元素符号加方括号的形式来表示,以简化电子排布式。例如基态钾原子的电子排布式还可表示为[Ar]4s1。
知识铺垫
必备知识
正误判断
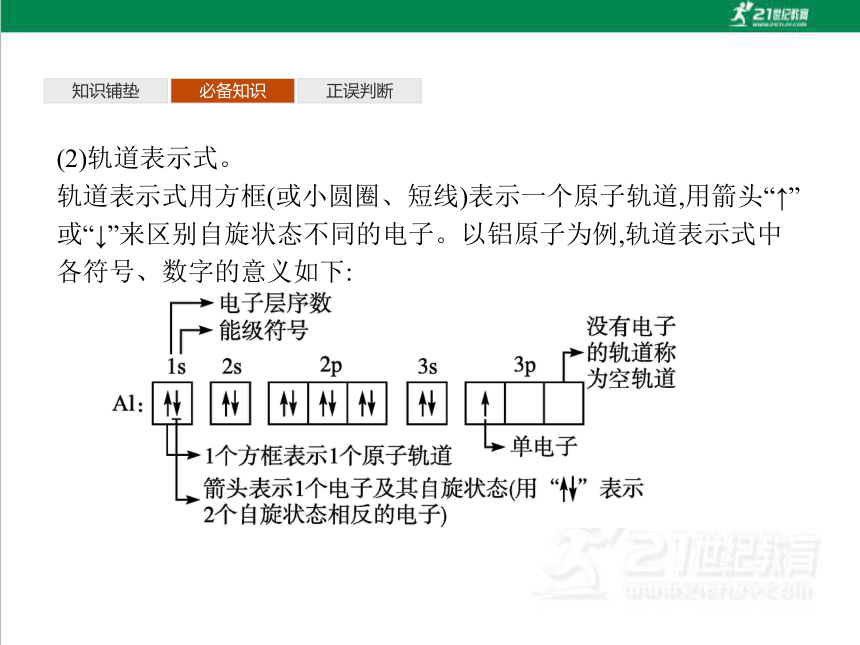
(2)轨道表示式。
轨道表示式用方框(或小圆圈、短线)表示一个原子轨道,用箭头“↑”或“↓”来区别自旋状态不同的电子。以铝原子为例,轨道表示式中各符号、数字的意义如下:
知识铺垫
必备知识
正误判断
(3)价电子排布式。
①价电子为与元素化学性质密切相关的外层原子轨道上的电子。
②为了便于研究化学性质与核外电子的关系,人们常常只表示出原子的价电子排布式。如铁原子的价电子排布式为3d64s2。
③对于主族元素来说,价电子就是最外层电子。而对于副族和Ⅷ族元素来说,价电子不仅包括最外层电子,还可能包括次外层d轨道的电子,有的还包括倒数第三层f轨道的电子。
知识铺垫
必备知识
正误判断
判断下列说法是否正确,正确的打“√”,错误的打“×”。
1.原子核外电子填充3p、3d、4s能级的顺序为3p→4s→3d。( )
2.某基态原子部分核外电子的排布式为3d64s2。( )
3.所有基态原子的核外电子排布都遵循构造原理。( )
4.构造原理中的电子排布能级顺序,实质是各能级能量由低到高的顺序。( )
5.基态碳原子的电子排布式为1s22s12p3。( )
6.把15P原子的电子排布式写成了1s22s22p63s23 ,违背了泡利不相容原理。( )
答案:1.√ 2.√ 3.× 4.√ 5.× 6.×
探究1
探究2
素养脉络
随堂检测
核外电子排布原则
问题探究
1.基态原子核外电子在原子轨道上是先排3d轨道还是先排4s轨道
提示:根据构造原理可知,电子在基态原子核外排布时,先排4s轨道再排3d轨道。
2.n值小的能级的轨道的能量一定小于n值大的能级的轨道的能量吗
提示:不一定。例如:①能级符号相同时,电子层序数越大,原子轨道能量越高,如E3p>E2p。 ②电子层序数相同时,能级越高,原子轨道能量越高,如E3d>E3p>E3s。③电子层序数、能级不同时,核外电子在外层分布时存在原子轨道能量交错现象,如E4s探究1
探究2
素养脉络
随堂检测
深化拓展
1.能量最低原理
电子尽量先占有能量最低的轨道,然后进入能量高的轨道,使整个原子的能量处于最低状态。
2.泡利不相容原理
每个原子轨道最多只能容纳2个电子且自旋状态相反。由此可知,从电子层、能级、原子轨道、自旋状态四个方面来说明电子的运动状态是不可能有两个完全相同的电子的。如氟原子的电子排布可表示为1s22s22 ,由于各原子轨道中的电子自旋状态相反,所以9个电子的运动状态都不相同。
探究1
探究2
素养脉络
随堂检测
3.洪特规则的特例
在同一能级上的电子排布处于全充满(如p6、d10、f14)、半充满(如p3、d5、f7)和全空(如p0、d0、f0)状态时,具有较低的能量和较大的稳定性,这称为洪特规则的特例。如24Cr的核外电子排布式为1s22s22p63s23p63d54s1,而不能写成1s22s22p63s23p63d44s2;29Cu的核外电子排布式为1s22s22p63s23p63d104s1,而不能写成1s22s22p63s23p63d94s2。
探究1
探究2
素养脉络
随堂检测
4.构造原理
基态原子核外电子在原子轨道上的排布顺序:
构造原理表明,随着原子序数的递增,基态原子核外电子排布按照箭头的方向依次排布在各原子轨道上:1s、2s、2p、3s、3p、4s、3d、4p、5s、4d、5p、6s、4f、5d、6p、7s……
探究1
探究2
素养脉络
随堂检测
素能应用
典例1下列说法错误的是( )
A.电子排布式1s22s22p63s23p64s3违反了泡利不相容原理
B.基态原子电子排布式1s22s22p63s23p63d5违反了能量最低原理
C.根据构造原理,原子核外电子填充顺序为1s、2s、2p、3s、3p、3d、4s、4p……
D.钠原子由1s22s22p63s1→1s22s22p63p1时,原子吸收能量,由基态转化成激发态
探究1
探究2
素养脉络
随堂检测
答案:C
解析:根据泡利不相容原理可知,4s轨道最多排2个电子,故A正确;因为4s轨道能量比3d轨道能量还低,所以基态原子电子排布式1s22s22p63s23p63d5违反了能量最低原理,正确的电子排布式应该为1s22s22p63s23p63d34s2,故B正确;根据构造原理可知,原子核外电子填充顺序为1s、2s、2p、3s、3p、4s、3d、4p、5s、4d、5p、6s、4f、5d、6p、7s、……故C错误;钠原子核外电子排布由1s22s22p63s1→1s22s22p63p1时,电子从基态跃迁到激发态,要吸收能量,故D正确。
探究1
探究2
素养脉络
随堂检测
易错警示 依据构造原理可知,各能级的能量顺序为np<(n+1)s探究1
探究2
素养脉络
随堂检测
变式训练1-1(双选)某原子的最外层电子排布为3s23p2,下列对其核外电子运动状态的说法错误的是( )
A.有4种不同的伸展方向
B.有4种不同能量的电子
C.有5个原子轨道排布了电子
D.有14种不同运动状态的电子
探究1
探究2
素养脉络
随堂检测
答案:BC
解析:由题给信息可知,该原子的核外电子排布式为1s22s22p63s23p2,共有14个电子,为硅原子,共有2种类型的轨道,s轨道为球形,只有1种伸展方向,p轨道有3种伸展方向,则共有4种不同的伸展方向,A正确;电子排布式为1s22s22p63s23p2,有5种不同能量的电子,B错误;电子排布式为1s22s22p63s23p2,则核外有8个原子轨道排布了电子,C错误;硅原子核外有14个电子,故有14种不同运动状态的电子,D正确。
探究1
探究2
素养脉络
随堂检测
变式训练1-2(1)下列基态原子或离子的电子排布的表示方法中,正确的是 ,违反了能量最低原理的是 ,违反洪特规则的是 。
①Ca2+:1s22s22p63s23p6
②F-:1s22s23p6
④Cr:1s22s22p63s23p63d44s2
⑤Fe:1s22s22p63s23p63d64s2
⑥Mg2+:1s22s22p6
探究1
探究2
素养脉络
随堂检测
(2)绿柱石被国际珠宝界公认为四大名贵宝石之一,其主要成分为Be3Al2(Si6O18),因含适量的Cr2O3(0.15%~0.6%)而形成祖母绿。基态Al原子中,电子填充的最高能级是 ,基态Cr原子的价电子排布式是 。
探究1
探究2
素养脉络
随堂检测
答案:(1)①⑤⑥ ② ③④⑦
(2)3p 3d54s1
解析:(1)①正确;②违反了能量最低原理;③违反了洪特规则;④违反了洪特规则;⑤正确;⑥正确;⑦违反了洪特规则。
(2)Al为13号元素,其基态原子的电子排布式为1s22s22p63s23p1,最高能级为3p,根据核外电子排布规律可以写出基态铬原子电子排布式为1s22s22p63s23p63d54s1,所以基态铬(Cr)原子的价电子排布式是3d54s1。
探究1
探究2
素养脉络
随堂检测
原子核外电子排布的表示方法
问题探究
1.书写电子排布式时,是按电子排布顺序书写吗
提示:书写电子排布式时,不是按电子排布顺序书写,而是按电子层顺序,同一电子层的各能级连在一起。如Fe原子的电子排布式为1s22s22p63s23p63d64s2,而不是1s22s22p63s23p64s23d6。
2.价电子就是最外层电子吗
提示:不一定。价电子是指决定元素化学性质的电子,最外层电子一定属于价电子,但有的内层电子也是价电子,如铁原子3d轨道上的6个电子也属于价电子。
探究1
探究2
素养脉络
随堂检测
深化拓展
原子结构
示意图 含义 将每个电子层上的电子总数表示在原子核外的式子
意义 能直观反映核内的质子数和核外的电子层数及各电子层上的电子数
实例
电子
排布式 含义 用数字在能级符号右上角标明该能级上排布的电子数的式子
意义 能直观地反映核外电子的电子层、能级和各能级上的电子数
实例 K:1s22s22p63s23p64s1
简化电子
排布式 含义 把电子排布式中内层电子达到稀有气体结构的部分以相应稀有气体的元素符号外加方括号表示
意义 避免电子排布式书写过于复杂
实例 K:[Ar]4s1
探究1
探究2
素养脉络
随堂检测
价电子排布式 含义 主族元素的价层电子指最外层电子,价层电子排布式即外围电子排布式
意义 能直观地反映元素的性质
实例 Al:3s23p1
轨道
表示式 含义 每个原子轨道用1个方框(或小圆圈、短线)表示,在圆圈内用箭头标明核外电子的分布
意义 直观地反映电子的分布情况
实例
探究1
探究2
素养脉络
随堂检测
素能应用
典例2 (双选)下列微粒的核外电子的表示方法中正确的是( )
A.碳原子轨道表示式
B.磷原子价电子轨道表示式
C.铬原子的价电子排布式3d54s1
D.Fe2+价电子排布式3d44s2
探究1
探究2
素养脉络
随堂检测
答案:AC
解析:碳是6号元素,6个电子分别排在1s、2s、2p轨道上,碳原子轨道表示式为 ,故A正确;磷原子3p能级上三个电子自旋状态相同,磷原子价电子轨道表示式为 ,故B错误;铬原子的价电子排布式3d54s1,均处于半充满状态,故C正确;铁原子失去4s能级上两个电子形成Fe2+,Fe2+的价电子排布式为3d6,故D错误。
探究1
探究2
素养脉络
随堂检测
易错警示 (1)基态原子电子排布式的书写方法。
第一步:按照构造原理写出电子填入能级的顺序:1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→6s→……
第二步:根据各能级容纳的电子数填充电子。
第三步:去掉空能级,并按照电子层顺序排列即可得到电子排布式。
(2)离子的电子排布式。
①判断该原子变成离子时会得到或失去的电子数。
②原子失去电子时,总是先失去能级较高的轨道上的电子,即失去电子的顺序是由外向里。一般来说,主族元素只失去它们的最外层电子,而副族和Ⅷ族元素可能还会进一步失去内层电子。
③原子得到电子而形成阴离子,则得到的电子填充在最外一个电子层的某一个能级上。
探究1
探究2
素养脉络
随堂检测
变式训练2-1 2008年北京奥运会主体育场“鸟巢”被《泰晤士报》评为全球“最强悍”工程。“鸟巢”运用了高强度、高性能的钒氮合金高新钢,钒元素的原子序数为23,则钒原子的价电子排布式正确的是( )
A.3s23p6 B.3d34s2 C.3d64s2 D.4s2
答案:B
解析:钒元素的原子序数为23,可根据电子排布规律写出钒原子的电子排布式为1s22s22p63s23p63d34s2,其价电子排布式为3d34s2。
探究1
探究2
素养脉络
随堂检测
变式训练2-2(双选)下列各组表述中,两个微粒一定不属于同种元素原子的是( )
A.3p能级有一个未成对电子的基态原子和核外电子排布为1s22s22p63s23p1的原子
B.M层全充满而N层为4s2的原子和核外电子排布为1s22s22p63s23p64s2的原子
C.最外层电子数是核外电子总数的 的原子和价电子排布为3s23p5的原子
D.2p能级有一个空轨道的基态原子和原子的价电子排布为2s22p2的原子
探究1
探究2
素养脉络
随堂检测
答案:BC
解析:对于3p能级有一个未成对电子的基态原子,该原子3p能级应有1个或5个电子,核外电子排布式为1s22s22p63s23p1或1s22s22p63s23p5,故A不符合题意;M层全充满而N层为4s2的原子的核外电子排布式为1s22s22p63s23p63d104s2,与核外电子排布为1s22s22p63s23p64s2的原子不表示同一原子,故B符合题意;最外层电子数是核外电子总数 的原子,若最外层电子数为1,则核外电子总数为3,电子排布为1s22s1,价电子排布为2s1,与价电子排布为3s23p5的原子不属于同种元素的原子;若最外层电子数为5,则核外电子总数为15,价电子排布为3s23p3,与价电子排布为3s23p5的原子不属于同种元素的原子,故C符合题意;2p能级有一个空轨道的基态原子,该原子2p能级有2个电子,价电子排布为2s22p2,与价电子排布为2s22p2的原子为同种原子,故D不符合题意。
探究1
探究2
素养脉络
随堂检测
探究1
探究2
素养脉络
随堂检测
1.下列各原子或离子的电子排布式错误的是( )
A.Mg2+ 1s22s22p6
B.Br 1s22s22p63s23p63d104s24p5
C.O2- 1s22s22p6
D.Cr 1s22s22p63s23p63d44s2
答案:D
解析:Mg2+的电子排布式为1s22s22p6,符合能量最低原理,故A正确;Br的电子排布式为1s22s22p63s23p63d104s24p5,符合能量最低原理,故B正确;O2-的电子排布式为1s22s22p6,符合能量最低原理,故C正确;Cr原子的电子排布式为1s22s22p63s23p63d54s1,故D错误。
探究1
探究2
素养脉络
随堂检测
2.下列轨道表示式能表示氮原子的最低能量状态的是( )
答案:A
解析:A项符合基态原子电子排布的能量最低原理、洪特规则,正确;B项2p轨道上的3个电子的自旋状态不完全相同,不符合洪特规则,错误;C项2p轨道上的3个电子应分别占据1个轨道,不符合洪特规则,错误;D项不是氮原子的轨道表示式,D错误。
探究1
探究2
素养脉络
随堂检测
3.构造原理揭示的电子排布能级顺序,实质是各能级能量的高低顺序。若以E表示某能级的能量,下列能级能量大小顺序中正确的是
( )
A.E(4f)>E(4s)>E(3d) B.E(3s)>E(2s)>E(1s)
C.E(3s)>E(3p)>E(3d) D.E(5s)>E(4s)>E(4f)
答案:B
解析:根据构造原理可判断,A错误,正确的应该是E(4f)>E(3d)>E(4s)。C错误,正确的应该是E(3s)E(5s)>E(4s)。
探究1
探究2
素养脉络
随堂检测
4.下列有关化学用语表示正确的是( )
A.K+的结构示意图:
D.基态铬原子(24Cr)的价电子排布式:3d44s2
探究1
探究2
素养脉络
随堂检测
答案:B
解析:K+的结构示意图为 ,A错误;根据核外电子排布规律可知基态氮原子的轨道表示式为 ,
B正确;水是共价化合物,含有共价键,水分子的电子式为 H,C错误;基态铬原子(24Cr)的价电子排布式为3d54s1,D错误。
探究1
探究2
素养脉络
随堂检测
5.回答下列问题:
(1)基态Co原子核外电子排布式为 ;
(2)基态Ge原子的核外电子排布式为 ;
(3)Zn2+的价电子轨道表示式为 ;
(4)Co3+核外未成对电子数为 。
答案:(1)1s22s22p63s23p63d74s2
(2)1s22s22p63s23p63d104s24p2
(3) (4)4
探究1
探究2
素养脉络
随堂检测
解析:(1)Co是27号元素,核外有27个电子,根据能量最低原理,其核外电子排布式为1s22s22p63s23p63d74s2。
(2)Ge是32号元素,基态Ge原子的核外电子排布式为1s22s22p63s23p63d104s24p2。
(3)Zn是30号元素,Zn原子价电子排布式是3d104s2,Zn2+的价电子排布式是3d10,Zn2+价电子轨道表示式为 。
(4)Co3+核外电子排布式是1s22s22p63s23p63d6,Co3+的价电子轨道表示式是 ,则Co3+核外未成对电子数为4。
第1课时 基态原子的核外电子排布
1.理解能量最低原理、泡利不相容原理、洪特规则。能用以上原理或规则解释l~36号元素基态原子的核外电子排布,培养宏观辨识与微观探析的化学核心素养。
2.根据基态原子的核外电子排布规律,会书写l~36号元素基态原子的核外电子排布式,形成证据推理与模型认知的化学核心素养。
知识铺垫
必备知识
正误判断
1.核外电子排布规律
(1)“一低”——电子首先排布在能量最低的电子层里。排满能量低的电子层,再排能量高的电子层。
知识铺垫
必备知识
正误判断
2.核外电子排布的表示方法
(1)原子结构示意图,如钠原子的结构示意图如下:
(2)离子结构示意图:
如Mg2+:
知识铺垫
必备知识
正误判断
1.基态原子的核外电子排布原则
知识铺垫
必备知识
正误判断
【微思考】某同学写出了下列几种基态原子的价电子轨道表示式:
请分析以上3个价电子轨道表示式是否正确,若不正确说出违背了什么原理,并写出正确的价电子轨道表示式。
知识铺垫
必备知识
正误判断
提示:(1)不正确。违背了能量最低原理,其正确的价电子轨道表示式为 。
(2)不正确。违背了泡利不相容原理,其正确的价电子轨道表示式为 。
(3)不正确。违背了洪特规则,其正确的价电子轨道表示式为 。
知识铺垫
必备知识
正误判断
2.核外电子排布的表示方法
(1)电子排布式。
①在ns、np、nd等各能级符号的右上角用数字表示出该能级中的电子数目的式子就是电子排布式。如钾原子的电子排布式可表示如下:
②电子排布式中的内层电子排布可用相应的稀有气体的元素符号加方括号的形式来表示,以简化电子排布式。例如基态钾原子的电子排布式还可表示为[Ar]4s1。
知识铺垫
必备知识
正误判断
(2)轨道表示式。
轨道表示式用方框(或小圆圈、短线)表示一个原子轨道,用箭头“↑”或“↓”来区别自旋状态不同的电子。以铝原子为例,轨道表示式中各符号、数字的意义如下:
知识铺垫
必备知识
正误判断
(3)价电子排布式。
①价电子为与元素化学性质密切相关的外层原子轨道上的电子。
②为了便于研究化学性质与核外电子的关系,人们常常只表示出原子的价电子排布式。如铁原子的价电子排布式为3d64s2。
③对于主族元素来说,价电子就是最外层电子。而对于副族和Ⅷ族元素来说,价电子不仅包括最外层电子,还可能包括次外层d轨道的电子,有的还包括倒数第三层f轨道的电子。
知识铺垫
必备知识
正误判断
判断下列说法是否正确,正确的打“√”,错误的打“×”。
1.原子核外电子填充3p、3d、4s能级的顺序为3p→4s→3d。( )
2.某基态原子部分核外电子的排布式为3d64s2。( )
3.所有基态原子的核外电子排布都遵循构造原理。( )
4.构造原理中的电子排布能级顺序,实质是各能级能量由低到高的顺序。( )
5.基态碳原子的电子排布式为1s22s12p3。( )
6.把15P原子的电子排布式写成了1s22s22p63s23 ,违背了泡利不相容原理。( )
答案:1.√ 2.√ 3.× 4.√ 5.× 6.×
探究1
探究2
素养脉络
随堂检测
核外电子排布原则
问题探究
1.基态原子核外电子在原子轨道上是先排3d轨道还是先排4s轨道
提示:根据构造原理可知,电子在基态原子核外排布时,先排4s轨道再排3d轨道。
2.n值小的能级的轨道的能量一定小于n值大的能级的轨道的能量吗
提示:不一定。例如:①能级符号相同时,电子层序数越大,原子轨道能量越高,如E3p>E2p。 ②电子层序数相同时,能级越高,原子轨道能量越高,如E3d>E3p>E3s。③电子层序数、能级不同时,核外电子在外层分布时存在原子轨道能量交错现象,如E4s
探究2
素养脉络
随堂检测
深化拓展
1.能量最低原理
电子尽量先占有能量最低的轨道,然后进入能量高的轨道,使整个原子的能量处于最低状态。
2.泡利不相容原理
每个原子轨道最多只能容纳2个电子且自旋状态相反。由此可知,从电子层、能级、原子轨道、自旋状态四个方面来说明电子的运动状态是不可能有两个完全相同的电子的。如氟原子的电子排布可表示为1s22s22 ,由于各原子轨道中的电子自旋状态相反,所以9个电子的运动状态都不相同。
探究1
探究2
素养脉络
随堂检测
3.洪特规则的特例
在同一能级上的电子排布处于全充满(如p6、d10、f14)、半充满(如p3、d5、f7)和全空(如p0、d0、f0)状态时,具有较低的能量和较大的稳定性,这称为洪特规则的特例。如24Cr的核外电子排布式为1s22s22p63s23p63d54s1,而不能写成1s22s22p63s23p63d44s2;29Cu的核外电子排布式为1s22s22p63s23p63d104s1,而不能写成1s22s22p63s23p63d94s2。
探究1
探究2
素养脉络
随堂检测
4.构造原理
基态原子核外电子在原子轨道上的排布顺序:
构造原理表明,随着原子序数的递增,基态原子核外电子排布按照箭头的方向依次排布在各原子轨道上:1s、2s、2p、3s、3p、4s、3d、4p、5s、4d、5p、6s、4f、5d、6p、7s……
探究1
探究2
素养脉络
随堂检测
素能应用
典例1下列说法错误的是( )
A.电子排布式1s22s22p63s23p64s3违反了泡利不相容原理
B.基态原子电子排布式1s22s22p63s23p63d5违反了能量最低原理
C.根据构造原理,原子核外电子填充顺序为1s、2s、2p、3s、3p、3d、4s、4p……
D.钠原子由1s22s22p63s1→1s22s22p63p1时,原子吸收能量,由基态转化成激发态
探究1
探究2
素养脉络
随堂检测
答案:C
解析:根据泡利不相容原理可知,4s轨道最多排2个电子,故A正确;因为4s轨道能量比3d轨道能量还低,所以基态原子电子排布式1s22s22p63s23p63d5违反了能量最低原理,正确的电子排布式应该为1s22s22p63s23p63d34s2,故B正确;根据构造原理可知,原子核外电子填充顺序为1s、2s、2p、3s、3p、4s、3d、4p、5s、4d、5p、6s、4f、5d、6p、7s、……故C错误;钠原子核外电子排布由1s22s22p63s1→1s22s22p63p1时,电子从基态跃迁到激发态,要吸收能量,故D正确。
探究1
探究2
素养脉络
随堂检测
易错警示 依据构造原理可知,各能级的能量顺序为np<(n+1)s
探究2
素养脉络
随堂检测
变式训练1-1(双选)某原子的最外层电子排布为3s23p2,下列对其核外电子运动状态的说法错误的是( )
A.有4种不同的伸展方向
B.有4种不同能量的电子
C.有5个原子轨道排布了电子
D.有14种不同运动状态的电子
探究1
探究2
素养脉络
随堂检测
答案:BC
解析:由题给信息可知,该原子的核外电子排布式为1s22s22p63s23p2,共有14个电子,为硅原子,共有2种类型的轨道,s轨道为球形,只有1种伸展方向,p轨道有3种伸展方向,则共有4种不同的伸展方向,A正确;电子排布式为1s22s22p63s23p2,有5种不同能量的电子,B错误;电子排布式为1s22s22p63s23p2,则核外有8个原子轨道排布了电子,C错误;硅原子核外有14个电子,故有14种不同运动状态的电子,D正确。
探究1
探究2
素养脉络
随堂检测
变式训练1-2(1)下列基态原子或离子的电子排布的表示方法中,正确的是 ,违反了能量最低原理的是 ,违反洪特规则的是 。
①Ca2+:1s22s22p63s23p6
②F-:1s22s23p6
④Cr:1s22s22p63s23p63d44s2
⑤Fe:1s22s22p63s23p63d64s2
⑥Mg2+:1s22s22p6
探究1
探究2
素养脉络
随堂检测
(2)绿柱石被国际珠宝界公认为四大名贵宝石之一,其主要成分为Be3Al2(Si6O18),因含适量的Cr2O3(0.15%~0.6%)而形成祖母绿。基态Al原子中,电子填充的最高能级是 ,基态Cr原子的价电子排布式是 。
探究1
探究2
素养脉络
随堂检测
答案:(1)①⑤⑥ ② ③④⑦
(2)3p 3d54s1
解析:(1)①正确;②违反了能量最低原理;③违反了洪特规则;④违反了洪特规则;⑤正确;⑥正确;⑦违反了洪特规则。
(2)Al为13号元素,其基态原子的电子排布式为1s22s22p63s23p1,最高能级为3p,根据核外电子排布规律可以写出基态铬原子电子排布式为1s22s22p63s23p63d54s1,所以基态铬(Cr)原子的价电子排布式是3d54s1。
探究1
探究2
素养脉络
随堂检测
原子核外电子排布的表示方法
问题探究
1.书写电子排布式时,是按电子排布顺序书写吗
提示:书写电子排布式时,不是按电子排布顺序书写,而是按电子层顺序,同一电子层的各能级连在一起。如Fe原子的电子排布式为1s22s22p63s23p63d64s2,而不是1s22s22p63s23p64s23d6。
2.价电子就是最外层电子吗
提示:不一定。价电子是指决定元素化学性质的电子,最外层电子一定属于价电子,但有的内层电子也是价电子,如铁原子3d轨道上的6个电子也属于价电子。
探究1
探究2
素养脉络
随堂检测
深化拓展
原子结构
示意图 含义 将每个电子层上的电子总数表示在原子核外的式子
意义 能直观反映核内的质子数和核外的电子层数及各电子层上的电子数
实例
电子
排布式 含义 用数字在能级符号右上角标明该能级上排布的电子数的式子
意义 能直观地反映核外电子的电子层、能级和各能级上的电子数
实例 K:1s22s22p63s23p64s1
简化电子
排布式 含义 把电子排布式中内层电子达到稀有气体结构的部分以相应稀有气体的元素符号外加方括号表示
意义 避免电子排布式书写过于复杂
实例 K:[Ar]4s1
探究1
探究2
素养脉络
随堂检测
价电子排布式 含义 主族元素的价层电子指最外层电子,价层电子排布式即外围电子排布式
意义 能直观地反映元素的性质
实例 Al:3s23p1
轨道
表示式 含义 每个原子轨道用1个方框(或小圆圈、短线)表示,在圆圈内用箭头标明核外电子的分布
意义 直观地反映电子的分布情况
实例
探究1
探究2
素养脉络
随堂检测
素能应用
典例2 (双选)下列微粒的核外电子的表示方法中正确的是( )
A.碳原子轨道表示式
B.磷原子价电子轨道表示式
C.铬原子的价电子排布式3d54s1
D.Fe2+价电子排布式3d44s2
探究1
探究2
素养脉络
随堂检测
答案:AC
解析:碳是6号元素,6个电子分别排在1s、2s、2p轨道上,碳原子轨道表示式为 ,故A正确;磷原子3p能级上三个电子自旋状态相同,磷原子价电子轨道表示式为 ,故B错误;铬原子的价电子排布式3d54s1,均处于半充满状态,故C正确;铁原子失去4s能级上两个电子形成Fe2+,Fe2+的价电子排布式为3d6,故D错误。
探究1
探究2
素养脉络
随堂检测
易错警示 (1)基态原子电子排布式的书写方法。
第一步:按照构造原理写出电子填入能级的顺序:1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→6s→……
第二步:根据各能级容纳的电子数填充电子。
第三步:去掉空能级,并按照电子层顺序排列即可得到电子排布式。
(2)离子的电子排布式。
①判断该原子变成离子时会得到或失去的电子数。
②原子失去电子时,总是先失去能级较高的轨道上的电子,即失去电子的顺序是由外向里。一般来说,主族元素只失去它们的最外层电子,而副族和Ⅷ族元素可能还会进一步失去内层电子。
③原子得到电子而形成阴离子,则得到的电子填充在最外一个电子层的某一个能级上。
探究1
探究2
素养脉络
随堂检测
变式训练2-1 2008年北京奥运会主体育场“鸟巢”被《泰晤士报》评为全球“最强悍”工程。“鸟巢”运用了高强度、高性能的钒氮合金高新钢,钒元素的原子序数为23,则钒原子的价电子排布式正确的是( )
A.3s23p6 B.3d34s2 C.3d64s2 D.4s2
答案:B
解析:钒元素的原子序数为23,可根据电子排布规律写出钒原子的电子排布式为1s22s22p63s23p63d34s2,其价电子排布式为3d34s2。
探究1
探究2
素养脉络
随堂检测
变式训练2-2(双选)下列各组表述中,两个微粒一定不属于同种元素原子的是( )
A.3p能级有一个未成对电子的基态原子和核外电子排布为1s22s22p63s23p1的原子
B.M层全充满而N层为4s2的原子和核外电子排布为1s22s22p63s23p64s2的原子
C.最外层电子数是核外电子总数的 的原子和价电子排布为3s23p5的原子
D.2p能级有一个空轨道的基态原子和原子的价电子排布为2s22p2的原子
探究1
探究2
素养脉络
随堂检测
答案:BC
解析:对于3p能级有一个未成对电子的基态原子,该原子3p能级应有1个或5个电子,核外电子排布式为1s22s22p63s23p1或1s22s22p63s23p5,故A不符合题意;M层全充满而N层为4s2的原子的核外电子排布式为1s22s22p63s23p63d104s2,与核外电子排布为1s22s22p63s23p64s2的原子不表示同一原子,故B符合题意;最外层电子数是核外电子总数 的原子,若最外层电子数为1,则核外电子总数为3,电子排布为1s22s1,价电子排布为2s1,与价电子排布为3s23p5的原子不属于同种元素的原子;若最外层电子数为5,则核外电子总数为15,价电子排布为3s23p3,与价电子排布为3s23p5的原子不属于同种元素的原子,故C符合题意;2p能级有一个空轨道的基态原子,该原子2p能级有2个电子,价电子排布为2s22p2,与价电子排布为2s22p2的原子为同种原子,故D不符合题意。
探究1
探究2
素养脉络
随堂检测
探究1
探究2
素养脉络
随堂检测
1.下列各原子或离子的电子排布式错误的是( )
A.Mg2+ 1s22s22p6
B.Br 1s22s22p63s23p63d104s24p5
C.O2- 1s22s22p6
D.Cr 1s22s22p63s23p63d44s2
答案:D
解析:Mg2+的电子排布式为1s22s22p6,符合能量最低原理,故A正确;Br的电子排布式为1s22s22p63s23p63d104s24p5,符合能量最低原理,故B正确;O2-的电子排布式为1s22s22p6,符合能量最低原理,故C正确;Cr原子的电子排布式为1s22s22p63s23p63d54s1,故D错误。
探究1
探究2
素养脉络
随堂检测
2.下列轨道表示式能表示氮原子的最低能量状态的是( )
答案:A
解析:A项符合基态原子电子排布的能量最低原理、洪特规则,正确;B项2p轨道上的3个电子的自旋状态不完全相同,不符合洪特规则,错误;C项2p轨道上的3个电子应分别占据1个轨道,不符合洪特规则,错误;D项不是氮原子的轨道表示式,D错误。
探究1
探究2
素养脉络
随堂检测
3.构造原理揭示的电子排布能级顺序,实质是各能级能量的高低顺序。若以E表示某能级的能量,下列能级能量大小顺序中正确的是
( )
A.E(4f)>E(4s)>E(3d) B.E(3s)>E(2s)>E(1s)
C.E(3s)>E(3p)>E(3d) D.E(5s)>E(4s)>E(4f)
答案:B
解析:根据构造原理可判断,A错误,正确的应该是E(4f)>E(3d)>E(4s)。C错误,正确的应该是E(3s)
探究1
探究2
素养脉络
随堂检测
4.下列有关化学用语表示正确的是( )
A.K+的结构示意图:
D.基态铬原子(24Cr)的价电子排布式:3d44s2
探究1
探究2
素养脉络
随堂检测
答案:B
解析:K+的结构示意图为 ,A错误;根据核外电子排布规律可知基态氮原子的轨道表示式为 ,
B正确;水是共价化合物,含有共价键,水分子的电子式为 H,C错误;基态铬原子(24Cr)的价电子排布式为3d54s1,D错误。
探究1
探究2
素养脉络
随堂检测
5.回答下列问题:
(1)基态Co原子核外电子排布式为 ;
(2)基态Ge原子的核外电子排布式为 ;
(3)Zn2+的价电子轨道表示式为 ;
(4)Co3+核外未成对电子数为 。
答案:(1)1s22s22p63s23p63d74s2
(2)1s22s22p63s23p63d104s24p2
(3) (4)4
探究1
探究2
素养脉络
随堂检测
解析:(1)Co是27号元素,核外有27个电子,根据能量最低原理,其核外电子排布式为1s22s22p63s23p63d74s2。
(2)Ge是32号元素,基态Ge原子的核外电子排布式为1s22s22p63s23p63d104s24p2。
(3)Zn是30号元素,Zn原子价电子排布式是3d104s2,Zn2+的价电子排布式是3d10,Zn2+价电子轨道表示式为 。
(4)Co3+核外电子排布式是1s22s22p63s23p63d6,Co3+的价电子轨道表示式是 ,则Co3+核外未成对电子数为4。
