鲁科版高中化学选择性必修2第2章微粒间相互作用与物质性质2.2.2价电子对互斥模型教学课件
文档属性
| 名称 | 鲁科版高中化学选择性必修2第2章微粒间相互作用与物质性质2.2.2价电子对互斥模型教学课件 |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-11 00:00:00 | ||
图片预览









文档简介
(共41张PPT)
第2课时 价电子对互斥理论
1.理解价电子对互斥理论和等电子原理,能根据有关理论、原理判断简单分子或离子的空间结构。培养证据推理与模型认知的化学核心素养。
2.了解等电子理论,能根据物质的微观结构预测物质在特定条件下可能具有的性质和可能发生的变化,形成宏观辨识与微观探析的化学核心素养。
必备知识
正误判断
一、价电子对互斥理论
1.价电子对互斥理论的基本观点
分子中的中心原子的价电子对——成键电子对(bp)和孤电子对(lp)由于相互排斥作用,处于不同的空间取向且尽可能趋向于彼此远离。两个原子间的成键电子不论是单键还是多重键,都看作一个空间取向;一对孤电子对可看作一个空间取向。因此,我们可以先分析分子中的中心原子的价电子对存在几个空间取向,再让这几个空间取向尽量彼此远离,就可以推测出分子的空间结构。
必备知识
正误判断
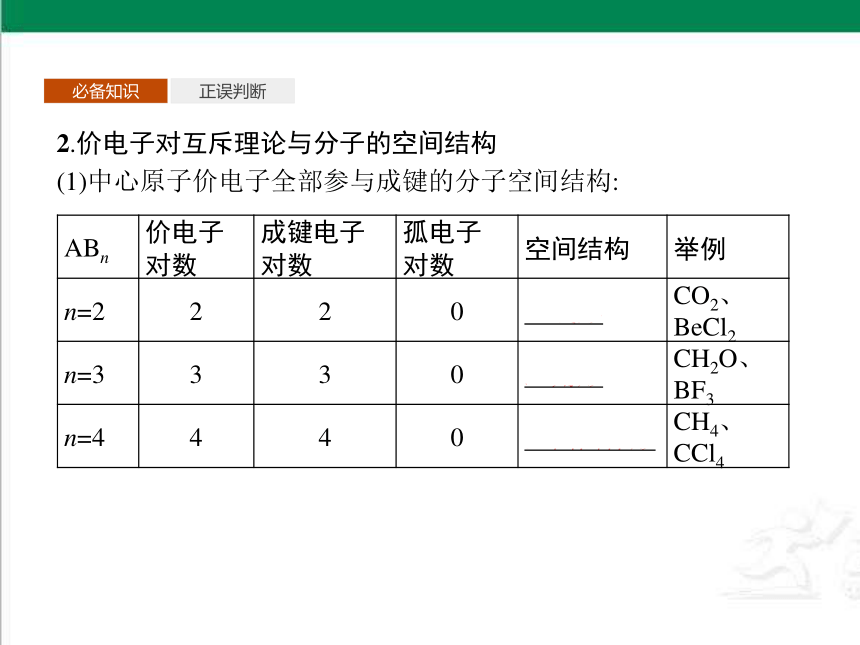
2.价电子对互斥理论与分子的空间结构
(1)中心原子价电子全部参与成键的分子空间结构:
ABn 价电子
对数 成键电子
对数 孤电子
对数 空间结构 举例
n=2 2 2 0 直线形 CO2、BeCl2
n=3 3 3 0 三角形 CH2O、BF3
n=4 4 4 0 正四面体形 CH4、CCl4
必备知识
正误判断
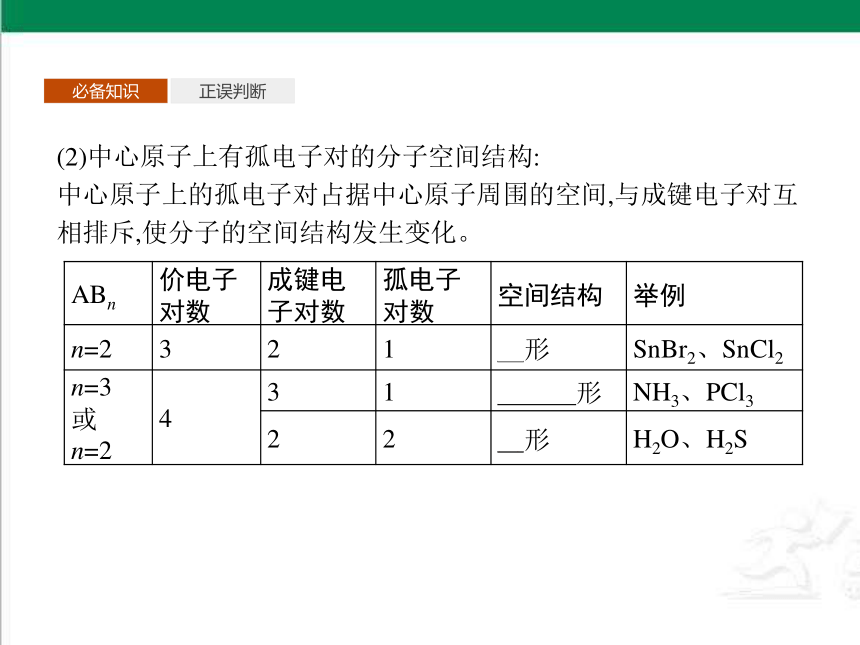
(2)中心原子上有孤电子对的分子空间结构:
中心原子上的孤电子对占据中心原子周围的空间,与成键电子对互相排斥,使分子的空间结构发生变化。
ABn 价电子
对数 成键电
子对数 孤电子
对数 空间结构 举例
n=2 3 2 1 角形 SnBr2、SnCl2
n=3
或
n=2 4 3 1 三角锥形 NH3、PCl3
2 2 角形 H2O、H2S
必备知识
正误判断
3.电子对之间的排斥与分子空间结构
当价电子对包含孤电子对且成键电子对中也有多重键时,由于它们之间的斥力不同,会对分子的空间结构产生影响。通常,多重键、成键电子对与孤电子对的斥力大小顺序可定性地表示为:
三键—三键>三键—双键>双键—双键>双键—单键>单键—单键
lp—lp lp—bp>bp—bp
必备知识
正误判断
【微思考】俗称光气的二氯甲醛分子(COCl2)为三角形,但C—Cl键与C==O键之间的夹角为124.1°,C—Cl键与C—Cl键之间的夹角为111.8°,解释其原因。
提示:COCl2为平面三角形分子,但由于C==O键与C—Cl键之间电子对的作用强于C—Cl键与C—Cl键之间电子对的作用,所以使C==O键与C—Cl键之间的夹角增大(>120°),使C—Cl键与C—Cl键之间的夹角减小(<120°)。
必备知识
正误判断
二、等电子原理
1.等电子原理的内容
化学通式相同且价电子总数相等的分子或离子具有相同的空间结构和化学键类型等结构特征,这是等电子原理的基本观点。
2.应用举例
利用等电子原理可以推断简单分子或离子的结构。
(1)CO、CN-与N2互为等电子体,则CO的结构式为C≡O,CN-的结构式为[C≡N]-。
(2)CS2与CO2互为等电子体,则CS2的结构式为S==C==S,碳原子的杂化类型为sp,分子空间结构为直线形。
必备知识
正误判断
必备知识
正误判断
判断下列说法是否正确,正确的打“√”,错误的打“×”。
1.价电子对就是σ键电子对。( )
2.孤电子对数是指没有成键的价电子对数,其与中心原子价电子总数、与中心原子结合的原子最多能接受的电子数及与中心原子结合的原子数有关。( )
3.分子的空间结构是价电子对互斥的结果。( )
4.孤电子对数等于π键数。( )
5.价电子对数等于杂化轨道数。( )
答案:1.× 2.√ 3.√ 4.× 5.√
探究1
探究2
素养脉络
随堂检测
价电子对互斥理论与分子空间结构
问题探究
1.CH4分子中的键角为109°28',NH3分子中的键角为107.3°,H2O分子中的键角为104.5°。从价电子对互斥理论分析导致这三种分子键角差异的原因是什么
提示:三种物质的中心原子都是sp3杂化,杂化轨道都是正四面体结构,其中CH4的中心原子没有孤电子对,四个杂化轨道都有成键电子,键角为109°28'。NH3和H2O的中心原子N、O分别有一个、两个杂化轨道填入孤电子对,孤电子对的排斥力比成键电子对大,因此键角被压缩;孤电子对越多,斥力越大,键角被压缩的越小,故NH3的键角为107.3°、H2O的键角为104.5°。
探究1
探究2
素养脉络
随堂检测
2.根据以下事实总结,分析判断一个化合物的中心原子杂化类型的一般方法。
探究1
探究2
素养脉络
随堂检测
提示:(1)通过分子的空间结构判断。如果是直线形,则是sp杂化;如果是三角形,则是sp2杂化;如果是角形,则是sp2杂化(有一个孤电子对)或sp3杂化(有两个孤电子对);如果是四面体形或三角锥形,则是sp3杂化。
(2)对于以碳原子为中心的分子或离子,通过分析中心原子有没有形成双键或三键进行判断。如果有一个三键,则其中有两个是π键,用去了两个p轨道,所以中心原子采取sp杂化;如果有一个双键,则其中有一个π键,用去了一个p轨道,所以中心原子采取sp2杂化;如果全部是单键,则中心原子采取sp3杂化。
探究1
探究2
素养脉络
随堂检测
深化拓展
1.ABm型分子中心原子价电子对数的计算方法(A为中心原子)
方法一:中心原子价电子对数=成键电子对数+孤电子对数。对于ABm型分子,中心原子的成键电子对数为m。
中心原子上的孤电子对数
例如,H2O中的中心原子为氧原子,其价电子数为6,与氧原子结合的每个氢原子未成对电子数为1,因此氧原子上的孤电子对数= =2,则中心原子氧原子的价电子对数=2+2=4。
探究1
探究2
素养脉络
随堂检测
方法二:中心原子价电子对数
在利用此方法计算中心原子的价电子对数时应注意如下规定:作为其他原子,一个卤素原子和一个氢原子均提供一个电子,氧族元素的原子不提供电子。
探究1
探究2
素养脉络
随堂检测
2.价电子对的空间结构
由于价电子对之间的相互排斥作用,它们趋向于尽可能地相互远离。于是价电子对的空间结构与价电子对数目的关系如下表所示:
价电子对数 价电子对的空间结构
2 直线形
3 三角形
4 四面体形
探究1
探究2
素养脉络
随堂检测
3.分子或离子空间结构的确定
(1)如果价电子对全是成键电子对,则价电子对的空间结构即为分子或离子的空间结构。
(2)如果在价电子对中有孤电子对,由于电子对之间的排斥作用:孤电子对—孤电子对>孤电子对—成键电子对>成键电子对—成键电子对,则分子或离子的空间结构与价电子对的空间结构不同。具体情况如下表所示:
探究1
探究2
素养脉络
随堂检测
分子或离子
类型 价电子
对数 价电子对
空间结构 孤电子
对数 分子或离子
的空间结构
AB2 2 直线形 0 直线形
AB3 3 三角形 0 三角形
3 1 角形
AB4 4 四面体形 0 正四面体形
4 1 三角锥形
4 2 角形
【微点拨】分子的空间结构指的是成键电子对空间结构,不包括孤电子对;分子的空间结构和价电子对的空间结构是否一致,取决于中心原子上有无孤电子对,没有孤电子对时,二者一致,有孤电子对时,二者不一致。
探究1
探究2
素养脉络
随堂检测
素能应用
典例1判断下列离子的空间结构。
答案:(1)三角形 (2)三角锥形 (3)正四面体形 (4)正四面体形
探究1
探究2
素养脉络
随堂检测
解析:根据中心原子形成的σ键数目和孤电子对数判断杂化类型,结合价电子对互斥理论判断分子或离子的空间结构。
探究1
探究2
素养脉络
随堂检测
规律方法价电子对数目、价电子对的空间结构及粒子的空间结构之间的关系
价电子对数目 价电子对的空间结构 成键电
子对数 孤电子
对数 粒子的
空间结构 实例
2 直线形 2 0 直线形 BeCl2 CO2
3 三角形 3 0 三角形 BF3 BCl3
2 1 角形 SnBr2 PbCl2
4 四面体形 4 0 正四面体形 CH4 CCl4
3 1 三角锥形 NH3 NF3
2 2 角形 H2O
探究1
探究2
素养脉络
随堂检测
变式训练1-1 下列描述中正确的是( )
A.CS2分子的空间结构为角形
B. 的空间结构为三角形
C.SF6中每个原子均满足最外层8电子稳定结构
D.SiF4和 的中心原子均为sp3杂化
探究1
探究2
素养脉络
随堂检测
答案:D
探究1
探究2
素养脉络
随堂检测
变式训练1-2 卤族元素是典型的非金属元素,包括F、Cl、Br、I等,请回答下面有关问题。
(1)同主族元素的电负性大小存在一定的规律,卤族元素F、Cl、Br、I的电负性由小到大的顺序是 。
(2)溴原子的核外电子排布式为 。
(3)用价电子对互斥理论判断BeCl2的空间结构为 ,BF3分子中B—F键的键角为 。
(4)CCl4分子中碳原子的杂化方式为 ,NF3分子的空间结构为 。
探究1
探究2
素养脉络
随堂检测
答案:(1)I(2)1s22s22p63s23p63d104s24p5或[Ar]3d104s24p5
(3)直线形 120° (4)sp3 三角锥形
解析:(1)同主族元素自上而下电负性减小,故电负性I(2)溴原子的核外电子排布式为1s22s22p63s23p63d104s24p5或[Ar]3d104s24p5。
(3)BeCl2中Be发生sp2杂化,分子是直线形结构,两个Be—Cl键之间的夹角为180°;BF3分子的中心原子硼原子形成3个σ键,中心原子上的孤电子对数= (3-3×1)=0,所以BF3分子的空间结构为三角形,键角是120°。
(4)CCl4中碳原子形成四个单键,故其发生sp3杂化;NF3分子空间结构与NH3相似,NH3分子空间结构是三角锥形的,所以NF3分子空间结构也是三角锥形的。
探究1
探究2
素养脉络
随堂检测
等电子原理
问题探究
1.等电子体有哪些应用
提示:(1)判断一些简单分子或离子的空间结构;
(2)利用等电子体在性质上的相似性制造新材料;
(3)利用等电子原理针对某性质找相应的等电子体。
2.为什么SiF4、CF4、CCl4三者的空间结构相同
提示:SiF4、CF4、CCl4三种物质单个分子的原子数目相同,中心原子的价电子数相同,故它们为等电子体,因此其空间结构也相同。
探究1
探究2
素养脉络
随堂检测
深化拓展
1.等电子体的判断方法
化学通式相同,价电子总数相等的分子或离子互为等电子体。
探究1
探究2
素养脉络
随堂检测
2.常见的等电子体
探究1
探究2
素养脉络
随堂检测
素能应用
典例2根据等电子原理,由短周期元素组成的粒子,只要其原子数相同,各原子最外层电子数之和相同,也可互称等电子体,它们也具有相似的结构特征。
(1)仅由第2周期元素组成的共价分子中,互为等电子体的是 和 ; 和 。
(2)在短周期元素组成的物质中,与 互为等电子体的分子有 。
探究1
探究2
素养脉络
随堂检测
答案:(1)N2 CO CO2 N2O
(2)SO2、O3
解析:(1)仅由第2周期元素组成的共价分子中,N2与CO的价电子总数均为10,CO2与N2O价电子总数均为16。
(2)依题意,只要原子数相同,且各原子最外层电子数之和也相同,即可互称等电子体。 为三原子粒子,各原子最外层电子数之和为5+6×2+1=18,SO2、O3也为三原子粒子,各原子最外层电子数之和为6×3=18,因此SO2、O3与 互为等电子体。
探究1
探究2
素养脉络
随堂检测
方法规律 利用替换法写等电子体
(1)同主族替换法。
同主族元素最外层电子数相等,故可将粒子中一个或几个原子换成同主族元素的其他原子,如O3与SO2、CO2与CS2分别互为等电子体。
(2)左右移位法。
①将粒子中的两个原子换成原子序数分别增加n和减少n(n=1,2等)的原子,如N2与CO、 和CNO-互为等电子体。
②将粒子中的m个原子换成原子序数增加(或减少)n的元素的原子,且粒子的总电荷数减小(或增大)m×n,
(3)叠加法。
互为等电子体的微粒分别再增加一个相同的原子或同主族元素的原子,如CO和N2互为等电子体,则N2O与CO2也互为等电子体。
探究1
探究2
素养脉络
随堂检测
变式训练2-1等电子体的结构相似,物理性质相似。下列各组粒子中,空间结构相似的是( )
A.SO2与O3 B.CO2与NO2
C.CS2与NO2 D.PCl3与BF3
答案:A
解析:SO2与O3互为等电子体,空间结构相似,A正确;CO2与NO2、CS2与NO2、PCl3与BF3价电子数都不同,都不是等电子体。
探究1
探究2
素养脉络
随堂检测
变式训练2-2 下列各组微粒属于等电子体的是( )
A.12CO2和14CO B.H2O和NH3
C.NO+和CN- D.NO和CO
答案:C
解析:根据等电子原理判断,NO+与CN-属于等电子体。
探究1
探究2
素养脉络
随堂检测
探究1
探究2
素养脉络
随堂检测
1.下列分子或离子的中心原子含有孤电子对的是( )
A.H2O B.CH4 C.SiH4 D.
答案:A
解析:H2O分子中的中心原子氧原子上有2对孤电子对。
探究1
探究2
素养脉络
随堂检测
2.根据等电子原理,下列各组分子或离子的空间结构不相似的是
( )
A.SO2和O3 B. 和CH4
C.H3O+和NH3 D.CO2和H2O
答案:D
解析:D项中,CO2分子和H2O分子原子总数相等,价电子总数前者为16,后者为10,二者不属于等电子体,则空间结构不相似。
探究1
探究2
素养脉络
随堂检测
3.已知在CH4中C—H键之间的键角为109°28',NH3中N—H键之间的键角为107.3°,H2O中O—H键之间的键角为104.5°。则下列说法中正确的是( )
A.孤电子对与成键电子对之间的斥力大于成键电子对与成键电子对之间的斥力
B.孤电子对与成键电子对之间的斥力小于成键电子对与成键电子对之间的斥力
C.孤电子对与成键电子对之间的斥力等于成键电子对与成键电子对之间的斥力
D.题干中的数据不能说明孤电子对与成键电子对之间的斥力和成键电子对与成键电子对之间斥力的大小关系
探究1
探究2
素养脉络
随堂检测
答案:A
解析:电子对之间斥力大小规律:孤电子对与孤电子对>孤电子对与成键电子对>成键电子对与成键电子对。A项正确。
探究1
探究2
素养脉络
随堂检测
4.下列中心原子的杂化轨道类型和分子空间结构不正确的是( )
A.PCl3中磷原子发生sp3杂化,为三角锥形
B.BCl3中硼原子发生sp2杂化,为三角形
C.CS2中碳原子发生sp杂化,为直线形
D.H2S中硫原子发生sp杂化,为直线形
答案:D
解析:H2S中硫原子形成2个σ键,孤电子对数为 =2,则硫原子发生sp3杂化,空间结构为角形,故D错误。
探究1
探究2
素养脉络
随堂检测
5.用价电子对互斥理论完成下列问题。
(1)在下列表格中填上相应的内容。
化学式 σ键电子对数 孤电子对数 空间结构
H2Se
BCl3
PCl3
SO2
(2)用价电子对互斥理论推断,甲醛中两个H—C键之间的键角 (填“>”“<”或“=”)120°。
探究1
探究2
素养脉络
随堂检测
答案:(1)
σ键电子对数 孤电子对数 空间结构
H2Se 2 2 角形
BCl3 3 0 三角形
PCl3 3 1 三角锥形
SO2 2 1 角形
4 0 正四面体形
(2)<
解析:(2)甲醛分子式为CH2O,碳原子的价电子对数为 ×(4+2+0)=3,孤电子对数为0,所以CH2O为平面分子,由于C==O键与C—H键之间的排斥作用大于两个C—H键之间的排斥作用,所以甲醛分子中C—H键与C—H键之间的夹角小于120°。
第2课时 价电子对互斥理论
1.理解价电子对互斥理论和等电子原理,能根据有关理论、原理判断简单分子或离子的空间结构。培养证据推理与模型认知的化学核心素养。
2.了解等电子理论,能根据物质的微观结构预测物质在特定条件下可能具有的性质和可能发生的变化,形成宏观辨识与微观探析的化学核心素养。
必备知识
正误判断
一、价电子对互斥理论
1.价电子对互斥理论的基本观点
分子中的中心原子的价电子对——成键电子对(bp)和孤电子对(lp)由于相互排斥作用,处于不同的空间取向且尽可能趋向于彼此远离。两个原子间的成键电子不论是单键还是多重键,都看作一个空间取向;一对孤电子对可看作一个空间取向。因此,我们可以先分析分子中的中心原子的价电子对存在几个空间取向,再让这几个空间取向尽量彼此远离,就可以推测出分子的空间结构。
必备知识
正误判断
2.价电子对互斥理论与分子的空间结构
(1)中心原子价电子全部参与成键的分子空间结构:
ABn 价电子
对数 成键电子
对数 孤电子
对数 空间结构 举例
n=2 2 2 0 直线形 CO2、BeCl2
n=3 3 3 0 三角形 CH2O、BF3
n=4 4 4 0 正四面体形 CH4、CCl4
必备知识
正误判断
(2)中心原子上有孤电子对的分子空间结构:
中心原子上的孤电子对占据中心原子周围的空间,与成键电子对互相排斥,使分子的空间结构发生变化。
ABn 价电子
对数 成键电
子对数 孤电子
对数 空间结构 举例
n=2 3 2 1 角形 SnBr2、SnCl2
n=3
或
n=2 4 3 1 三角锥形 NH3、PCl3
2 2 角形 H2O、H2S
必备知识
正误判断
3.电子对之间的排斥与分子空间结构
当价电子对包含孤电子对且成键电子对中也有多重键时,由于它们之间的斥力不同,会对分子的空间结构产生影响。通常,多重键、成键电子对与孤电子对的斥力大小顺序可定性地表示为:
三键—三键>三键—双键>双键—双键>双键—单键>单键—单键
lp—lp lp—bp>bp—bp
必备知识
正误判断
【微思考】俗称光气的二氯甲醛分子(COCl2)为三角形,但C—Cl键与C==O键之间的夹角为124.1°,C—Cl键与C—Cl键之间的夹角为111.8°,解释其原因。
提示:COCl2为平面三角形分子,但由于C==O键与C—Cl键之间电子对的作用强于C—Cl键与C—Cl键之间电子对的作用,所以使C==O键与C—Cl键之间的夹角增大(>120°),使C—Cl键与C—Cl键之间的夹角减小(<120°)。
必备知识
正误判断
二、等电子原理
1.等电子原理的内容
化学通式相同且价电子总数相等的分子或离子具有相同的空间结构和化学键类型等结构特征,这是等电子原理的基本观点。
2.应用举例
利用等电子原理可以推断简单分子或离子的结构。
(1)CO、CN-与N2互为等电子体,则CO的结构式为C≡O,CN-的结构式为[C≡N]-。
(2)CS2与CO2互为等电子体,则CS2的结构式为S==C==S,碳原子的杂化类型为sp,分子空间结构为直线形。
必备知识
正误判断
必备知识
正误判断
判断下列说法是否正确,正确的打“√”,错误的打“×”。
1.价电子对就是σ键电子对。( )
2.孤电子对数是指没有成键的价电子对数,其与中心原子价电子总数、与中心原子结合的原子最多能接受的电子数及与中心原子结合的原子数有关。( )
3.分子的空间结构是价电子对互斥的结果。( )
4.孤电子对数等于π键数。( )
5.价电子对数等于杂化轨道数。( )
答案:1.× 2.√ 3.√ 4.× 5.√
探究1
探究2
素养脉络
随堂检测
价电子对互斥理论与分子空间结构
问题探究
1.CH4分子中的键角为109°28',NH3分子中的键角为107.3°,H2O分子中的键角为104.5°。从价电子对互斥理论分析导致这三种分子键角差异的原因是什么
提示:三种物质的中心原子都是sp3杂化,杂化轨道都是正四面体结构,其中CH4的中心原子没有孤电子对,四个杂化轨道都有成键电子,键角为109°28'。NH3和H2O的中心原子N、O分别有一个、两个杂化轨道填入孤电子对,孤电子对的排斥力比成键电子对大,因此键角被压缩;孤电子对越多,斥力越大,键角被压缩的越小,故NH3的键角为107.3°、H2O的键角为104.5°。
探究1
探究2
素养脉络
随堂检测
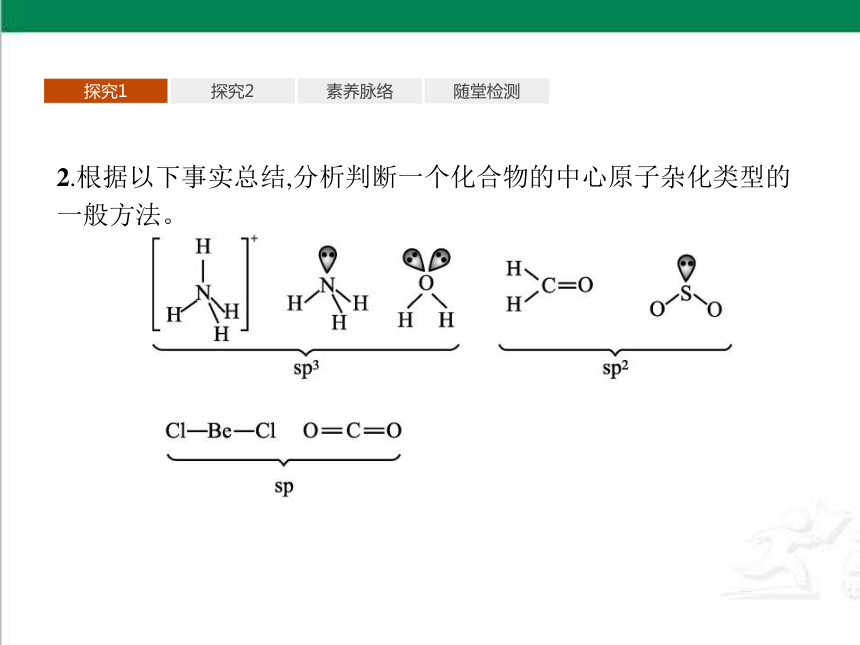
2.根据以下事实总结,分析判断一个化合物的中心原子杂化类型的一般方法。
探究1
探究2
素养脉络
随堂检测
提示:(1)通过分子的空间结构判断。如果是直线形,则是sp杂化;如果是三角形,则是sp2杂化;如果是角形,则是sp2杂化(有一个孤电子对)或sp3杂化(有两个孤电子对);如果是四面体形或三角锥形,则是sp3杂化。
(2)对于以碳原子为中心的分子或离子,通过分析中心原子有没有形成双键或三键进行判断。如果有一个三键,则其中有两个是π键,用去了两个p轨道,所以中心原子采取sp杂化;如果有一个双键,则其中有一个π键,用去了一个p轨道,所以中心原子采取sp2杂化;如果全部是单键,则中心原子采取sp3杂化。
探究1
探究2
素养脉络
随堂检测
深化拓展
1.ABm型分子中心原子价电子对数的计算方法(A为中心原子)
方法一:中心原子价电子对数=成键电子对数+孤电子对数。对于ABm型分子,中心原子的成键电子对数为m。
中心原子上的孤电子对数
例如,H2O中的中心原子为氧原子,其价电子数为6,与氧原子结合的每个氢原子未成对电子数为1,因此氧原子上的孤电子对数= =2,则中心原子氧原子的价电子对数=2+2=4。
探究1
探究2
素养脉络
随堂检测
方法二:中心原子价电子对数
在利用此方法计算中心原子的价电子对数时应注意如下规定:作为其他原子,一个卤素原子和一个氢原子均提供一个电子,氧族元素的原子不提供电子。
探究1
探究2
素养脉络
随堂检测
2.价电子对的空间结构
由于价电子对之间的相互排斥作用,它们趋向于尽可能地相互远离。于是价电子对的空间结构与价电子对数目的关系如下表所示:
价电子对数 价电子对的空间结构
2 直线形
3 三角形
4 四面体形
探究1
探究2
素养脉络
随堂检测
3.分子或离子空间结构的确定
(1)如果价电子对全是成键电子对,则价电子对的空间结构即为分子或离子的空间结构。
(2)如果在价电子对中有孤电子对,由于电子对之间的排斥作用:孤电子对—孤电子对>孤电子对—成键电子对>成键电子对—成键电子对,则分子或离子的空间结构与价电子对的空间结构不同。具体情况如下表所示:
探究1
探究2
素养脉络
随堂检测
分子或离子
类型 价电子
对数 价电子对
空间结构 孤电子
对数 分子或离子
的空间结构
AB2 2 直线形 0 直线形
AB3 3 三角形 0 三角形
3 1 角形
AB4 4 四面体形 0 正四面体形
4 1 三角锥形
4 2 角形
【微点拨】分子的空间结构指的是成键电子对空间结构,不包括孤电子对;分子的空间结构和价电子对的空间结构是否一致,取决于中心原子上有无孤电子对,没有孤电子对时,二者一致,有孤电子对时,二者不一致。
探究1
探究2
素养脉络
随堂检测
素能应用
典例1判断下列离子的空间结构。
答案:(1)三角形 (2)三角锥形 (3)正四面体形 (4)正四面体形
探究1
探究2
素养脉络
随堂检测
解析:根据中心原子形成的σ键数目和孤电子对数判断杂化类型,结合价电子对互斥理论判断分子或离子的空间结构。
探究1
探究2
素养脉络
随堂检测
规律方法价电子对数目、价电子对的空间结构及粒子的空间结构之间的关系
价电子对数目 价电子对的空间结构 成键电
子对数 孤电子
对数 粒子的
空间结构 实例
2 直线形 2 0 直线形 BeCl2 CO2
3 三角形 3 0 三角形 BF3 BCl3
2 1 角形 SnBr2 PbCl2
4 四面体形 4 0 正四面体形 CH4 CCl4
3 1 三角锥形 NH3 NF3
2 2 角形 H2O
探究1
探究2
素养脉络
随堂检测
变式训练1-1 下列描述中正确的是( )
A.CS2分子的空间结构为角形
B. 的空间结构为三角形
C.SF6中每个原子均满足最外层8电子稳定结构
D.SiF4和 的中心原子均为sp3杂化
探究1
探究2
素养脉络
随堂检测
答案:D
探究1
探究2
素养脉络
随堂检测
变式训练1-2 卤族元素是典型的非金属元素,包括F、Cl、Br、I等,请回答下面有关问题。
(1)同主族元素的电负性大小存在一定的规律,卤族元素F、Cl、Br、I的电负性由小到大的顺序是 。
(2)溴原子的核外电子排布式为 。
(3)用价电子对互斥理论判断BeCl2的空间结构为 ,BF3分子中B—F键的键角为 。
(4)CCl4分子中碳原子的杂化方式为 ,NF3分子的空间结构为 。
探究1
探究2
素养脉络
随堂检测
答案:(1)I
(3)直线形 120° (4)sp3 三角锥形
解析:(1)同主族元素自上而下电负性减小,故电负性I
(3)BeCl2中Be发生sp2杂化,分子是直线形结构,两个Be—Cl键之间的夹角为180°;BF3分子的中心原子硼原子形成3个σ键,中心原子上的孤电子对数= (3-3×1)=0,所以BF3分子的空间结构为三角形,键角是120°。
(4)CCl4中碳原子形成四个单键,故其发生sp3杂化;NF3分子空间结构与NH3相似,NH3分子空间结构是三角锥形的,所以NF3分子空间结构也是三角锥形的。
探究1
探究2
素养脉络
随堂检测
等电子原理
问题探究
1.等电子体有哪些应用
提示:(1)判断一些简单分子或离子的空间结构;
(2)利用等电子体在性质上的相似性制造新材料;
(3)利用等电子原理针对某性质找相应的等电子体。
2.为什么SiF4、CF4、CCl4三者的空间结构相同
提示:SiF4、CF4、CCl4三种物质单个分子的原子数目相同,中心原子的价电子数相同,故它们为等电子体,因此其空间结构也相同。
探究1
探究2
素养脉络
随堂检测
深化拓展
1.等电子体的判断方法
化学通式相同,价电子总数相等的分子或离子互为等电子体。
探究1
探究2
素养脉络
随堂检测
2.常见的等电子体
探究1
探究2
素养脉络
随堂检测
素能应用
典例2根据等电子原理,由短周期元素组成的粒子,只要其原子数相同,各原子最外层电子数之和相同,也可互称等电子体,它们也具有相似的结构特征。
(1)仅由第2周期元素组成的共价分子中,互为等电子体的是 和 ; 和 。
(2)在短周期元素组成的物质中,与 互为等电子体的分子有 。
探究1
探究2
素养脉络
随堂检测
答案:(1)N2 CO CO2 N2O
(2)SO2、O3
解析:(1)仅由第2周期元素组成的共价分子中,N2与CO的价电子总数均为10,CO2与N2O价电子总数均为16。
(2)依题意,只要原子数相同,且各原子最外层电子数之和也相同,即可互称等电子体。 为三原子粒子,各原子最外层电子数之和为5+6×2+1=18,SO2、O3也为三原子粒子,各原子最外层电子数之和为6×3=18,因此SO2、O3与 互为等电子体。
探究1
探究2
素养脉络
随堂检测
方法规律 利用替换法写等电子体
(1)同主族替换法。
同主族元素最外层电子数相等,故可将粒子中一个或几个原子换成同主族元素的其他原子,如O3与SO2、CO2与CS2分别互为等电子体。
(2)左右移位法。
①将粒子中的两个原子换成原子序数分别增加n和减少n(n=1,2等)的原子,如N2与CO、 和CNO-互为等电子体。
②将粒子中的m个原子换成原子序数增加(或减少)n的元素的原子,且粒子的总电荷数减小(或增大)m×n,
(3)叠加法。
互为等电子体的微粒分别再增加一个相同的原子或同主族元素的原子,如CO和N2互为等电子体,则N2O与CO2也互为等电子体。
探究1
探究2
素养脉络
随堂检测
变式训练2-1等电子体的结构相似,物理性质相似。下列各组粒子中,空间结构相似的是( )
A.SO2与O3 B.CO2与NO2
C.CS2与NO2 D.PCl3与BF3
答案:A
解析:SO2与O3互为等电子体,空间结构相似,A正确;CO2与NO2、CS2与NO2、PCl3与BF3价电子数都不同,都不是等电子体。
探究1
探究2
素养脉络
随堂检测
变式训练2-2 下列各组微粒属于等电子体的是( )
A.12CO2和14CO B.H2O和NH3
C.NO+和CN- D.NO和CO
答案:C
解析:根据等电子原理判断,NO+与CN-属于等电子体。
探究1
探究2
素养脉络
随堂检测
探究1
探究2
素养脉络
随堂检测
1.下列分子或离子的中心原子含有孤电子对的是( )
A.H2O B.CH4 C.SiH4 D.
答案:A
解析:H2O分子中的中心原子氧原子上有2对孤电子对。
探究1
探究2
素养脉络
随堂检测
2.根据等电子原理,下列各组分子或离子的空间结构不相似的是
( )
A.SO2和O3 B. 和CH4
C.H3O+和NH3 D.CO2和H2O
答案:D
解析:D项中,CO2分子和H2O分子原子总数相等,价电子总数前者为16,后者为10,二者不属于等电子体,则空间结构不相似。
探究1
探究2
素养脉络
随堂检测
3.已知在CH4中C—H键之间的键角为109°28',NH3中N—H键之间的键角为107.3°,H2O中O—H键之间的键角为104.5°。则下列说法中正确的是( )
A.孤电子对与成键电子对之间的斥力大于成键电子对与成键电子对之间的斥力
B.孤电子对与成键电子对之间的斥力小于成键电子对与成键电子对之间的斥力
C.孤电子对与成键电子对之间的斥力等于成键电子对与成键电子对之间的斥力
D.题干中的数据不能说明孤电子对与成键电子对之间的斥力和成键电子对与成键电子对之间斥力的大小关系
探究1
探究2
素养脉络
随堂检测
答案:A
解析:电子对之间斥力大小规律:孤电子对与孤电子对>孤电子对与成键电子对>成键电子对与成键电子对。A项正确。
探究1
探究2
素养脉络
随堂检测
4.下列中心原子的杂化轨道类型和分子空间结构不正确的是( )
A.PCl3中磷原子发生sp3杂化,为三角锥形
B.BCl3中硼原子发生sp2杂化,为三角形
C.CS2中碳原子发生sp杂化,为直线形
D.H2S中硫原子发生sp杂化,为直线形
答案:D
解析:H2S中硫原子形成2个σ键,孤电子对数为 =2,则硫原子发生sp3杂化,空间结构为角形,故D错误。
探究1
探究2
素养脉络
随堂检测
5.用价电子对互斥理论完成下列问题。
(1)在下列表格中填上相应的内容。
化学式 σ键电子对数 孤电子对数 空间结构
H2Se
BCl3
PCl3
SO2
(2)用价电子对互斥理论推断,甲醛中两个H—C键之间的键角 (填“>”“<”或“=”)120°。
探究1
探究2
素养脉络
随堂检测
答案:(1)
σ键电子对数 孤电子对数 空间结构
H2Se 2 2 角形
BCl3 3 0 三角形
PCl3 3 1 三角锥形
SO2 2 1 角形
4 0 正四面体形
(2)<
解析:(2)甲醛分子式为CH2O,碳原子的价电子对数为 ×(4+2+0)=3,孤电子对数为0,所以CH2O为平面分子,由于C==O键与C—H键之间的排斥作用大于两个C—H键之间的排斥作用,所以甲醛分子中C—H键与C—H键之间的夹角小于120°。
