鲁科版高中化学选择性必修2第2章微粒间相互作用与物质性质2.3.2配位键教学课件
文档属性
| 名称 | 鲁科版高中化学选择性必修2第2章微粒间相互作用与物质性质2.3.2配位键教学课件 |

|
|
| 格式 | ppt | ||
| 文件大小 | 4.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-11 00:00:00 | ||
图片预览




文档简介
(共29张PPT)
食盐真的有毒吗?
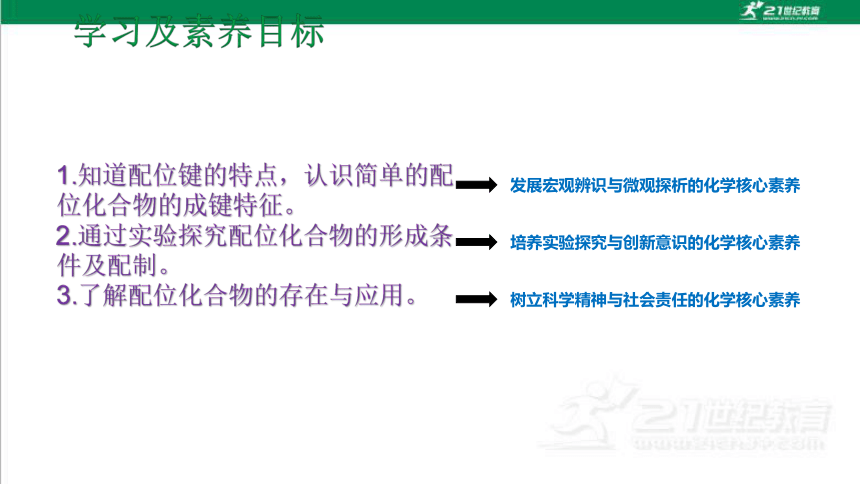
1.知道配位键的特点,认识简单的配位化合物的成键特征。
2.通过实验探究配位化合物的形成条件及配制。
3.了解配位化合物的存在与应用。
发展宏观辨识与微观探析的化学核心素养
培养实验探究与创新意识的化学核心素养
树立科学精神与社会责任的化学核心素养
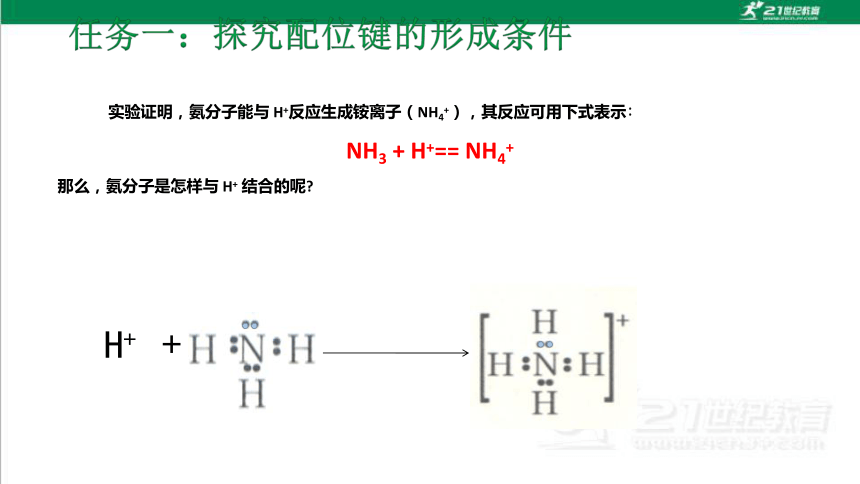
实验证明,氨分子能与 H+反应生成铵离子(NH4+),其反应可用下式表示∶
NH3 + H+== NH4+
那么,氨分子是怎样与 H+ 结合的呢
H+ +
H+ +
孤电子对
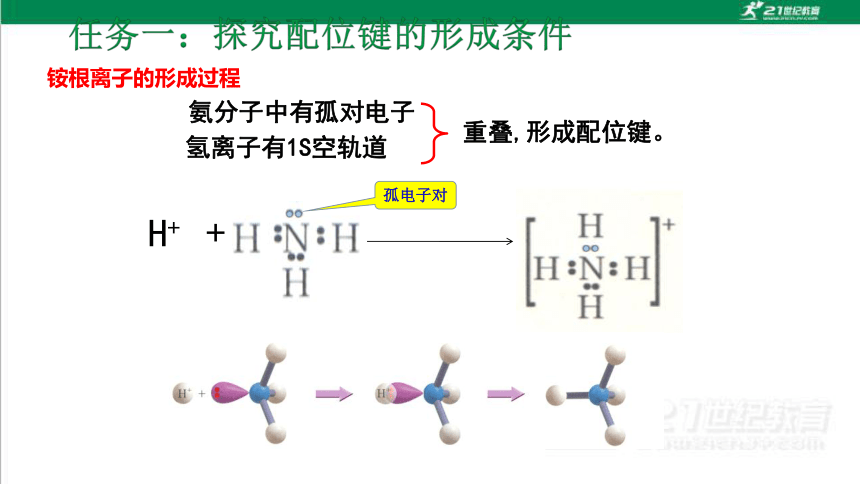
铵根离子的形成过程
氨分子中有孤对电子
氢离子有1S空轨道
重叠,形成配位键。
配
位
键
的
形
成
条
件
1.条件
一方A提供孤电子对,另一方B提供能够接受孤
电子对的空轨道。
2.表示
用符号A→B表示
练习:1.写出NH4+和H3O+中配位键的表示方法。
2.NH4+中的配位键和其他N-H有何异同?
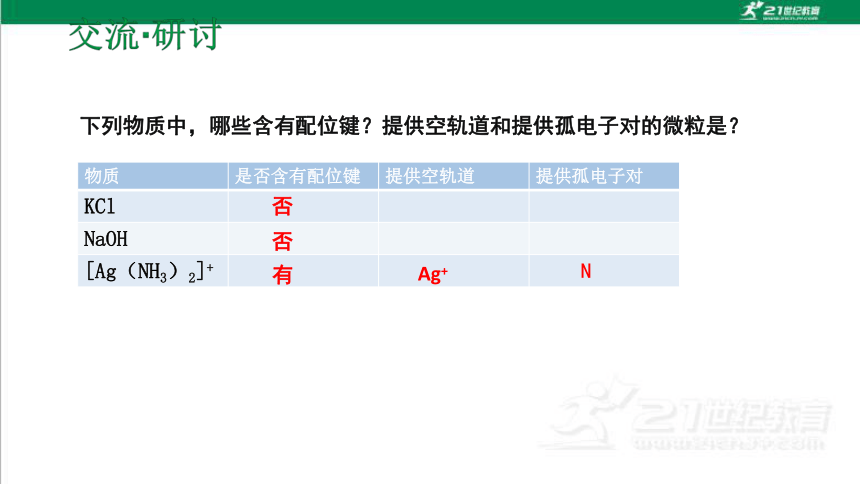
物质 是否含有配位键 提供空轨道 提供孤电子对
KCl
NaOH
[Ag(NH3)2]+
下列物质中,哪些含有配位键?提供空轨道和提供孤电子对的微粒是?
否
否
有
Ag+
N
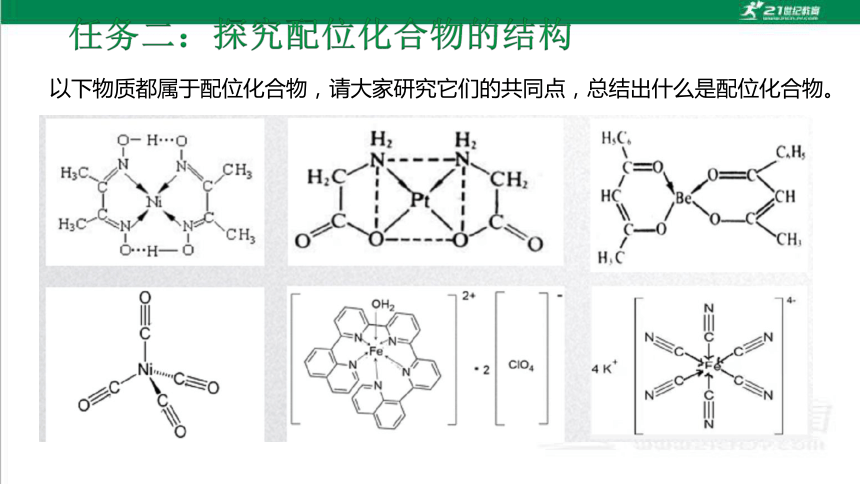
以下物质都属于配位化合物,请大家研究它们的共同点,总结出什么是配位化合物。
思考:结合上述配合物的实例,分析NH4Cl是配合物吗?
配位化合物
定义
形成条件
把能接受孤电子对的空轨道的金属离子(或原子)与某些提供孤电子对的分子或离子以配位键结合形成的化合物成为配位化合物,简称配合物。
有能接受孤电子对的空轨道的金属离子或原子;
有提供孤电子对的分子或离子。
[Ag(NH3)2]NO3
配
位
数
中
心
离
子
配
位
体
外界(离子)
内界(配离子)
硝酸二氨合银
[Ag(NH3)2]NO3 == [Ag(NH3)2]++NO3-
提供孤电子对
提供空轨道
注意:
内界与外界之间的化学键是离子键。
内界通常较稳定,中心体和配体通常难以电离。
K4[Fe(CN)6]
配
位
数
中
心
离
子
配
位
体
内界(配离子)
外界(离子)
提供孤电子对
提供空轨道
亚铁氰化钾
K4[Fe(CN)6] = 4K++[Fe(CN)6]4-
注意:
内界与外界之间的化学键是离子键。
内界通常较稳定,中心体和配体通常难以电离。
食盐有毒吗?
K4[Fe(CN)6]
抗结剂
从原理上说,氰化物可以通过接触皮肤和腔道粘膜、呼吸吸入、口服、注射等各种途径进入人体,然后解离出氰基离子。这种离子能与人体中细胞色素酶内的三价铁离子(Fe 3+)牢牢地结合,从而使得它不再能变为二价铁离子(Fe 2+),从而导致细胞内一系列的生化反应不能继续进行,使细胞不能再利用血液中的氧气而迅速窒息。同时,因为缺乏呼吸作用产生的能量(ATP),中枢神经系统会迅速丧失功能,继而使人体出现呼吸肌麻痹、心跳停止、多脏器衰竭等症状而迅速死亡。
亚铁氰化钾在高温环境下容易分解为氰化钾,此反应的温度条件是400摄氏度。
我们日常烹调温度根本无法达到,最高温度也不会超过340摄氏度;温度达不到,也就根本不会分解出氰化钾物质。
1.下列配合物的水溶液中加入硝酸银不能生成沉淀的是( )A.[Co(NH3)4Cl2]Cl B.[Co(NH3)6]Cl3C.[Cu(NH3)4]Cl2 D.[Co(NH3)3Cl3]
D
中心体
提供能够接受孤电子对的空轨道的原子
或离子,多为金属,常见的是过渡金属,如:Fe、Ni、Fe3+、Ag+、Cu2+、Zn2+等
配体
1.提含有孤电子对的原子、分子或离子。
2.原子常为VA、VIA、VIIA族元素的原子。
3.分子:如H2O、NH3、CO等。
4.阴离子:如X-、OH-、SCN-、CH3COO-、CN-等。
配位原子
配体中直接与中心体键合的原子,都具有孤电子对,如C、N、O、S、P、X等。
配位数
直接与中心体键合的配位原子的数目。
思考:配体中原子都具有孤电子对,如何判断谁是配位原子?
思考:配体数目与配位数一定相等吗?
单齿配体
多齿配体(螯合物)
在配位化学及其应用领域做出重要贡献的我国著名化学家
唐敖庆教授是我国现代理论化学的开拓者和奠基人。他从20世纪 60 年代起系统地开展配位场理论的研究;70年代,进行了配合化学模拟生物固氮作用的研究,开展了分子氮配位作用的化学键理论研究,其"配位场理论方法"获 1982 年国家自然科学奖一等奖。
徐光宪教授长期从事物理化学和无机化学的教学及研究,涉及量子化学、化学键理论、配位化学、萃取化学、核燃料化学和稀土科学等领域。基于对稀土化学键、配位化学和物质结构等基本规律的深刻认识,他发现了稀土溶剂萃取体系具有"恒定混合萃取比"基本规律。20世纪 70年代,他建立了具有普适性的串级萃取理论,极大提升了利用配合│物萃取分离稀土元素的效率,为我国稀土工业的发展做出了突出贡献,获得 2008 年度"国家最高科学技术奖"。
2.(2020山东)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Cd2+配合物的结构如下图所示,1mol该配合物中通过螯合作用形成的配位键有 mol。
6
3.已知血红蛋白分子中含有配位键,请指出Fe和N形成的四个化学键中哪些是配位键?
实验目的
实验用品
制备简单的配合物,体验配合物应用。
0.1 mol·L-1AgNO3溶液,0.1 mol·L-1CuSO4溶液,1 mol·L-1盐酸,1 mol·L-1硝酸,1 mol·L-1NaCl溶液,1 mol·L-1NaOH溶液,浓氨水,10%葡萄糖溶液,氯化铜固体,氯化铁固体,硝酸铁固体,蒸馏水;
试管,胶头滴管。
实验方案设计与实施
蓝色
黄绿色
实验任务 实验过程与现象 结论
1.探究氯化铜固体在溶解并稀释过程中所发生的变化
2.分别以氯化铁和硝酸铁为原料,探究Fe3+溶液显色的原因
3.制备[Ag(NH3)2]+并用于与葡萄糖反应得到银镜
4.对比Cu2+与氨水和OH-反应的差异
分组实验
1、2组做实验1
3、4组做实验2
5、6组做实验3
7、8组做实验4
要求:
小组人员分工合作,注意实验中的试剂的使用剂量,尽量做到节约环保。
[CuCl4]2- [Cu(NH3)4]2+ [Fe(H2O)6]3+ [Fe(H2O)6-n(OH)n]3-n [FeCl4]-
黄绿色 深蓝色 无色 黄色 黄色
实验1.向试管中加入少量氯化铜粉末,然后加水溶解,再逐渐加水稀释,边加边振荡,观察现象。
现象:CuCl2(s) 黄绿色溶液
水
水
蓝色溶液
结论:
[CuCl4]2-+4H2O [Cu(H2O)4]2++4Cl-
黄绿 蓝色
思考:溶液呈现黄绿色和蓝色,说明溶液中分别存在了什么微粒?
由于溶液浓度的改变,引起平衡移动,导致配离子发生转变,从而使溶液颜色发生变化。
配合物存在形式受浓度的影响
实验2.分别以氯化铁和硝酸铁为原料,探究Fe3+溶液显色的原因
结论:
配合物的形成与配体的种类有关。
不同的配合物耐酸程度不同,从而影响其存在形式。
如何设计实验操作?
① Fe3+水解并与OH-配位 [Fe(H2O)6-n(OH)n]3-n,使溶液显示黄色。
加入硝酸,氢离子浓度增加,平衡左移,溶液主要以[Fe(H2O)6]3+存在,退为无色。
[Fe(H2O)6]3++nH2O [Fe(H2O)6-n(OH)n]3-n+nH3O+
现象:FeCl3(s) 黄色溶液
硝酸
水
黄色溶液
结论:
② 氯化铁溶液中形成黄色配离子[FeCl4]-。加酸酸化也不分解。
现象:Fe(NO3)3(s) 黄色溶液
硝酸
水
黄色退去
氯化钠
黄色溶液
实验3.制备[Ag(NH3)2]+并用于与葡萄糖反应制备银镜
配合物可用于制备物质。
结论:
Ag++NH3·H2O = AgOH↓+NH4+
AgOH+2NH3·H2O = [Ag(NH3)2]++ OH- + 2H2O
[Ag(NH3)2]OH与葡萄糖反应产生银镜。
现象:AgNO3(aq) 白色沉淀
浓氨水
浓氨水
沉淀溶解
葡萄糖
水浴加热
银镜
实验4.探究Cu2+与氨水和OH-反应的差异。
结论:
如何设计实验操作?
现象:CuSO4(aq) 蓝色沉淀
氨水
氨水
深蓝色溶液
现象:CuSO4(aq) 蓝色沉淀
氢氧化钠
氢氧化钠
蓝色溶液
①Cu2++2NH3·H2O ==Cu(OH)2↓+2NH4+
②Cu(OH)2+ 4NH3·H2O == [Cu(NH3)4]2++2OH-+4H2O
①Cu2++2OH-==Cu(OH)2↓
②Cu(OH)2+2OH-== [Cu(OH)4]2-
配合物存在形式受配体的影响。
实验任务 操作 现象 结论
1.探究氯化铜固体在溶解并稀释过程中所发生的变化 取少量氯化铜固体于一支试管中,向其中逐滴加入蒸馏水至过量,观察实验现象
实验任务 操作 现象 结论
2.分别以氯化铁和硝酸铁为原料,探究Fe3+溶液显色的原因 将少量的氯化铁和硝酸铁固体溶解在水中。
取1mL硝酸铁溶液于试管中,向其中加入2滴稀硝酸
取2mL氯化铁溶液于试管中,向其中加入3滴稀硝酸
将硝酸铁溶液分为2份,一份加入3滴氯化钠溶液,另一份加入3滴硝酸钠溶液
实验任务 操作 现象 结论
归纳配合物的应用
(1)物质检验
Fe3+的检验
Fe3+ + nSCN- → [Fe(SCN)n]3-n (n=1 ~ 6)
(2)物质制备
制备银氨溶液用于制镜工业
(3)参与生命活动
生命体中,许多酶与金属离子的配合物有关
(4)用于尖端技术、医药科学、催化反应和材料化学等领域
为什么CO会使人中毒?如果你遇到这种情况应该怎么做?
与Fe2+结合能力:
CO>O2
配位键
配合物
应用
宏观辨识与微观探析
科学探究与创新意识
科学态度与社会责任
食盐真的有毒吗?
1.知道配位键的特点,认识简单的配位化合物的成键特征。
2.通过实验探究配位化合物的形成条件及配制。
3.了解配位化合物的存在与应用。
发展宏观辨识与微观探析的化学核心素养
培养实验探究与创新意识的化学核心素养
树立科学精神与社会责任的化学核心素养
实验证明,氨分子能与 H+反应生成铵离子(NH4+),其反应可用下式表示∶
NH3 + H+== NH4+
那么,氨分子是怎样与 H+ 结合的呢
H+ +
H+ +
孤电子对
铵根离子的形成过程
氨分子中有孤对电子
氢离子有1S空轨道
重叠,形成配位键。
配
位
键
的
形
成
条
件
1.条件
一方A提供孤电子对,另一方B提供能够接受孤
电子对的空轨道。
2.表示
用符号A→B表示
练习:1.写出NH4+和H3O+中配位键的表示方法。
2.NH4+中的配位键和其他N-H有何异同?
物质 是否含有配位键 提供空轨道 提供孤电子对
KCl
NaOH
[Ag(NH3)2]+
下列物质中,哪些含有配位键?提供空轨道和提供孤电子对的微粒是?
否
否
有
Ag+
N
以下物质都属于配位化合物,请大家研究它们的共同点,总结出什么是配位化合物。
思考:结合上述配合物的实例,分析NH4Cl是配合物吗?
配位化合物
定义
形成条件
把能接受孤电子对的空轨道的金属离子(或原子)与某些提供孤电子对的分子或离子以配位键结合形成的化合物成为配位化合物,简称配合物。
有能接受孤电子对的空轨道的金属离子或原子;
有提供孤电子对的分子或离子。
[Ag(NH3)2]NO3
配
位
数
中
心
离
子
配
位
体
外界(离子)
内界(配离子)
硝酸二氨合银
[Ag(NH3)2]NO3 == [Ag(NH3)2]++NO3-
提供孤电子对
提供空轨道
注意:
内界与外界之间的化学键是离子键。
内界通常较稳定,中心体和配体通常难以电离。
K4[Fe(CN)6]
配
位
数
中
心
离
子
配
位
体
内界(配离子)
外界(离子)
提供孤电子对
提供空轨道
亚铁氰化钾
K4[Fe(CN)6] = 4K++[Fe(CN)6]4-
注意:
内界与外界之间的化学键是离子键。
内界通常较稳定,中心体和配体通常难以电离。
食盐有毒吗?
K4[Fe(CN)6]
抗结剂
从原理上说,氰化物可以通过接触皮肤和腔道粘膜、呼吸吸入、口服、注射等各种途径进入人体,然后解离出氰基离子。这种离子能与人体中细胞色素酶内的三价铁离子(Fe 3+)牢牢地结合,从而使得它不再能变为二价铁离子(Fe 2+),从而导致细胞内一系列的生化反应不能继续进行,使细胞不能再利用血液中的氧气而迅速窒息。同时,因为缺乏呼吸作用产生的能量(ATP),中枢神经系统会迅速丧失功能,继而使人体出现呼吸肌麻痹、心跳停止、多脏器衰竭等症状而迅速死亡。
亚铁氰化钾在高温环境下容易分解为氰化钾,此反应的温度条件是400摄氏度。
我们日常烹调温度根本无法达到,最高温度也不会超过340摄氏度;温度达不到,也就根本不会分解出氰化钾物质。
1.下列配合物的水溶液中加入硝酸银不能生成沉淀的是( )A.[Co(NH3)4Cl2]Cl B.[Co(NH3)6]Cl3C.[Cu(NH3)4]Cl2 D.[Co(NH3)3Cl3]
D
中心体
提供能够接受孤电子对的空轨道的原子
或离子,多为金属,常见的是过渡金属,如:Fe、Ni、Fe3+、Ag+、Cu2+、Zn2+等
配体
1.提含有孤电子对的原子、分子或离子。
2.原子常为VA、VIA、VIIA族元素的原子。
3.分子:如H2O、NH3、CO等。
4.阴离子:如X-、OH-、SCN-、CH3COO-、CN-等。
配位原子
配体中直接与中心体键合的原子,都具有孤电子对,如C、N、O、S、P、X等。
配位数
直接与中心体键合的配位原子的数目。
思考:配体中原子都具有孤电子对,如何判断谁是配位原子?
思考:配体数目与配位数一定相等吗?
单齿配体
多齿配体(螯合物)
在配位化学及其应用领域做出重要贡献的我国著名化学家
唐敖庆教授是我国现代理论化学的开拓者和奠基人。他从20世纪 60 年代起系统地开展配位场理论的研究;70年代,进行了配合化学模拟生物固氮作用的研究,开展了分子氮配位作用的化学键理论研究,其"配位场理论方法"获 1982 年国家自然科学奖一等奖。
徐光宪教授长期从事物理化学和无机化学的教学及研究,涉及量子化学、化学键理论、配位化学、萃取化学、核燃料化学和稀土科学等领域。基于对稀土化学键、配位化学和物质结构等基本规律的深刻认识,他发现了稀土溶剂萃取体系具有"恒定混合萃取比"基本规律。20世纪 70年代,他建立了具有普适性的串级萃取理论,极大提升了利用配合│物萃取分离稀土元素的效率,为我国稀土工业的发展做出了突出贡献,获得 2008 年度"国家最高科学技术奖"。
2.(2020山东)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Cd2+配合物的结构如下图所示,1mol该配合物中通过螯合作用形成的配位键有 mol。
6
3.已知血红蛋白分子中含有配位键,请指出Fe和N形成的四个化学键中哪些是配位键?
实验目的
实验用品
制备简单的配合物,体验配合物应用。
0.1 mol·L-1AgNO3溶液,0.1 mol·L-1CuSO4溶液,1 mol·L-1盐酸,1 mol·L-1硝酸,1 mol·L-1NaCl溶液,1 mol·L-1NaOH溶液,浓氨水,10%葡萄糖溶液,氯化铜固体,氯化铁固体,硝酸铁固体,蒸馏水;
试管,胶头滴管。
实验方案设计与实施
蓝色
黄绿色
实验任务 实验过程与现象 结论
1.探究氯化铜固体在溶解并稀释过程中所发生的变化
2.分别以氯化铁和硝酸铁为原料,探究Fe3+溶液显色的原因
3.制备[Ag(NH3)2]+并用于与葡萄糖反应得到银镜
4.对比Cu2+与氨水和OH-反应的差异
分组实验
1、2组做实验1
3、4组做实验2
5、6组做实验3
7、8组做实验4
要求:
小组人员分工合作,注意实验中的试剂的使用剂量,尽量做到节约环保。
[CuCl4]2- [Cu(NH3)4]2+ [Fe(H2O)6]3+ [Fe(H2O)6-n(OH)n]3-n [FeCl4]-
黄绿色 深蓝色 无色 黄色 黄色
实验1.向试管中加入少量氯化铜粉末,然后加水溶解,再逐渐加水稀释,边加边振荡,观察现象。
现象:CuCl2(s) 黄绿色溶液
水
水
蓝色溶液
结论:
[CuCl4]2-+4H2O [Cu(H2O)4]2++4Cl-
黄绿 蓝色
思考:溶液呈现黄绿色和蓝色,说明溶液中分别存在了什么微粒?
由于溶液浓度的改变,引起平衡移动,导致配离子发生转变,从而使溶液颜色发生变化。
配合物存在形式受浓度的影响
实验2.分别以氯化铁和硝酸铁为原料,探究Fe3+溶液显色的原因
结论:
配合物的形成与配体的种类有关。
不同的配合物耐酸程度不同,从而影响其存在形式。
如何设计实验操作?
① Fe3+水解并与OH-配位 [Fe(H2O)6-n(OH)n]3-n,使溶液显示黄色。
加入硝酸,氢离子浓度增加,平衡左移,溶液主要以[Fe(H2O)6]3+存在,退为无色。
[Fe(H2O)6]3++nH2O [Fe(H2O)6-n(OH)n]3-n+nH3O+
现象:FeCl3(s) 黄色溶液
硝酸
水
黄色溶液
结论:
② 氯化铁溶液中形成黄色配离子[FeCl4]-。加酸酸化也不分解。
现象:Fe(NO3)3(s) 黄色溶液
硝酸
水
黄色退去
氯化钠
黄色溶液
实验3.制备[Ag(NH3)2]+并用于与葡萄糖反应制备银镜
配合物可用于制备物质。
结论:
Ag++NH3·H2O = AgOH↓+NH4+
AgOH+2NH3·H2O = [Ag(NH3)2]++ OH- + 2H2O
[Ag(NH3)2]OH与葡萄糖反应产生银镜。
现象:AgNO3(aq) 白色沉淀
浓氨水
浓氨水
沉淀溶解
葡萄糖
水浴加热
银镜
实验4.探究Cu2+与氨水和OH-反应的差异。
结论:
如何设计实验操作?
现象:CuSO4(aq) 蓝色沉淀
氨水
氨水
深蓝色溶液
现象:CuSO4(aq) 蓝色沉淀
氢氧化钠
氢氧化钠
蓝色溶液
①Cu2++2NH3·H2O ==Cu(OH)2↓+2NH4+
②Cu(OH)2+ 4NH3·H2O == [Cu(NH3)4]2++2OH-+4H2O
①Cu2++2OH-==Cu(OH)2↓
②Cu(OH)2+2OH-== [Cu(OH)4]2-
配合物存在形式受配体的影响。
实验任务 操作 现象 结论
1.探究氯化铜固体在溶解并稀释过程中所发生的变化 取少量氯化铜固体于一支试管中,向其中逐滴加入蒸馏水至过量,观察实验现象
实验任务 操作 现象 结论
2.分别以氯化铁和硝酸铁为原料,探究Fe3+溶液显色的原因 将少量的氯化铁和硝酸铁固体溶解在水中。
取1mL硝酸铁溶液于试管中,向其中加入2滴稀硝酸
取2mL氯化铁溶液于试管中,向其中加入3滴稀硝酸
将硝酸铁溶液分为2份,一份加入3滴氯化钠溶液,另一份加入3滴硝酸钠溶液
实验任务 操作 现象 结论
归纳配合物的应用
(1)物质检验
Fe3+的检验
Fe3+ + nSCN- → [Fe(SCN)n]3-n (n=1 ~ 6)
(2)物质制备
制备银氨溶液用于制镜工业
(3)参与生命活动
生命体中,许多酶与金属离子的配合物有关
(4)用于尖端技术、医药科学、催化反应和材料化学等领域
为什么CO会使人中毒?如果你遇到这种情况应该怎么做?
与Fe2+结合能力:
CO>O2
配位键
配合物
应用
宏观辨识与微观探析
科学探究与创新意识
科学态度与社会责任
