鲁科版高中化学选择性必修2第1章原子结构与元素性质1.3.1原子半径及其变化规律课件(18张)
文档属性
| 名称 | 鲁科版高中化学选择性必修2第1章原子结构与元素性质1.3.1原子半径及其变化规律课件(18张) |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-11 14:09:55 | ||
图片预览





文档简介
(共18张PPT)
知识回顾
在元素周期表中,随着原子序数的递增,元素基态原子的核外电子排布呈现周期性变化,元素的性质也呈现周期性变化。那么,元素哪些性质呈现周期性变化 元素性质周期性变化的本质是什么 如何运用元素周期表推测元素的基本性质
联想质疑
原子半径
原子的核外电子排布呈现周期性变化
元素的性质呈现周期性变化
化合价
得失电子能力
金属性和非金属性
原子半径是如何测定的?
追根寻源
测定原子半径的方法很多。常用的一种方法是根据固态单质的密度算出1mol原子的体积,再除以阿伏加德罗常数,得到一个原子在固态单质中平均占有的体积,进而得到其原子半径。
原子半径的测定方法
另一种更常用的方法是,指定化合物中两个相邻原子的核间距为两个原子的半径之和,再通过实验来测定分子或固体中原子的核间距,从而求得相关原子的原子半径。有关书籍和手册上提供的原子半径通常是用第二种方法测定的。利用这种方法测得的原子半径有三种∶ 一是共价半径,由共价分子或共价晶体中原子的核间距计算得出;二是是范德华半径,由分子晶体中共价分子之间的最短距离计算得出;三是金属半径,由金属晶体中原子之间的最短距离计算得出。
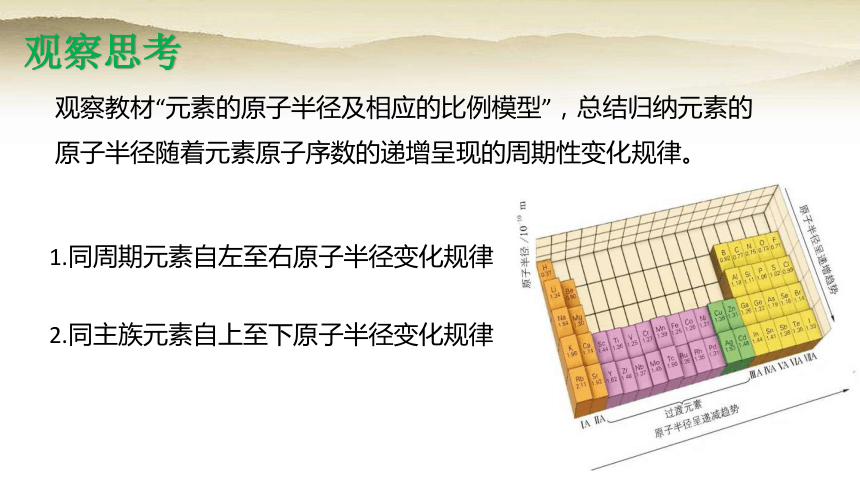
观察思考
观察教材“元素的原子半径及相应的比例模型”,总结归纳元素的原子半径随着元素原子序数的递增呈现的周期性变化规律。
1.同周期元素自左至右原子半径变化规律
2.同主族元素自上至下原子半径变化规律
(1)主族元素
同一周期从左到右,原子半径逐渐减小。
同一主族自上到下,原子半径逐渐增大。
增加电子产生的电子间的排斥作用小于核电荷数增加导致的核对外层电子的吸引作用
核电荷数增加导致的核对外层电子的吸引作用小于增加电子产生的电子间的排斥作用
同一周期自左至右原子半径逐渐减小,但变化幅度不大。
原因是同一周期过渡元素增加的电子都分布在(n-1)d轨道上,电子间的排斥作用与核对电子的吸引作用大致相当。
(2)过渡元素
1.影响原子半径大小的因素是什么?
2.同一周期原子半径自左至右逐渐减小,同一周期(如第3周期)离子半径是否逐渐减小?
3.同一主族原子半径自上而下逐渐增大,同一主族离子半径是否逐渐增大?
交流研讨
原子的核电荷数和电子层数。
否
S2->Cl->Na+>Mg2+>Al3+
是
迁移应用
已知An+、B(n+1)+、Cn-、D(n+1)-都具有相同的电子层结构,则A、B、C、D的原子半径由大到小的顺序是______________________,离子半径由大到小的顺序是__________________________,
原子序数由大到小的顺序是________________________。
A>B>D>C
D>C>A>B
B>A>C>D
归纳总结
1.影响微粒半径的因素主要是核电荷数和电子层数。
2.阳离子半径小于对应的原子半径,阴离子半径大于对应的原子半径,
3.电子层结构相同的离子,随核电荷数增大,离子半径减小,
4.不同价态的同种元素的离子,核外电子多的半径大,
同周期中,核电荷数越大,半径越小;同主族中,电子层数越多,半径越大。
如r(Na+)<r(Na),r(S)<r(S2-)。
如r(S2-)>r(Cl-)>r(K+)>r(Ca2+)。
如r(Fe2+)>r(Fe3+),r(Cu+)>r(Cu2+)。
思考
元素周期表中元素原子得失电子能力呈现的递变规律是什么?如何利用原子半径和价电子数进行解释?
同周期自左至右元素原子得失电子
同主族自上至下元素原子得失电子
元素原子得失电子能力递变规律
同周期元素原子的电子层数相同,从左到右原子半径逐渐减小,原子核对外层电子的吸引作用逐渐增强。
同主族元素原子的价电子数相同,但自上而下原子半径逐渐增大,原子核对外层电子的吸引作用逐渐减弱。
失电子能力逐渐减弱,得电子能力逐渐增强
失电子能力逐渐增强
得电子能力逐渐减弱
位于元素周期表中金属与非金属元素分界线周围元素的原子获得或失去电子的能力都不强。
回顾思考
单质与水或酸反应置换出氢气的难易程度
最高价氧化物对应水化合物碱性的强弱
单质与氢气反应的难易程度
形成气态氢化物的稳定性
最高价氧化物对应水化物酸性强弱
归纳总结
项目 同周期(从左→右) 同主族(从上→下)
原子核外电子排布 电子层数相同,最外层电子数逐渐增多,1→7(第1周期1→2) 最外层电子数相同,
电子层数递增
原子半径 逐渐减小(0族除外) 逐渐增大
元素主要化合价 最高正价由+1→+7,
最低负价由-4→-1 最高正价=主族序数(氟、氧除外),
非金属最低负价=主族序数-8(氢除外)
原子得、失电子能力 得电子能力逐渐增强,
失电子能力逐渐减弱 得电子能力逐渐减弱,
失电子能力逐渐增强
元素金属性、非金属性 金属性逐渐减弱
非金属性逐渐增强 金属性逐渐增强
非金属性逐渐减弱
元素性质递变规律
迁移应用
运用元素周期律,判断下列语句,其中正确的是 。
①碱金属单质的熔点随原子序数的增大而降低
②砹(At)是ⅦA族,其氢化物的稳定性小于HCl
③根据同周期元素的失电子能力变化趋势,推出Al的金属性比Mg大
④第2周期非金属元素的气态氢化物溶于水后,水溶液均为酸性
⑤铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应
⑥若X+和Y2-的核外电子层结构相同,则原子序数:X>Y
①②⑥
课堂小结
原子半径及其变化规律
同周期自左至右半径依次减小
同主族自上至下半径依次增大
得电子能力逐渐增强
失电子能力逐渐减弱
得电子能力逐渐减弱
失电子能力逐渐增强
原子核对逐渐外层电子吸引力增强
原子核对外层电子吸引力逐渐减弱
知识回顾
在元素周期表中,随着原子序数的递增,元素基态原子的核外电子排布呈现周期性变化,元素的性质也呈现周期性变化。那么,元素哪些性质呈现周期性变化 元素性质周期性变化的本质是什么 如何运用元素周期表推测元素的基本性质
联想质疑
原子半径
原子的核外电子排布呈现周期性变化
元素的性质呈现周期性变化
化合价
得失电子能力
金属性和非金属性
原子半径是如何测定的?
追根寻源
测定原子半径的方法很多。常用的一种方法是根据固态单质的密度算出1mol原子的体积,再除以阿伏加德罗常数,得到一个原子在固态单质中平均占有的体积,进而得到其原子半径。
原子半径的测定方法
另一种更常用的方法是,指定化合物中两个相邻原子的核间距为两个原子的半径之和,再通过实验来测定分子或固体中原子的核间距,从而求得相关原子的原子半径。有关书籍和手册上提供的原子半径通常是用第二种方法测定的。利用这种方法测得的原子半径有三种∶ 一是共价半径,由共价分子或共价晶体中原子的核间距计算得出;二是是范德华半径,由分子晶体中共价分子之间的最短距离计算得出;三是金属半径,由金属晶体中原子之间的最短距离计算得出。
观察思考
观察教材“元素的原子半径及相应的比例模型”,总结归纳元素的原子半径随着元素原子序数的递增呈现的周期性变化规律。
1.同周期元素自左至右原子半径变化规律
2.同主族元素自上至下原子半径变化规律
(1)主族元素
同一周期从左到右,原子半径逐渐减小。
同一主族自上到下,原子半径逐渐增大。
增加电子产生的电子间的排斥作用小于核电荷数增加导致的核对外层电子的吸引作用
核电荷数增加导致的核对外层电子的吸引作用小于增加电子产生的电子间的排斥作用
同一周期自左至右原子半径逐渐减小,但变化幅度不大。
原因是同一周期过渡元素增加的电子都分布在(n-1)d轨道上,电子间的排斥作用与核对电子的吸引作用大致相当。
(2)过渡元素
1.影响原子半径大小的因素是什么?
2.同一周期原子半径自左至右逐渐减小,同一周期(如第3周期)离子半径是否逐渐减小?
3.同一主族原子半径自上而下逐渐增大,同一主族离子半径是否逐渐增大?
交流研讨
原子的核电荷数和电子层数。
否
S2->Cl->Na+>Mg2+>Al3+
是
迁移应用
已知An+、B(n+1)+、Cn-、D(n+1)-都具有相同的电子层结构,则A、B、C、D的原子半径由大到小的顺序是______________________,离子半径由大到小的顺序是__________________________,
原子序数由大到小的顺序是________________________。
A>B>D>C
D>C>A>B
B>A>C>D
归纳总结
1.影响微粒半径的因素主要是核电荷数和电子层数。
2.阳离子半径小于对应的原子半径,阴离子半径大于对应的原子半径,
3.电子层结构相同的离子,随核电荷数增大,离子半径减小,
4.不同价态的同种元素的离子,核外电子多的半径大,
同周期中,核电荷数越大,半径越小;同主族中,电子层数越多,半径越大。
如r(Na+)<r(Na),r(S)<r(S2-)。
如r(S2-)>r(Cl-)>r(K+)>r(Ca2+)。
如r(Fe2+)>r(Fe3+),r(Cu+)>r(Cu2+)。
思考
元素周期表中元素原子得失电子能力呈现的递变规律是什么?如何利用原子半径和价电子数进行解释?
同周期自左至右元素原子得失电子
同主族自上至下元素原子得失电子
元素原子得失电子能力递变规律
同周期元素原子的电子层数相同,从左到右原子半径逐渐减小,原子核对外层电子的吸引作用逐渐增强。
同主族元素原子的价电子数相同,但自上而下原子半径逐渐增大,原子核对外层电子的吸引作用逐渐减弱。
失电子能力逐渐减弱,得电子能力逐渐增强
失电子能力逐渐增强
得电子能力逐渐减弱
位于元素周期表中金属与非金属元素分界线周围元素的原子获得或失去电子的能力都不强。
回顾思考
单质与水或酸反应置换出氢气的难易程度
最高价氧化物对应水化合物碱性的强弱
单质与氢气反应的难易程度
形成气态氢化物的稳定性
最高价氧化物对应水化物酸性强弱
归纳总结
项目 同周期(从左→右) 同主族(从上→下)
原子核外电子排布 电子层数相同,最外层电子数逐渐增多,1→7(第1周期1→2) 最外层电子数相同,
电子层数递增
原子半径 逐渐减小(0族除外) 逐渐增大
元素主要化合价 最高正价由+1→+7,
最低负价由-4→-1 最高正价=主族序数(氟、氧除外),
非金属最低负价=主族序数-8(氢除外)
原子得、失电子能力 得电子能力逐渐增强,
失电子能力逐渐减弱 得电子能力逐渐减弱,
失电子能力逐渐增强
元素金属性、非金属性 金属性逐渐减弱
非金属性逐渐增强 金属性逐渐增强
非金属性逐渐减弱
元素性质递变规律
迁移应用
运用元素周期律,判断下列语句,其中正确的是 。
①碱金属单质的熔点随原子序数的增大而降低
②砹(At)是ⅦA族,其氢化物的稳定性小于HCl
③根据同周期元素的失电子能力变化趋势,推出Al的金属性比Mg大
④第2周期非金属元素的气态氢化物溶于水后,水溶液均为酸性
⑤铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应
⑥若X+和Y2-的核外电子层结构相同,则原子序数:X>Y
①②⑥
课堂小结
原子半径及其变化规律
同周期自左至右半径依次减小
同主族自上至下半径依次增大
得电子能力逐渐增强
失电子能力逐渐减弱
得电子能力逐渐减弱
失电子能力逐渐增强
原子核对逐渐外层电子吸引力增强
原子核对外层电子吸引力逐渐减弱
