鲁科版高中化学选择性必修2第1章原子结构与元素性质1.3.2元素的电离能、电负性及其变化规律课件(22张)
文档属性
| 名称 | 鲁科版高中化学选择性必修2第1章原子结构与元素性质1.3.2元素的电离能、电负性及其变化规律课件(22张) |

|
|
| 格式 | ppt | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-11 20:01:04 | ||
图片预览







文档简介
(共22张PPT)
知识回顾
1.原子半径
同一周期从左到右原子半径逐渐 ;
同一主族从上到下原子半径逐渐 。
2.得失电子能力
同一周期从左到右失电子能力逐渐 ,得电子 。
同一主族从上到下失电子能力逐渐 ,得电子 。
减小
增大
减弱
增强
增强
减弱
3.金属性
非金属性
同一周期从左到右金属性逐渐 ,非金属性 。
同一主族从上到下金属性逐渐 ,非金属性 。
减弱
增强
增强
减弱
为满足科学研究和生产实践的需要,对原子得失电子的能力仅有定性的分析往往是不够的,因此人们不断尝试寻找能定量地衡量或比较原子得失电子能力的方法。不过,在化学变化中伴随着不同原子核外电子之间的相互作用等复杂过程的发生,要想借助化学变化来确立定量描述某种原子得失电子能力的参数并不容易。请你充分发挥想象力,尝试找到解决这个问题的思路。
联想质疑
二、元素的电离能及其变化规律
1.电离能定义
气态基态原子或气态基态离子失去一个电子所需要的最小能量称为电离能
符号:
单位:
kJ·mol-1
I
M(g)= M+ (g)+e-
I1
M2+(g)= M3+ (g)+e-
I3
M+(g)= M2+ (g)+e-
I2
第一电离能
第二电离能
第三电离能
第一电离能:元素原子失去一个电子的电离能,常用符号I1表示;
如:钠元素I1=496KJ/mol是指Na(g)= Na+(g)+e-时所需的最小能量为496KJ/mol。
含义:处于基态的气态原子失去一个电子,生成+1价气态阳离子所需的最小能量。
第二电离能:
元素原子失去一个电子后,再失去一个电子的电离能,常用符号 I2表示;
第三电离能(I3)
……
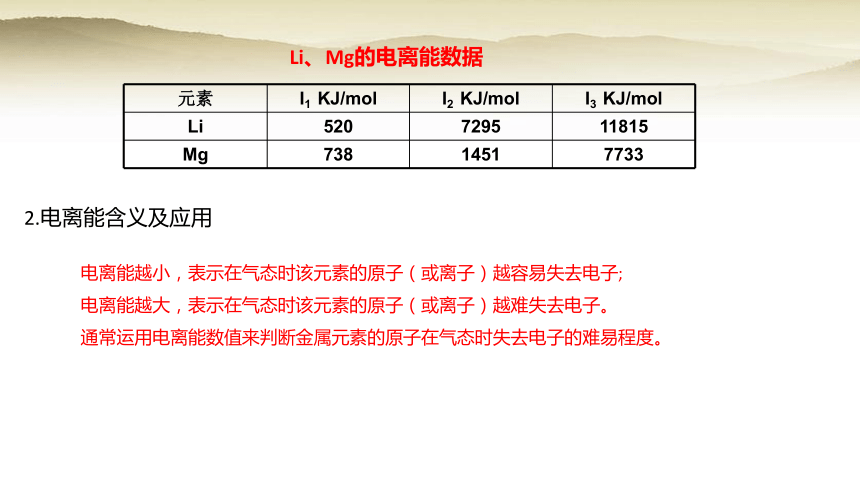
同一原子的各级电离能之间存在如下关系:I1电离能越小,表示在气态时该元素的原子(或离子)越容易失去电子;
电离能越大,表示在气态时该元素的原子(或离子)越难失去电子。
通常运用电离能数值来判断金属元素的原子在气态时失去电子的难易程度。
2.电离能含义及应用
Li、Mg的电离能数据
元素 I1 KJ/mol I2 KJ/mol I3 KJ/mol
Li 520 7295 11815
Mg 738 1451 7733
思考
为什么锂元素易形成Li+,而不易形成Li2+;镁元素易形成Mg2+,而不易形成Mg3+?
Li原子最外层一个电子,第一电离能小,容易失去,第二电离能为次外层电子不易失去;
Mg原子最多外层两个电子,第一和第二电离能远大于此外层的第三电离能,易失去两个电子。
当相邻逐级电离能突然变大时,说明其电子层发生变化,即同一电子层中电离能相近,不同电子层中电离能有很大的差距。
观察图1-3-4,请你说明元素的第一电离能随着元素原子序数的递增呈现怎样的变化规律,并从原子结构的角度加以解释。
观察思考
同周期元素电离能变化规律?
同主族元素电离能变化规律?
(1)同一周期的元素,碱金属元素的第一电离能最小,稀有气体元素的第一电离能最大;
从左到右,元素的第一电离能在总体上呈现从小到大的变化趋势,表示元素原子越来越难失去电子。
3.电离能变化规律
原因:
同周期元素原子电子层数相同,但随着核电荷数增大,原子核对外层电子的有效吸引作用增强。
思考:
第二周期Be第一电离能大于B,N大于O;第三周期Mg大于Al,P大于S的原因是什么?
Be:1S2 2S22P0 (B:1S2 2S22P1)
N:1S2 2S22P3 (O:1S2 2S22P4)
Mg:1S2 2S22P6 3S23P0 (Al:1S2 2S22P6 3S23P1)
P:1S2 2S22P6 3S23P3 (S:1S2 2S22P6 3S23P4)
(2)同主族元素,自上而下第一电离能逐渐减小,表明自上而下原子越来越容易失去电子。
原因:
同主族元素原子的价电子数相同,原子半径逐渐增大,原子核对外层电子的有效吸引作用逐渐减弱。
(3)过渡元素的第一电离能的变化不太规则,对同一周期的元素而言,总体上随元素原子序数的增加第一电离能从左到右略有增加。
原因:
对过渡元素的原子来说,增加的电子大部分排布在(n-1)d或(n-2)f轨道上,原子核对外层电子的有效吸引作用变化不是太大。
判断下列元素间的第一电离能的大小:
Na K; O N; N P;
F Ne; Mg Al; S P;
Cl S; Cl Ar。
迁移应用
>
<
<
>
<
>
>
<
金属活动性顺序为K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、 Pt、Au。该顺序表示从K 到 Au,在水溶液中金属单质中的原子失去电子越来越困难。金属元素的电离能是指金属元素原子(或离子)在气态时失去电子成为气态阳离子的能力,它是金属元素原子(或离子 )在气态时活泼性的量度。
因为金属活动性顺序与电离能所对应的条件不同,所以二者不可能完全一致。例如,钠元素的第一电离能为 496 kJ·mol-1,钙元素的第一电离能和第二电离能分别为 590 kJ·mol-1、 1145 kJ·mol-1,表明气态钠原子比气态钙原子更容易失去电子,更加活泼。但是,因为 Ca2+形成水合离子时放出的能量(1653kJ·mol-1)远比Na+形成水合离子时放出的能量(405kJ·mol-1)多,所以在水溶液里钙原子比钠原子更容易失去电子,即在金属活动性顺序中钙排在钠的前面。由此可以看出,我们用某种规律分析问题时一定要注意具体条件。
追根寻源
金属的活动性顺序与金属元素电离能的大小顺序为什么不一致
电子亲和能反映的是气态原子结合电子的难易程度。元素的气态原子(或离子)获得一个电子所放出的能量称为电子亲和能,单位为kJ·mol-1。习惯上规定,体系放出能量时电子亲和能为正,体系吸收能量时电子亲和能为负。
电子亲和能的大小反映了气态原子获得电子成为气态阴离子的难易程度。无论在同一周期中还是在同一族中,电子亲和能没有表现出简单的变化规律。此外,电子亲和能的数据不易测定,准确性较差,来自不同文献的数据往往不同,因此电子亲和能的应用远不如电离能广泛。
拓展视野
部分元素的第一电子亲和能
鲍林与电负性
尽管电离能(或电子亲和能)为理解元素性质及其周期性变化提供了工具,但因为其反映的是气态原子得失电子的难易程度,当用于描述物质中不同原子吸引电子的能力、物质中原子的电荷分布等情况时会有较大偏差。因此,化学家尝试对已经测得的物理量进行组合和数学处理,以获得能更好反映变化规律的参数。
美国化学家鲍林在研究化学键键能的过程中发现,对于同核双原子分子,化学键的键能会随着原子序数的变化而发生变化,为了半定量或定性描述各种化学键的键能以及其变化趋势,鲍林于1932年首先提出了用以描述原子核对电子吸引能力的电负性概念,并且提出了定量衡量原子电负性的计算公式。电负性这一概念简单、直观、物理意义明确并且不失准确性,至今仍获得广泛应用,是描述元素化学性质的重要指标之一。
三、元素的电负性及其变化规律
1.电负性定义
元素的电负性越大,其原子在化合物中吸引电子的能力越强;
元素的电负性越小,其原子在化合物中吸引电子的能力越弱。
2.电负性意义
3.电负性变化规律
(1)主族元素,同一周期从左到右,元素的电负性递增;
(2)同一主族自上而下,元素的电负性递减。
(3)电负性大的元素集中在元素周期表的右上角,电负性小的元素集中在元素周期表的左下角。
用来描述两个不同原子在形成化学键时吸引电子能力的相对强弱。
电负性标度的建立是为了量度原子对成键电子吸引能力的相对大小。基于建立模型的不同思路和方法,可以有不同的电负性标度。
鉴于电子亲和能数据的缺乏,鲍林建议用两种元素的原子形成化合物时的生成热的数值来计算电负性,并选定氟的电负性为4.0,进而计算出其他元素的电负性数值。电负性是相对值,所以没有单位。1934年,马利肯布(R.Mulliken)则建议用第一电离能和第一电子亲和能之和来衡量原子的电负性。1957年,阿莱(A.Allred)和罗周(E.Rochow)根据原子核对价层电子的引力来计算拟合电负性。其中,鲍林标度由于提出最早、数据易得、使用方便,是应用最广泛的标度方式。元素电负性因有不同的标度而有不同的数据,在讨论问题时要注意使用同一标度下的数据。
资料在线
至今化学家建立电负性标度的方法还在不断更新。例如,2019 年拉姆(M.Rahm)等人将电负性定义为价电子的平均结合能,由此得到了从氢到锡共96 种元素的电负性,而且这个概念还可扩展到分子或者基团中。
4.电负性应用
(1)判断元素活泼性
(2)判断化合物中元素化合价正负
(3)判断化学键的性质
金属元素:电负性<2
非金属元素:电负性>2
电负性越大,非金属元素越活泼。
氟的电负性为4.0,是最活泼的非金属元素;
钫的电负性为0.7,是活泼的金属元素
电负性性差值大的元素原子之间形成的化学键主要是离子键。
电负性相同或差值小的非金属元素原子之间形成的化学键主要是共价键。
迁移应用
比较下列元素电负性的大小。
(1)Li______Na,(2)O______F,(3)Si______P, (4)K______Ca,(5)Mg_____Al,(6)N______O。
>
1.同一周期从左到右,原子电子层数相同,核电荷数逐渐增大,原子半径逐渐减小,原子核对外层电子的有效吸引作用逐渐增强,电负性逐渐增大。2.同一主族从上到下,原子核电荷数增大,电子层数逐渐增加,原子半径逐渐增大,原子核对外层电子的有效吸引作用逐渐减弱,电负性逐渐减小。3.对副族而言,同族元素的电负性也大体呈现主族元素的变化趋势。因此,电负性大的元素集中在元素周期表的右上角,电负性小的元素位于元素周期表的左下角。4.非金属元素的电负性一般比金属元素的电负性大。5.二元化合物中,显负价的元素的电负性更大。6.不同周期、不同主族两种元素电负性的比较可找第三种元素(与其中一种位于同主族或同周期)进行参照。
归纳总结
比较元素电负性大小的方法
元素的原子半径、第一电离能、电负性等从不同角度对元素性质进行了描述,请你利用教材中所给出的短周期元素的原子半径、第一电离能及电负性数据,通过作图寻找它们之间的关系和规律,以及它们与金属活动性顺序之间的关系。基于图象对这些关系和规律进行描述和讨论,并与同学分享你的体会。
交流研讨
方法引导
如何寻找数据之间的关 系
寻找数据之间的关系时,可以借鉴数学中研究函数的思路,首先确定自变量,再选取因变量,并运用函数图像表示出自变量与因变量之间的关系。例如,在本活动中可以选取原子序数作为自变量,将原子半径、第一电离能、电负性等分别作为因变量;也可以建立这些参数按周期、主族或金属活动性顺序变化的规律。作图观察、分析这些数据之间的关系。图1-3-6给出了电负性与金属活动性顺序之间的关系。
随着原子序数的递增,原子半径、第一电离能、电负性均呈现周期性变化。同周期原子序数增大,原子半径逐渐减小,第一电离能趋于增大(有起伏),电负性逐渐增大。
归纳总结
项目 同周期(从左→右) 同主族(从上→下)
原子核外电子排布 电子层数相同,最外层电子数逐渐增多,1→7(第1周期1→2) 最外层电子数相同,
电子层数递增
原子半径 逐渐减小(0族除外) 渐增大
原子得、失电子能力 得电子能力逐渐增强,
失电子能力逐渐减弱 得电子能力逐渐减弱,
失电子能力逐渐增强
元素金属性、非金属性 金属性逐渐减弱
非金属性逐渐增强 金属性逐渐增强
非金属性逐渐减弱
电离能 逐渐增大的趋势,有起伏 逐渐减小
电负性 逐渐增大 逐渐减小
元素性质递变规律
课堂小结
电离能
电负性
定义
定义
变化规律
应用
变化规律
应用
气态基态原子或气态基态离子失去一个电子所需要的最小能量称为电离能
用来描述两个不同原子在形成化学键时吸引电子能力的相对强弱
同一周期从左到右,电负性逐渐增大。
同一主族,从上到下,电负性逐渐减小。
电负性大的元素集中在元素周期表的右上角,电负性小的元素位于元素周期表的左下角。
判断金属性和非金属性的强弱
判断化合物中元素化合价的正负
判断化学键的类型
判断金属元素的原子在气态时失去电子的难易程度。
同一周期从左到右,电离能有逐渐增大趋势,有起伏。
同一主族从上到下,电离能逐渐减小。
过渡元素的第一电离能的变化不太规则
知识回顾
1.原子半径
同一周期从左到右原子半径逐渐 ;
同一主族从上到下原子半径逐渐 。
2.得失电子能力
同一周期从左到右失电子能力逐渐 ,得电子 。
同一主族从上到下失电子能力逐渐 ,得电子 。
减小
增大
减弱
增强
增强
减弱
3.金属性
非金属性
同一周期从左到右金属性逐渐 ,非金属性 。
同一主族从上到下金属性逐渐 ,非金属性 。
减弱
增强
增强
减弱
为满足科学研究和生产实践的需要,对原子得失电子的能力仅有定性的分析往往是不够的,因此人们不断尝试寻找能定量地衡量或比较原子得失电子能力的方法。不过,在化学变化中伴随着不同原子核外电子之间的相互作用等复杂过程的发生,要想借助化学变化来确立定量描述某种原子得失电子能力的参数并不容易。请你充分发挥想象力,尝试找到解决这个问题的思路。
联想质疑
二、元素的电离能及其变化规律
1.电离能定义
气态基态原子或气态基态离子失去一个电子所需要的最小能量称为电离能
符号:
单位:
kJ·mol-1
I
M(g)= M+ (g)+e-
I1
M2+(g)= M3+ (g)+e-
I3
M+(g)= M2+ (g)+e-
I2
第一电离能
第二电离能
第三电离能
第一电离能:元素原子失去一个电子的电离能,常用符号I1表示;
如:钠元素I1=496KJ/mol是指Na(g)= Na+(g)+e-时所需的最小能量为496KJ/mol。
含义:处于基态的气态原子失去一个电子,生成+1价气态阳离子所需的最小能量。
第二电离能:
元素原子失去一个电子后,再失去一个电子的电离能,常用符号 I2表示;
第三电离能(I3)
……
同一原子的各级电离能之间存在如下关系:I1
电离能越大,表示在气态时该元素的原子(或离子)越难失去电子。
通常运用电离能数值来判断金属元素的原子在气态时失去电子的难易程度。
2.电离能含义及应用
Li、Mg的电离能数据
元素 I1 KJ/mol I2 KJ/mol I3 KJ/mol
Li 520 7295 11815
Mg 738 1451 7733
思考
为什么锂元素易形成Li+,而不易形成Li2+;镁元素易形成Mg2+,而不易形成Mg3+?
Li原子最外层一个电子,第一电离能小,容易失去,第二电离能为次外层电子不易失去;
Mg原子最多外层两个电子,第一和第二电离能远大于此外层的第三电离能,易失去两个电子。
当相邻逐级电离能突然变大时,说明其电子层发生变化,即同一电子层中电离能相近,不同电子层中电离能有很大的差距。
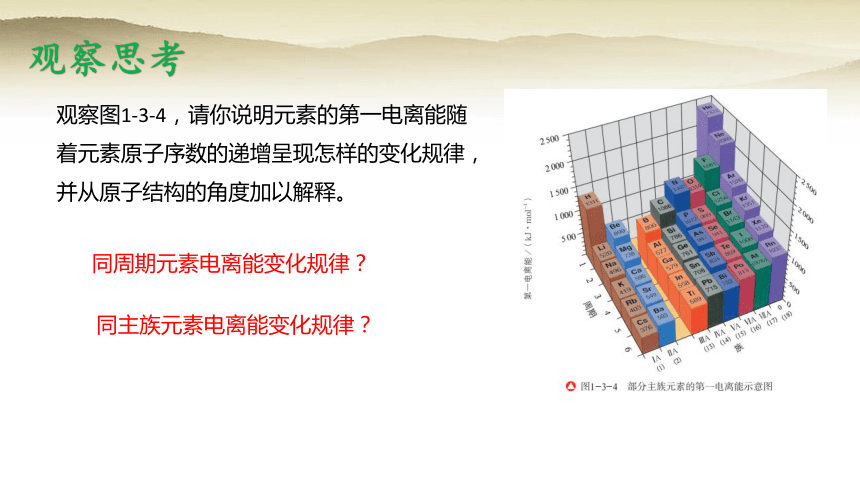
观察图1-3-4,请你说明元素的第一电离能随着元素原子序数的递增呈现怎样的变化规律,并从原子结构的角度加以解释。
观察思考
同周期元素电离能变化规律?
同主族元素电离能变化规律?
(1)同一周期的元素,碱金属元素的第一电离能最小,稀有气体元素的第一电离能最大;
从左到右,元素的第一电离能在总体上呈现从小到大的变化趋势,表示元素原子越来越难失去电子。
3.电离能变化规律
原因:
同周期元素原子电子层数相同,但随着核电荷数增大,原子核对外层电子的有效吸引作用增强。
思考:
第二周期Be第一电离能大于B,N大于O;第三周期Mg大于Al,P大于S的原因是什么?
Be:1S2 2S22P0 (B:1S2 2S22P1)
N:1S2 2S22P3 (O:1S2 2S22P4)
Mg:1S2 2S22P6 3S23P0 (Al:1S2 2S22P6 3S23P1)
P:1S2 2S22P6 3S23P3 (S:1S2 2S22P6 3S23P4)
(2)同主族元素,自上而下第一电离能逐渐减小,表明自上而下原子越来越容易失去电子。
原因:
同主族元素原子的价电子数相同,原子半径逐渐增大,原子核对外层电子的有效吸引作用逐渐减弱。
(3)过渡元素的第一电离能的变化不太规则,对同一周期的元素而言,总体上随元素原子序数的增加第一电离能从左到右略有增加。
原因:
对过渡元素的原子来说,增加的电子大部分排布在(n-1)d或(n-2)f轨道上,原子核对外层电子的有效吸引作用变化不是太大。
判断下列元素间的第一电离能的大小:
Na K; O N; N P;
F Ne; Mg Al; S P;
Cl S; Cl Ar。
迁移应用
>
<
<
>
<
>
>
<
金属活动性顺序为K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、 Pt、Au。该顺序表示从K 到 Au,在水溶液中金属单质中的原子失去电子越来越困难。金属元素的电离能是指金属元素原子(或离子)在气态时失去电子成为气态阳离子的能力,它是金属元素原子(或离子 )在气态时活泼性的量度。
因为金属活动性顺序与电离能所对应的条件不同,所以二者不可能完全一致。例如,钠元素的第一电离能为 496 kJ·mol-1,钙元素的第一电离能和第二电离能分别为 590 kJ·mol-1、 1145 kJ·mol-1,表明气态钠原子比气态钙原子更容易失去电子,更加活泼。但是,因为 Ca2+形成水合离子时放出的能量(1653kJ·mol-1)远比Na+形成水合离子时放出的能量(405kJ·mol-1)多,所以在水溶液里钙原子比钠原子更容易失去电子,即在金属活动性顺序中钙排在钠的前面。由此可以看出,我们用某种规律分析问题时一定要注意具体条件。
追根寻源
金属的活动性顺序与金属元素电离能的大小顺序为什么不一致
电子亲和能反映的是气态原子结合电子的难易程度。元素的气态原子(或离子)获得一个电子所放出的能量称为电子亲和能,单位为kJ·mol-1。习惯上规定,体系放出能量时电子亲和能为正,体系吸收能量时电子亲和能为负。
电子亲和能的大小反映了气态原子获得电子成为气态阴离子的难易程度。无论在同一周期中还是在同一族中,电子亲和能没有表现出简单的变化规律。此外,电子亲和能的数据不易测定,准确性较差,来自不同文献的数据往往不同,因此电子亲和能的应用远不如电离能广泛。
拓展视野
部分元素的第一电子亲和能
鲍林与电负性
尽管电离能(或电子亲和能)为理解元素性质及其周期性变化提供了工具,但因为其反映的是气态原子得失电子的难易程度,当用于描述物质中不同原子吸引电子的能力、物质中原子的电荷分布等情况时会有较大偏差。因此,化学家尝试对已经测得的物理量进行组合和数学处理,以获得能更好反映变化规律的参数。
美国化学家鲍林在研究化学键键能的过程中发现,对于同核双原子分子,化学键的键能会随着原子序数的变化而发生变化,为了半定量或定性描述各种化学键的键能以及其变化趋势,鲍林于1932年首先提出了用以描述原子核对电子吸引能力的电负性概念,并且提出了定量衡量原子电负性的计算公式。电负性这一概念简单、直观、物理意义明确并且不失准确性,至今仍获得广泛应用,是描述元素化学性质的重要指标之一。
三、元素的电负性及其变化规律
1.电负性定义
元素的电负性越大,其原子在化合物中吸引电子的能力越强;
元素的电负性越小,其原子在化合物中吸引电子的能力越弱。
2.电负性意义
3.电负性变化规律
(1)主族元素,同一周期从左到右,元素的电负性递增;
(2)同一主族自上而下,元素的电负性递减。
(3)电负性大的元素集中在元素周期表的右上角,电负性小的元素集中在元素周期表的左下角。
用来描述两个不同原子在形成化学键时吸引电子能力的相对强弱。
电负性标度的建立是为了量度原子对成键电子吸引能力的相对大小。基于建立模型的不同思路和方法,可以有不同的电负性标度。
鉴于电子亲和能数据的缺乏,鲍林建议用两种元素的原子形成化合物时的生成热的数值来计算电负性,并选定氟的电负性为4.0,进而计算出其他元素的电负性数值。电负性是相对值,所以没有单位。1934年,马利肯布(R.Mulliken)则建议用第一电离能和第一电子亲和能之和来衡量原子的电负性。1957年,阿莱(A.Allred)和罗周(E.Rochow)根据原子核对价层电子的引力来计算拟合电负性。其中,鲍林标度由于提出最早、数据易得、使用方便,是应用最广泛的标度方式。元素电负性因有不同的标度而有不同的数据,在讨论问题时要注意使用同一标度下的数据。
资料在线
至今化学家建立电负性标度的方法还在不断更新。例如,2019 年拉姆(M.Rahm)等人将电负性定义为价电子的平均结合能,由此得到了从氢到锡共96 种元素的电负性,而且这个概念还可扩展到分子或者基团中。
4.电负性应用
(1)判断元素活泼性
(2)判断化合物中元素化合价正负
(3)判断化学键的性质
金属元素:电负性<2
非金属元素:电负性>2
电负性越大,非金属元素越活泼。
氟的电负性为4.0,是最活泼的非金属元素;
钫的电负性为0.7,是活泼的金属元素
电负性性差值大的元素原子之间形成的化学键主要是离子键。
电负性相同或差值小的非金属元素原子之间形成的化学键主要是共价键。
迁移应用
比较下列元素电负性的大小。
(1)Li______Na,(2)O______F,(3)Si______P, (4)K______Ca,(5)Mg_____Al,(6)N______O。
>
1.同一周期从左到右,原子电子层数相同,核电荷数逐渐增大,原子半径逐渐减小,原子核对外层电子的有效吸引作用逐渐增强,电负性逐渐增大。2.同一主族从上到下,原子核电荷数增大,电子层数逐渐增加,原子半径逐渐增大,原子核对外层电子的有效吸引作用逐渐减弱,电负性逐渐减小。3.对副族而言,同族元素的电负性也大体呈现主族元素的变化趋势。因此,电负性大的元素集中在元素周期表的右上角,电负性小的元素位于元素周期表的左下角。4.非金属元素的电负性一般比金属元素的电负性大。5.二元化合物中,显负价的元素的电负性更大。6.不同周期、不同主族两种元素电负性的比较可找第三种元素(与其中一种位于同主族或同周期)进行参照。
归纳总结
比较元素电负性大小的方法
元素的原子半径、第一电离能、电负性等从不同角度对元素性质进行了描述,请你利用教材中所给出的短周期元素的原子半径、第一电离能及电负性数据,通过作图寻找它们之间的关系和规律,以及它们与金属活动性顺序之间的关系。基于图象对这些关系和规律进行描述和讨论,并与同学分享你的体会。
交流研讨
方法引导
如何寻找数据之间的关 系
寻找数据之间的关系时,可以借鉴数学中研究函数的思路,首先确定自变量,再选取因变量,并运用函数图像表示出自变量与因变量之间的关系。例如,在本活动中可以选取原子序数作为自变量,将原子半径、第一电离能、电负性等分别作为因变量;也可以建立这些参数按周期、主族或金属活动性顺序变化的规律。作图观察、分析这些数据之间的关系。图1-3-6给出了电负性与金属活动性顺序之间的关系。
随着原子序数的递增,原子半径、第一电离能、电负性均呈现周期性变化。同周期原子序数增大,原子半径逐渐减小,第一电离能趋于增大(有起伏),电负性逐渐增大。
归纳总结
项目 同周期(从左→右) 同主族(从上→下)
原子核外电子排布 电子层数相同,最外层电子数逐渐增多,1→7(第1周期1→2) 最外层电子数相同,
电子层数递增
原子半径 逐渐减小(0族除外) 渐增大
原子得、失电子能力 得电子能力逐渐增强,
失电子能力逐渐减弱 得电子能力逐渐减弱,
失电子能力逐渐增强
元素金属性、非金属性 金属性逐渐减弱
非金属性逐渐增强 金属性逐渐增强
非金属性逐渐减弱
电离能 逐渐增大的趋势,有起伏 逐渐减小
电负性 逐渐增大 逐渐减小
元素性质递变规律
课堂小结
电离能
电负性
定义
定义
变化规律
应用
变化规律
应用
气态基态原子或气态基态离子失去一个电子所需要的最小能量称为电离能
用来描述两个不同原子在形成化学键时吸引电子能力的相对强弱
同一周期从左到右,电负性逐渐增大。
同一主族,从上到下,电负性逐渐减小。
电负性大的元素集中在元素周期表的右上角,电负性小的元素位于元素周期表的左下角。
判断金属性和非金属性的强弱
判断化合物中元素化合价的正负
判断化学键的类型
判断金属元素的原子在气态时失去电子的难易程度。
同一周期从左到右,电离能有逐渐增大趋势,有起伏。
同一主族从上到下,电离能逐渐减小。
过渡元素的第一电离能的变化不太规则
