鲁科版高中化学选择性必修2第1章原子结构与元素性质1.5章末整合提升课件(18张)
文档属性
| 名称 | 鲁科版高中化学选择性必修2第1章原子结构与元素性质1.5章末整合提升课件(18张) |

|
|
| 格式 | ppt | ||
| 文件大小 | 1005.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-11 20:40:38 | ||
图片预览






文档简介
(共18张PPT)
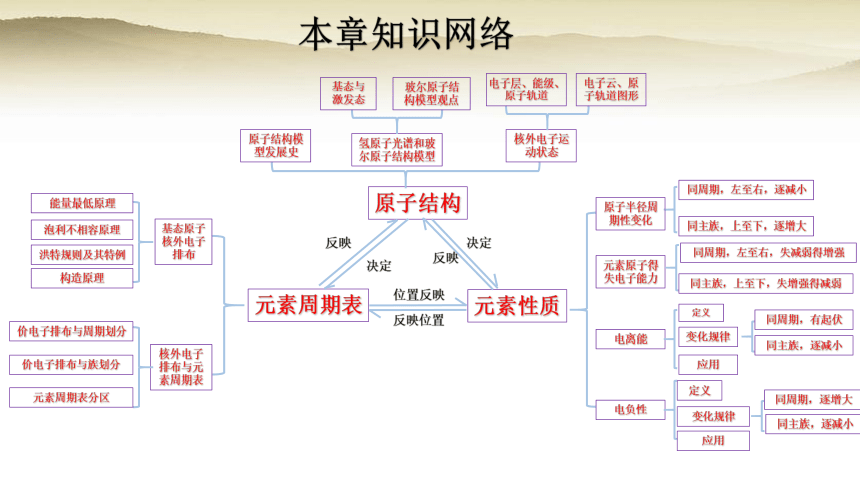
本章知识网络
元素周期表
原子结构
元素性质
基态原子核外电子排布
核外电子排布与元素周期表
能量最低原理
泡利不相容原理
洪特规则及其特例
构造原理
价电子排布与周期划分
价电子排布与族划分
元素周期表分区
元素原子得失电子能力
电离能
电负性
定义
变化规律
应用
定义
变化规律
应用
同周期,左至右,逐减小
同主族,上至下,逐增大
同周期,左至右,失减弱得增强
同主族,上至下,失增强得减弱
同周期,有起伏
同主族,逐减小
同周期,逐增大
同主族,逐减小
原子半径周期性变化
原子结构模型发展史
氢原子光谱和玻尔原子结构模型
核外电子运动状态
基态与激发态
玻尔原子结构模型观点
电子云、原子轨道图形
电子层、能级、原子轨道
考点一:能层、能级、原子轨道与原子运动状态
【例1】下列说法中正确的是( )
A.任何一个能层最多只有s、p、d、f四个能级
B.同一原子中,2p、3p、4p能级的轨道数依次增多
C.在一个多电子原子中,不可能有两个运动状态完全相同的电子
D.在一个多电子原子中,N层上的电子能量肯定比M层上的电子能量高
C
【解析】第5能层开始含有5个能级,A错误;不同电子层中p轨道均为3个,则同一原子中,2p、3p、4p能级的轨道数相同, B错误;在多电子的原子中,电子填充在不同的能层,能层又分不同的能级,同一能级又有不同的原子轨道,每个轨道中最多可以填充两个电子,自旋相反,在一个基态多电子的原子中,不可能有两个运动状态完全相同的电子,C正确;由构造原理得:3d轨道上电子的能量比4s轨道上的要高,D错误。
【解题指导】能层、能级、原子轨道与原子运动状态的关系
(1)同一能层,不同能级其原子轨道形状不同,数目不同;不同能层,同种能级其原子轨道形状相同,半径不同,能量不同。
(2)电子的运动状态与能层、能级、自旋状态有关,同一原子内部不存在两个运动状态完全相同的电子。
考点二:核外电子排布表示方法
【例2】下列化学用语的表达正确的是( )
A.原子核内有10个中子的氧原子:168O
B.氯原子的结构示意图:
C.Fe3+的最外层电子排布式:3s23p63d5
D.基态铜原子的外围电子轨道表示式:
↑↓
↑↓
↑↓
↑↓
3d
4s
↑↓
↑
C
【解析】原子核内有10个中子的氧原子应表示为 188O,A错误;
氯原子的结构示意图为 ,B错误;
Fe的原子序数是26,故Fe3+的最外层电子排布式为3s23p63d5,C正确;
铜的原子序数是29,基态铜原子的外围电子排布符合洪特规则的特例,外围电子轨道表示式为 ,D项错误。
↑↓
↑↓
↑↓
↑
3d
4s
↑↓
↑↓
【解题指导】核外电子的排布表示方法的常见误区
(1)当出现d轨道时,虽然电子按ns、(n-1)d,np的顺序填充,但在书写电子排布式时,仍把(n-1)d放在ns前,如Fe:1s22s22p63s23p63d64s2正确,Fe:1s22s22p63s23p64s23d6错误。
(2)在画基态原子的轨道表示式时,常出现以下错误:
①(违反能量最低原则) ②(违反泡利不相容原理)
③(违反洪特规则) ④(违反洪特规则)
⑤画轨道表示式时,省略空轨道。如C的轨道表示式应为 ,而不是。
↑
↑
↑
↑↑
↑↓
↑
↓
1s
↑↓
↑↓
↑
↑
2s
2p
1s
↑↓
↑↓
↑
↑
2s
2p
考点三:基态原子核外电子排布规律
【例3】下列由电子排布式或轨道表示式所得的结论错误的是( )
选项 电子排布式 结论
A 1s22s22p2p2p 违背洪特规则
B 1s22s22p63s23p63d3 违背能量最低原则
C N的轨道表示式: 违背泡利不相容原理
D 1s22s22p63s23p63d54s1 违背能量最低原则
D
【解析】A项2px,2py,2pz就是2p能级的3个简并轨道,两个电子排入2p能级,它们将分别占据2个简并轨道且自旋相同,而不是自旋相反地挤入其中一个轨道,违反洪特规则;B项 3d轨道能量高于4s轨道,所以电子排布优先占据4s轨道,电子排布式应为1s22s22p63s23p63d14s2,违反能量最低原则;C项1s、2s轨道上两个电子自旋方向相同,违反泡利不相容原理;D项电子排布式是正确的,此时3d和4s轨道均为半充满结构,能量较低,符合三个原理。
【解题指导】关于核外电子排布规律理解的常见误区
(1)只考虑能量最低原则而忽视构造原理,例如,要先排4s能级再排3d能级。
(2)书写轨道表示式时,只考虑泡利不相容原理或洪特规则。
考点四:元素的电离能和电负性的规律及应用
【例4】下列关于电离能和电负性的说法中不正确的是( )
A.元素电负性越大,元素的非金属性越强
B.通常元素的第一电离能越小,元素的金属性越强
C.根据元素逐级电离能的数值可以确定主族元素的最高化合价
D.在形成化合物时,元素的电负性大的显正价,电负性小的显负价
D
【解析】元素的电负性越大,非金属性越强,得电子能力越强,在化合物中显负价,A正确,D错误;电离能和金属性某种程度上都可以理解为失去电子的能力,而通常这是一致的,B项正确;同一电子层中电子的电离能相差不大,层与层之间电子的电离能数值上会发生突变,相差较大,所以根据逐级电离能的数值可以确定元素的核外电子的分层排布情况,主族元素的最高化合价等于其最外层电子数,C正确。
【解题指导】(1)利用元素的第一电离能和电负性的大小可以比较元素金属性、非金属性的相对强弱。
(2)利用两种元素电负性的相对大小可以判断化合物的类型、化学键的类型以及元素化合价的正负。
(3)利用元素的逐级电离能可以判断原子核外电子的分层排布情况和可能的化合价。
考点五:元素周期律的综合应用
【例5】有四种元素的基态原子的电子排布式如下:
①1s22s22p63s23p4 ②1s22s22p63s23p3 ③1s22s22p3 ④1s22s22p5
则下列有关比较中正确的是( )
A.第一电离能:④>③>②>①
B.原子半径:④>③>②>①
C.电负性:④>③>②>①
D.最高正化合价:④>③=②>①
A
【解析】根据元素的基态原子的电子排布式可知,①②③④分别是S、P、N、F元素。非金属性越强,第一电离能越大,但由于P元素的3p轨道处于半充满状态,稳定性强,第一电离能P大于S,故第一电离能:④>③>②>①,A正确;原子半径应该是②>①>③>④,B错误;非金属性越强,电负性越大,则电负性应该是④>③>①>②,C错误;F没有正价,D错误。
【解题指导】(1)同周期从左到右元素的第一电离能呈增大趋势,但要注意第ⅡA族的反常(如Be>B,Mg>Al),第ⅤA族的反常(如N>O,P>S)。同主族从上到下元素的第一电离能逐渐减小。
(2)一般情况下元素的电离能越小,元素的电负性越大,但是电离能有特殊情况。
考点六:元素的推断及应用
【例6】已知元素周期表中1~18号元素中的四种元素的简单离子W3+、X+、Y2-、Z-都具有相同的电子层结构,下列判断正确的是( )
A.元素的第一电离能:X>W
B.离子的还原性:Y2->Z-
C.氢化物的稳定性:H2Y>HZ
D.原子半径:X<W
B
【解析】1~18号元素中的四种元素的简单离子W3+、X+、Y2-、Z-都具有相同的电子层结构,则W和X是金属元素,且在周期表中W位于X的右侧,Y和Z是非金属元素,在周期表中位于W和X的上一周期,其中Z位于Y的右侧。同周期元素从左到右金属性逐渐减弱,非金属性逐渐增强,即金属性:X>W,非金属性:Z>Y,所以元素的第一电离能:X<W,原子半径:X>W,离子的还原性:Y2->Z-,氢化物的稳定性:H2Y<HZ,故B项正确。
【解题指导】当离子的电子层结构相同时,可利用“阴上阳下,序大径小”的原则,确定元素在周期表中相对位置,再结合元素周期律分析选项。
考点七:基于元素推断的综合考查
【例7】在元素周期表前四周期中,有A、B、C、D四种元素,它们的原子序数依次增大,A原子有3个未成对电子;B元素原子次外层有8个电子,1 mol B单质与足量盐酸反应可生成1 molH2,B单质不易与冷水反应;C元素的+3价离子的d轨道是半充满的;D元素易形成-1价离子。
(1)填写下表:
(2)A元素位于第______周期______族, B元素位于第______周期______族。
(3)C元素位于第______周期______族,C2+的电子排布式为_______________________,
(4)写出B与D两种元素形成的化合物的电子式:___________________________,此化合物属于______化合物。
(5)四种元素中电负性最大的元素是______(用元素符号表示,下同),第一电离能最小的元素是____________。A、B两种元素的原子半径大小关系是______________,单核离子的离子半径大小是________________________。
元素 A B C D
名称、符号
电子排布式
轨道表示式 — —
属于哪个区
【答案】 (1)
元素 A B
名称、符号 氮N 镁Mg
电子排布式 1s22s22p3 1s22s22p63s2
轨道表示式
属于哪个区 p区 s区
元素 C D
名称、符号 铁Fe 溴Br
电子排布式 1s22s22p63s23p63d64s2 1s22s22p63s23p63d104s24p5
轨道表示式 — —
属于哪个区 d区 p区
(2)2 ⅤA 3 ⅡA (3)4 Ⅷ 1s22s22p63s23p63d6
(4) 离子
(5)N Mg Mg>N Mg2+<N3-
【解析】A原子有3个未成对电子,其价电子排布为2s22p3或3s23p3;1molB与盐酸反应产生1molH2,B为ⅡA族元素Mg或Ca,又由于B比A的原子序数大且不易与冷水反应,则B为Mg元素,那么A为氮元素。C元素的+3价离子的d轨道是半充满的即3d5,那么它的原子的价电子排布式为3d64s2,C为铁元素;D元素在第4周期(原子序数比C大)且易形成-1价阴离子,它是溴元素。推出了A、B、C、D四种元素,则(1)~(5)小题可依次推理作答。
【解题指导】解答原子结构、元素在元素周期表中的位置、元素及其化合物的性质间的推断试题的思路一般可用下面的框线关系表示:
本章知识网络
元素周期表
原子结构
元素性质
基态原子核外电子排布
核外电子排布与元素周期表
能量最低原理
泡利不相容原理
洪特规则及其特例
构造原理
价电子排布与周期划分
价电子排布与族划分
元素周期表分区
元素原子得失电子能力
电离能
电负性
定义
变化规律
应用
定义
变化规律
应用
同周期,左至右,逐减小
同主族,上至下,逐增大
同周期,左至右,失减弱得增强
同主族,上至下,失增强得减弱
同周期,有起伏
同主族,逐减小
同周期,逐增大
同主族,逐减小
原子半径周期性变化
原子结构模型发展史
氢原子光谱和玻尔原子结构模型
核外电子运动状态
基态与激发态
玻尔原子结构模型观点
电子云、原子轨道图形
电子层、能级、原子轨道
考点一:能层、能级、原子轨道与原子运动状态
【例1】下列说法中正确的是( )
A.任何一个能层最多只有s、p、d、f四个能级
B.同一原子中,2p、3p、4p能级的轨道数依次增多
C.在一个多电子原子中,不可能有两个运动状态完全相同的电子
D.在一个多电子原子中,N层上的电子能量肯定比M层上的电子能量高
C
【解析】第5能层开始含有5个能级,A错误;不同电子层中p轨道均为3个,则同一原子中,2p、3p、4p能级的轨道数相同, B错误;在多电子的原子中,电子填充在不同的能层,能层又分不同的能级,同一能级又有不同的原子轨道,每个轨道中最多可以填充两个电子,自旋相反,在一个基态多电子的原子中,不可能有两个运动状态完全相同的电子,C正确;由构造原理得:3d轨道上电子的能量比4s轨道上的要高,D错误。
【解题指导】能层、能级、原子轨道与原子运动状态的关系
(1)同一能层,不同能级其原子轨道形状不同,数目不同;不同能层,同种能级其原子轨道形状相同,半径不同,能量不同。
(2)电子的运动状态与能层、能级、自旋状态有关,同一原子内部不存在两个运动状态完全相同的电子。
考点二:核外电子排布表示方法
【例2】下列化学用语的表达正确的是( )
A.原子核内有10个中子的氧原子:168O
B.氯原子的结构示意图:
C.Fe3+的最外层电子排布式:3s23p63d5
D.基态铜原子的外围电子轨道表示式:
↑↓
↑↓
↑↓
↑↓
3d
4s
↑↓
↑
C
【解析】原子核内有10个中子的氧原子应表示为 188O,A错误;
氯原子的结构示意图为 ,B错误;
Fe的原子序数是26,故Fe3+的最外层电子排布式为3s23p63d5,C正确;
铜的原子序数是29,基态铜原子的外围电子排布符合洪特规则的特例,外围电子轨道表示式为 ,D项错误。
↑↓
↑↓
↑↓
↑
3d
4s
↑↓
↑↓
【解题指导】核外电子的排布表示方法的常见误区
(1)当出现d轨道时,虽然电子按ns、(n-1)d,np的顺序填充,但在书写电子排布式时,仍把(n-1)d放在ns前,如Fe:1s22s22p63s23p63d64s2正确,Fe:1s22s22p63s23p64s23d6错误。
(2)在画基态原子的轨道表示式时,常出现以下错误:
①(违反能量最低原则) ②(违反泡利不相容原理)
③(违反洪特规则) ④(违反洪特规则)
⑤画轨道表示式时,省略空轨道。如C的轨道表示式应为 ,而不是。
↑
↑
↑
↑↑
↑↓
↑
↓
1s
↑↓
↑↓
↑
↑
2s
2p
1s
↑↓
↑↓
↑
↑
2s
2p
考点三:基态原子核外电子排布规律
【例3】下列由电子排布式或轨道表示式所得的结论错误的是( )
选项 电子排布式 结论
A 1s22s22p2p2p 违背洪特规则
B 1s22s22p63s23p63d3 违背能量最低原则
C N的轨道表示式: 违背泡利不相容原理
D 1s22s22p63s23p63d54s1 违背能量最低原则
D
【解析】A项2px,2py,2pz就是2p能级的3个简并轨道,两个电子排入2p能级,它们将分别占据2个简并轨道且自旋相同,而不是自旋相反地挤入其中一个轨道,违反洪特规则;B项 3d轨道能量高于4s轨道,所以电子排布优先占据4s轨道,电子排布式应为1s22s22p63s23p63d14s2,违反能量最低原则;C项1s、2s轨道上两个电子自旋方向相同,违反泡利不相容原理;D项电子排布式是正确的,此时3d和4s轨道均为半充满结构,能量较低,符合三个原理。
【解题指导】关于核外电子排布规律理解的常见误区
(1)只考虑能量最低原则而忽视构造原理,例如,要先排4s能级再排3d能级。
(2)书写轨道表示式时,只考虑泡利不相容原理或洪特规则。
考点四:元素的电离能和电负性的规律及应用
【例4】下列关于电离能和电负性的说法中不正确的是( )
A.元素电负性越大,元素的非金属性越强
B.通常元素的第一电离能越小,元素的金属性越强
C.根据元素逐级电离能的数值可以确定主族元素的最高化合价
D.在形成化合物时,元素的电负性大的显正价,电负性小的显负价
D
【解析】元素的电负性越大,非金属性越强,得电子能力越强,在化合物中显负价,A正确,D错误;电离能和金属性某种程度上都可以理解为失去电子的能力,而通常这是一致的,B项正确;同一电子层中电子的电离能相差不大,层与层之间电子的电离能数值上会发生突变,相差较大,所以根据逐级电离能的数值可以确定元素的核外电子的分层排布情况,主族元素的最高化合价等于其最外层电子数,C正确。
【解题指导】(1)利用元素的第一电离能和电负性的大小可以比较元素金属性、非金属性的相对强弱。
(2)利用两种元素电负性的相对大小可以判断化合物的类型、化学键的类型以及元素化合价的正负。
(3)利用元素的逐级电离能可以判断原子核外电子的分层排布情况和可能的化合价。
考点五:元素周期律的综合应用
【例5】有四种元素的基态原子的电子排布式如下:
①1s22s22p63s23p4 ②1s22s22p63s23p3 ③1s22s22p3 ④1s22s22p5
则下列有关比较中正确的是( )
A.第一电离能:④>③>②>①
B.原子半径:④>③>②>①
C.电负性:④>③>②>①
D.最高正化合价:④>③=②>①
A
【解析】根据元素的基态原子的电子排布式可知,①②③④分别是S、P、N、F元素。非金属性越强,第一电离能越大,但由于P元素的3p轨道处于半充满状态,稳定性强,第一电离能P大于S,故第一电离能:④>③>②>①,A正确;原子半径应该是②>①>③>④,B错误;非金属性越强,电负性越大,则电负性应该是④>③>①>②,C错误;F没有正价,D错误。
【解题指导】(1)同周期从左到右元素的第一电离能呈增大趋势,但要注意第ⅡA族的反常(如Be>B,Mg>Al),第ⅤA族的反常(如N>O,P>S)。同主族从上到下元素的第一电离能逐渐减小。
(2)一般情况下元素的电离能越小,元素的电负性越大,但是电离能有特殊情况。
考点六:元素的推断及应用
【例6】已知元素周期表中1~18号元素中的四种元素的简单离子W3+、X+、Y2-、Z-都具有相同的电子层结构,下列判断正确的是( )
A.元素的第一电离能:X>W
B.离子的还原性:Y2->Z-
C.氢化物的稳定性:H2Y>HZ
D.原子半径:X<W
B
【解析】1~18号元素中的四种元素的简单离子W3+、X+、Y2-、Z-都具有相同的电子层结构,则W和X是金属元素,且在周期表中W位于X的右侧,Y和Z是非金属元素,在周期表中位于W和X的上一周期,其中Z位于Y的右侧。同周期元素从左到右金属性逐渐减弱,非金属性逐渐增强,即金属性:X>W,非金属性:Z>Y,所以元素的第一电离能:X<W,原子半径:X>W,离子的还原性:Y2->Z-,氢化物的稳定性:H2Y<HZ,故B项正确。
【解题指导】当离子的电子层结构相同时,可利用“阴上阳下,序大径小”的原则,确定元素在周期表中相对位置,再结合元素周期律分析选项。
考点七:基于元素推断的综合考查
【例7】在元素周期表前四周期中,有A、B、C、D四种元素,它们的原子序数依次增大,A原子有3个未成对电子;B元素原子次外层有8个电子,1 mol B单质与足量盐酸反应可生成1 molH2,B单质不易与冷水反应;C元素的+3价离子的d轨道是半充满的;D元素易形成-1价离子。
(1)填写下表:
(2)A元素位于第______周期______族, B元素位于第______周期______族。
(3)C元素位于第______周期______族,C2+的电子排布式为_______________________,
(4)写出B与D两种元素形成的化合物的电子式:___________________________,此化合物属于______化合物。
(5)四种元素中电负性最大的元素是______(用元素符号表示,下同),第一电离能最小的元素是____________。A、B两种元素的原子半径大小关系是______________,单核离子的离子半径大小是________________________。
元素 A B C D
名称、符号
电子排布式
轨道表示式 — —
属于哪个区
【答案】 (1)
元素 A B
名称、符号 氮N 镁Mg
电子排布式 1s22s22p3 1s22s22p63s2
轨道表示式
属于哪个区 p区 s区
元素 C D
名称、符号 铁Fe 溴Br
电子排布式 1s22s22p63s23p63d64s2 1s22s22p63s23p63d104s24p5
轨道表示式 — —
属于哪个区 d区 p区
(2)2 ⅤA 3 ⅡA (3)4 Ⅷ 1s22s22p63s23p63d6
(4) 离子
(5)N Mg Mg>N Mg2+<N3-
【解析】A原子有3个未成对电子,其价电子排布为2s22p3或3s23p3;1molB与盐酸反应产生1molH2,B为ⅡA族元素Mg或Ca,又由于B比A的原子序数大且不易与冷水反应,则B为Mg元素,那么A为氮元素。C元素的+3价离子的d轨道是半充满的即3d5,那么它的原子的价电子排布式为3d64s2,C为铁元素;D元素在第4周期(原子序数比C大)且易形成-1价阴离子,它是溴元素。推出了A、B、C、D四种元素,则(1)~(5)小题可依次推理作答。
【解题指导】解答原子结构、元素在元素周期表中的位置、元素及其化合物的性质间的推断试题的思路一般可用下面的框线关系表示:
