第2章微粒间相互作用与物质性质2.4分子间作用力课件(共22张PPT)鲁科版高中化学选择性必修2
文档属性
| 名称 | 第2章微粒间相互作用与物质性质2.4分子间作用力课件(共22张PPT)鲁科版高中化学选择性必修2 |

|
|
| 格式 | ppt | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-12 00:00:00 | ||
图片预览







文档简介
(共22张PPT)
知识回顾
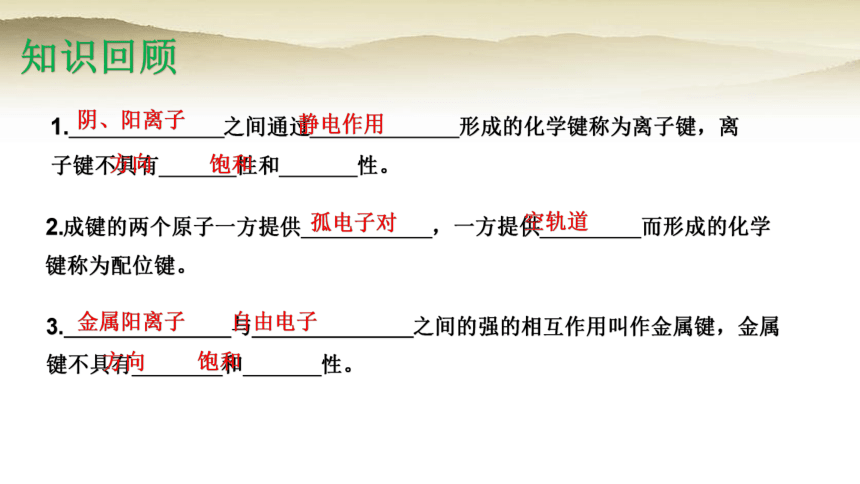
1. 之间通过 形成的化学键称为离子键,离子键不具有 性和 性。
2.成键的两个原子一方提供 ,一方提供 而形成的化学键称为配位键。
空轨道
孤电子对
静电作用
阴、阳离子
方向
饱和
3. 与 之间的强的相互作用叫作金属键,金属键不具有 和 性。
金属阳离子
自由电子
方向
饱和
你曾观察过电解水的实验,对水的三态变化也很熟悉。通过对这两种变化过程及条件的比较,你对水中微粒间的相互作用有什么新的思考
联想质疑
分子间作用力:分子间存在的一类弱的相互作用。
固态水
液态水
气态水
水的三态变化伴随着能量变化。这说明:分子间存在着相互作用力。
水的三态转变
分子间作用力:分子间存在的一类弱的相互作用。
阅读探究
阅读教材第一部分“范德华力与物质性质”总结范德华力的含义以及对物质性质的影响。
一.范德华力与物质性质
1.范德华力
(1)概念:分子间普遍存在的一种相互作用力,它使许多物质能以一定的凝聚态(固态和液态)存在。
(2)特点:比化学键的键能小得多。
(3)实质:电性作用。
(4)特征:没有饱和性和方向性
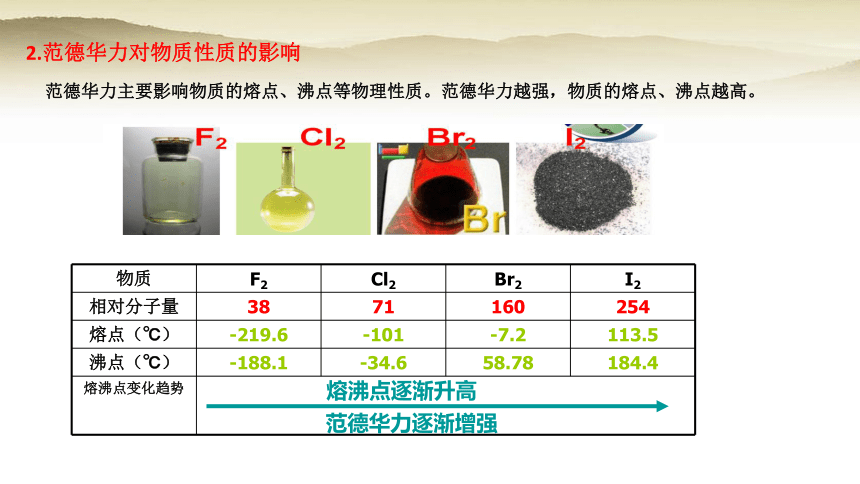
2.范德华力对物质性质的影响
范德华力主要影响物质的熔点、沸点等物理性质。范德华力越强,物质的熔点、沸点越高。
物质 F2 Cl2 Br2 I2
相对分子量 38 71 160 254
熔点(℃) -219.6 -101 -7.2 113.5
沸点(℃) -188.1 -34.6 58.78 184.4
熔沸点变化趋势
熔沸点逐渐升高
范德华力逐渐增强
交流研讨
1.观察四卤化碳、卤素单质的熔沸点与分子量的关系,思考范德华力与分子量的关系
2.CO2和CH3CHO的分子量相同,但CH3CHO常温下为液态?原因是什么?
CH3CHO为极性分子
CO2为非极性分子
一.范德华力与物质性质
1.范德华力
(1)概念:分子间普遍存在的一种相互作用力,它使许多物质能以一定的凝聚态(固态和液态)存在。
(2)特点:比化学键的键能小得多。
(3)实质:电性作用。
(4)特征:没有饱和性和方向性
2.影响范德华力的因素
①结构和组成相似的物质,相对分子质量越大,范德华力越强。
②分子的极性越大,范德华力越强。
为了研究气体分子的运动规律,科学家提出了一种理想气体模型,假设气体分子不具有体积,并且气体分子之间不存在相互作用。根据这种模型提出的理想气体方程对气体分子运动规律的描述与实验事实出现了偏差。荷兰物理学家范德华(J.van der Waals)修正了关于气体分子运动的以上假设,指出气体分子本身具有体积,并且分子间存在引力。由此,范德华提出了描述实际气体行为的范德华气态方程,根据这个方程计算的结果与实验事实十分吻合。由于是范德华首次将分子间作用力的概念引入气态方程,人们将这种分子间相互作用力称为范德华力。
拓展视野
范德华力概念的提出
荷兰物理学家
约翰内斯·迪德里·范·德·瓦耳斯
极性分子相互靠近时,一个分子的正电荷端与另一个分子的负电荷端相互吸引,这种静电吸引力称为取向力。分子极性越强,取向力就越大。
一个分子受到极性分子的诱导作用,导致正电荷重心与负电荷重心不重合或距离加大,进而使两种分子之间产生吸引力或吸引力增强,这种吸引力称为诱导力。
由于原子核和电子总是在不停地运动,因此即使对非极性分子来说,其正电荷重心与负电荷重心也会发生瞬间不重合。当分子相互靠近时,分子之间会产生静电吸引力,这种静电吸引力叫作色散力。分子越大,分子内的电子越多,分子越容易变形,色散力就越大。除了极性特别强的极性分子间的范德华力以取向力为主以外,其他分子间的范德华力往往以色散力为主。
拓展视野
范德华力的成因
化学键 范德华力
概念 分子内相邻的原子间强烈的相互作用 把分子聚集在一起的作用力
存在 分子内(或晶体内)原子或离子间 分子间(近距离)
强弱 较强 比化学键弱得多
对物质性质的影响 影响化学性质和物理性质 主要影响物理性质
2.对范德华力存在的理解
(1)离子化合物中只存在化学键,不存在范德华力。
(2)范德华力只存在于由共价键形成的多数共价化合物和绝大多数非金属单质分子之间及稀有气体分子之间。但像二氧化硅、金刚石等由共价键形成的物质的微粒之间不存在范德华力。
归纳总结
1.化学键与范德华力的比较
你注意到我们每天都离不开的水有什么反常之处吗?物质由液态变为固态时,通常是体积变小,但水结冰后体积却变大,如果是在密闭容器里的水结成冰,甚至可能将容器撑破。
另外,在氧族元素的氢化物中,常温、常压下硫化氢(H2S)、硒化氢(H2Se)、碲化氢(H2Te)都是气体,只有水以液态存在。按照一般规律,水的沸点应该低于硫化氢的沸点,但事实却相反。这是为什么?
联想质疑
水分子之间除了范德华力以外还存在其他作用力
——氢键
二.氢键与物质性质
1.什么是氢键
氢键的概念:
当氢原子与电负性大的原子X以共价键结合时,氢原子与另一个电负性大的原子Y之间的静电作用。
氢键的表示形式:
通常用X—H…Y表示氢键,其中X—H表示氢原子和X原子以共价键相结合。
氢键的实质:
静电作用
特殊的分子间作用力
氢键的特征:
具有方向性和饱和性
每个水分子最多可与四个水分子形成四个氢键
化学键>氢键>范德华力
分子间氢键
分子内氢键
2.氢键的形成条件
(1)氢原子位于X原子和Y原子之间。
(2)X、Y原子所属元素具有很强的电负性和很小的原子半径。一般是氮原子、氧原子和氟原子。
DNA分子有两条链,链内原子之间以很强的共价键结合,链之间则是两条链上的碱基以氢键配对,许许多多的氢键将两条链连成独特的双螺旋结构,这是遗传基因复制机理的化学基础。
化学与生命
DNA双螺旋结构中的氢键
3.氢键对物质性质的影响
(1)当形成分子间氢键时,物质的熔、沸点将升高。
(2)氢键也影响物质的电离、溶解等过程。
氨气极易溶于水,溶解度约为1:700;乙醇能与水任意比互溶
如果溶质分子与溶剂分子间可以生成氢键,则溶质的溶解度增大。
范德华力、氢键与共价键的比较
作用力 范德华力 氢键 共价键
概念 物质分子之间普遍存在的一种相互作用力 已经与电负性很大的原子形成共价键的氢原子与另一个分子中电负性很大的原子之间的作用力 原子间通过共用电子对所形成的相互作用
分类 分子内氢键、分子间氢键 极性共价键、非极性共价键
特征 无方向性、无饱和性 有方向性、有饱和性 有方向性、有饱和性
强度比较 共价键>氢键>范德华力
影响强度的因素 ①随着分子极性和相对分子质量的增大而增大;②组成和结构相似的物质,相对分子质量越大,分子间作用力越大 对于X—H…Y,X、Y的电负性越大,X、Y原子的半径越小,作用能越大 成键原子半径越小,键长越短,键能越大,共价键越稳定
对物质性质的影响 影响物质的熔、沸点及溶解度等物理性质;如熔、沸点F2H2S,HF>HCl,NH3>PH3 ①影响分子的稳定性;②共价键键能越大,分子稳定性越强
归纳总结
水分子之间存在着氢键,使水的沸点比硫化氢的沸点高出139 ℃,导致在通常状况下水为液态,地球上因此有了生命。冰中的水分子之间最大程度地形成氢键。由于氢键有方向性,每个水分子的两对孤对电子和两个氢原子只能沿着四个sp3杂化轨道的方向分别与相邻水分子形成氢键,因此每个水分子只能与周围四个水分子接触。水分子之间形成的孔穴造成冰晶体的微观空间存在空隙,反映在宏观性质上就是冰的密度比水的密度小。正是由于冰的这一独特结构,使冰可以浮在水面上,从而使水中生物在寒冷的冬季得以在冰层下的水中存活。
冰中每个氢原子分享到一个氢键,折合每摩尔冰有 2NA个氢键(NA为阿伏加德罗常数)。冰中氢键的作用能为 18.8 kJ·mol-1,而冰的熔化热只有5.0 kJ·mol-1。当在0 ℃冰融化成水时,即使熔化热全部用于破坏氢键,也只能使大约 13%的氢键遭到破坏,水中仍存在着许多由氢键作用而形成的小集团(H2O)n。温度升高使冰融化为水的过程,实际上包括两种过程∶水分子间的氢键减少,使水的密度变大,水分子的热运动即热膨胀作用使水的密度减小。随着温度升高,前一过程的作用由强变弱,后一过程的作用由弱变强,在 4 ℃时两种作用达到平衡。所以,当温度升高时,由0 ℃到 4 ℃时水的密度逐渐增大,4 ℃时水的密度达到最大,4℃后水的密度变小。
追根寻源
为什么水呈现出独特的物理性质
大家知道,羊毛织品水洗后会变形,这是什么原因呢 羊毛纤维是蛋白质构成的,蛋白质上的氨基和羰基可能会形成氢键。羊毛在浸水和干燥的过程中,会在这些氢键处纳入水和去除水,而且其变化往往是不可逆的,从而改变了原先蛋白质的构造,即原先的氢键部位可能发生移动,由此引起羊毛织品变形。
追根寻源
羊毛织品水洗后为什么会变形
课堂小结
分子间作用力与物质性质
范德华力与物质性质
氢键与物质性质
范德华力的定义
范德华力对物质性质的影响
本质
类型
特征
静电作用
分子间氢键
分子内氢键
饱和性
方向性
知识回顾
1. 之间通过 形成的化学键称为离子键,离子键不具有 性和 性。
2.成键的两个原子一方提供 ,一方提供 而形成的化学键称为配位键。
空轨道
孤电子对
静电作用
阴、阳离子
方向
饱和
3. 与 之间的强的相互作用叫作金属键,金属键不具有 和 性。
金属阳离子
自由电子
方向
饱和
你曾观察过电解水的实验,对水的三态变化也很熟悉。通过对这两种变化过程及条件的比较,你对水中微粒间的相互作用有什么新的思考
联想质疑
分子间作用力:分子间存在的一类弱的相互作用。
固态水
液态水
气态水
水的三态变化伴随着能量变化。这说明:分子间存在着相互作用力。
水的三态转变
分子间作用力:分子间存在的一类弱的相互作用。
阅读探究
阅读教材第一部分“范德华力与物质性质”总结范德华力的含义以及对物质性质的影响。
一.范德华力与物质性质
1.范德华力
(1)概念:分子间普遍存在的一种相互作用力,它使许多物质能以一定的凝聚态(固态和液态)存在。
(2)特点:比化学键的键能小得多。
(3)实质:电性作用。
(4)特征:没有饱和性和方向性
2.范德华力对物质性质的影响
范德华力主要影响物质的熔点、沸点等物理性质。范德华力越强,物质的熔点、沸点越高。
物质 F2 Cl2 Br2 I2
相对分子量 38 71 160 254
熔点(℃) -219.6 -101 -7.2 113.5
沸点(℃) -188.1 -34.6 58.78 184.4
熔沸点变化趋势
熔沸点逐渐升高
范德华力逐渐增强
交流研讨
1.观察四卤化碳、卤素单质的熔沸点与分子量的关系,思考范德华力与分子量的关系
2.CO2和CH3CHO的分子量相同,但CH3CHO常温下为液态?原因是什么?
CH3CHO为极性分子
CO2为非极性分子
一.范德华力与物质性质
1.范德华力
(1)概念:分子间普遍存在的一种相互作用力,它使许多物质能以一定的凝聚态(固态和液态)存在。
(2)特点:比化学键的键能小得多。
(3)实质:电性作用。
(4)特征:没有饱和性和方向性
2.影响范德华力的因素
①结构和组成相似的物质,相对分子质量越大,范德华力越强。
②分子的极性越大,范德华力越强。
为了研究气体分子的运动规律,科学家提出了一种理想气体模型,假设气体分子不具有体积,并且气体分子之间不存在相互作用。根据这种模型提出的理想气体方程对气体分子运动规律的描述与实验事实出现了偏差。荷兰物理学家范德华(J.van der Waals)修正了关于气体分子运动的以上假设,指出气体分子本身具有体积,并且分子间存在引力。由此,范德华提出了描述实际气体行为的范德华气态方程,根据这个方程计算的结果与实验事实十分吻合。由于是范德华首次将分子间作用力的概念引入气态方程,人们将这种分子间相互作用力称为范德华力。
拓展视野
范德华力概念的提出
荷兰物理学家
约翰内斯·迪德里·范·德·瓦耳斯
极性分子相互靠近时,一个分子的正电荷端与另一个分子的负电荷端相互吸引,这种静电吸引力称为取向力。分子极性越强,取向力就越大。
一个分子受到极性分子的诱导作用,导致正电荷重心与负电荷重心不重合或距离加大,进而使两种分子之间产生吸引力或吸引力增强,这种吸引力称为诱导力。
由于原子核和电子总是在不停地运动,因此即使对非极性分子来说,其正电荷重心与负电荷重心也会发生瞬间不重合。当分子相互靠近时,分子之间会产生静电吸引力,这种静电吸引力叫作色散力。分子越大,分子内的电子越多,分子越容易变形,色散力就越大。除了极性特别强的极性分子间的范德华力以取向力为主以外,其他分子间的范德华力往往以色散力为主。
拓展视野
范德华力的成因
化学键 范德华力
概念 分子内相邻的原子间强烈的相互作用 把分子聚集在一起的作用力
存在 分子内(或晶体内)原子或离子间 分子间(近距离)
强弱 较强 比化学键弱得多
对物质性质的影响 影响化学性质和物理性质 主要影响物理性质
2.对范德华力存在的理解
(1)离子化合物中只存在化学键,不存在范德华力。
(2)范德华力只存在于由共价键形成的多数共价化合物和绝大多数非金属单质分子之间及稀有气体分子之间。但像二氧化硅、金刚石等由共价键形成的物质的微粒之间不存在范德华力。
归纳总结
1.化学键与范德华力的比较
你注意到我们每天都离不开的水有什么反常之处吗?物质由液态变为固态时,通常是体积变小,但水结冰后体积却变大,如果是在密闭容器里的水结成冰,甚至可能将容器撑破。
另外,在氧族元素的氢化物中,常温、常压下硫化氢(H2S)、硒化氢(H2Se)、碲化氢(H2Te)都是气体,只有水以液态存在。按照一般规律,水的沸点应该低于硫化氢的沸点,但事实却相反。这是为什么?
联想质疑
水分子之间除了范德华力以外还存在其他作用力
——氢键
二.氢键与物质性质
1.什么是氢键
氢键的概念:
当氢原子与电负性大的原子X以共价键结合时,氢原子与另一个电负性大的原子Y之间的静电作用。
氢键的表示形式:
通常用X—H…Y表示氢键,其中X—H表示氢原子和X原子以共价键相结合。
氢键的实质:
静电作用
特殊的分子间作用力
氢键的特征:
具有方向性和饱和性
每个水分子最多可与四个水分子形成四个氢键
化学键>氢键>范德华力
分子间氢键
分子内氢键
2.氢键的形成条件
(1)氢原子位于X原子和Y原子之间。
(2)X、Y原子所属元素具有很强的电负性和很小的原子半径。一般是氮原子、氧原子和氟原子。
DNA分子有两条链,链内原子之间以很强的共价键结合,链之间则是两条链上的碱基以氢键配对,许许多多的氢键将两条链连成独特的双螺旋结构,这是遗传基因复制机理的化学基础。
化学与生命
DNA双螺旋结构中的氢键
3.氢键对物质性质的影响
(1)当形成分子间氢键时,物质的熔、沸点将升高。
(2)氢键也影响物质的电离、溶解等过程。
氨气极易溶于水,溶解度约为1:700;乙醇能与水任意比互溶
如果溶质分子与溶剂分子间可以生成氢键,则溶质的溶解度增大。
范德华力、氢键与共价键的比较
作用力 范德华力 氢键 共价键
概念 物质分子之间普遍存在的一种相互作用力 已经与电负性很大的原子形成共价键的氢原子与另一个分子中电负性很大的原子之间的作用力 原子间通过共用电子对所形成的相互作用
分类 分子内氢键、分子间氢键 极性共价键、非极性共价键
特征 无方向性、无饱和性 有方向性、有饱和性 有方向性、有饱和性
强度比较 共价键>氢键>范德华力
影响强度的因素 ①随着分子极性和相对分子质量的增大而增大;②组成和结构相似的物质,相对分子质量越大,分子间作用力越大 对于X—H…Y,X、Y的电负性越大,X、Y原子的半径越小,作用能越大 成键原子半径越小,键长越短,键能越大,共价键越稳定
对物质性质的影响 影响物质的熔、沸点及溶解度等物理性质;如熔、沸点F2
归纳总结
水分子之间存在着氢键,使水的沸点比硫化氢的沸点高出139 ℃,导致在通常状况下水为液态,地球上因此有了生命。冰中的水分子之间最大程度地形成氢键。由于氢键有方向性,每个水分子的两对孤对电子和两个氢原子只能沿着四个sp3杂化轨道的方向分别与相邻水分子形成氢键,因此每个水分子只能与周围四个水分子接触。水分子之间形成的孔穴造成冰晶体的微观空间存在空隙,反映在宏观性质上就是冰的密度比水的密度小。正是由于冰的这一独特结构,使冰可以浮在水面上,从而使水中生物在寒冷的冬季得以在冰层下的水中存活。
冰中每个氢原子分享到一个氢键,折合每摩尔冰有 2NA个氢键(NA为阿伏加德罗常数)。冰中氢键的作用能为 18.8 kJ·mol-1,而冰的熔化热只有5.0 kJ·mol-1。当在0 ℃冰融化成水时,即使熔化热全部用于破坏氢键,也只能使大约 13%的氢键遭到破坏,水中仍存在着许多由氢键作用而形成的小集团(H2O)n。温度升高使冰融化为水的过程,实际上包括两种过程∶水分子间的氢键减少,使水的密度变大,水分子的热运动即热膨胀作用使水的密度减小。随着温度升高,前一过程的作用由强变弱,后一过程的作用由弱变强,在 4 ℃时两种作用达到平衡。所以,当温度升高时,由0 ℃到 4 ℃时水的密度逐渐增大,4 ℃时水的密度达到最大,4℃后水的密度变小。
追根寻源
为什么水呈现出独特的物理性质
大家知道,羊毛织品水洗后会变形,这是什么原因呢 羊毛纤维是蛋白质构成的,蛋白质上的氨基和羰基可能会形成氢键。羊毛在浸水和干燥的过程中,会在这些氢键处纳入水和去除水,而且其变化往往是不可逆的,从而改变了原先蛋白质的构造,即原先的氢键部位可能发生移动,由此引起羊毛织品变形。
追根寻源
羊毛织品水洗后为什么会变形
课堂小结
分子间作用力与物质性质
范德华力与物质性质
氢键与物质性质
范德华力的定义
范德华力对物质性质的影响
本质
类型
特征
静电作用
分子间氢键
分子内氢键
饱和性
方向性
