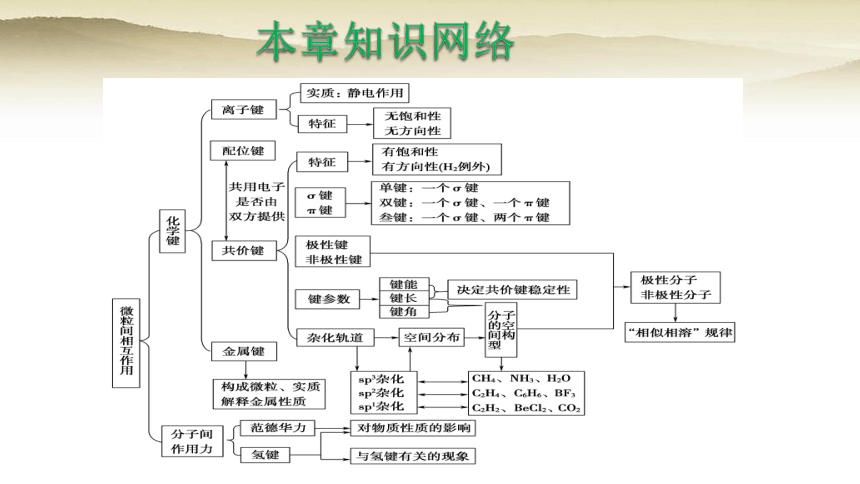
第2章微粒间相互作用与物质性质2.6章末整合提升课件(共19张PPT) 鲁科版高中化学选择性必修2
文档属性
| 名称 | 第2章微粒间相互作用与物质性质2.6章末整合提升课件(共19张PPT) 鲁科版高中化学选择性必修2 |  | |
| 格式 | ppt | ||
| 文件大小 | 959.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-12 00:34:35 | ||
图片预览





文档简介
(共19张PPT)
【例1】甲、乙、丙三种有机物的结构如下:
甲: 乙:COCl2 ( ) 丙:CH2==CHCN
(1)甲分子中有______个σ键,______个π键,________(填“有”或“没有”)非极性键。
(2)乙分子中每个碳原子形成________个σ键,________个π键。
(3)丙分子中σ键与π键的数目之比为______。
(4)上述分子中既存在极性键又存在非极性键的是______。
【答案】 (1)8 2 有 (2)3 1 (3)2∶1 (4) 甲、丙
【解析】 (1)甲分子中有3个C—H σ键,2个C—C σ键,2个C—O σ键,1个O—H σ键;C==C和C==O中分别有1个π键;有C—C、C==C非极性键。(2)乙分子中C与O原子之间形成1个σ键和1个π键,C与两个Cl原子之间分别形成1个σ键。(3)丙分子中含有1个C==C键,1个C≡N键,3个C—H键和1个C—C键,故丙分子中共有6个σ键和3个π键。
【解题指导】 σ键、π键存在的规律
(1)共价单键全部是σ键。
(2)共价双键中,一个是σ键、一个是π键。
(3)共价叁键中,一个是σ键、两个是π键。
【例2】在 分子中,羰基碳原子与甲基碳原子成键时所采取的杂化方式分别为( )
A.sp2杂化;sp2杂化 B.sp3杂化;sp3杂化
C.sp2杂化;sp3杂化 D.sp杂化;sp3杂化
【答案】 C
【解析】羰基上的碳原子共形成3个σ键,为sp2杂化,两侧甲基中的碳原子共形成4个σ键,为sp3杂化。
【解题指导】有机物分子中碳原子杂化类型的判断
对于有机物分子来说,若没有形成π键则为sp3杂化,形成一个π键则为sp2杂化,形成两个π键则为sp杂化。
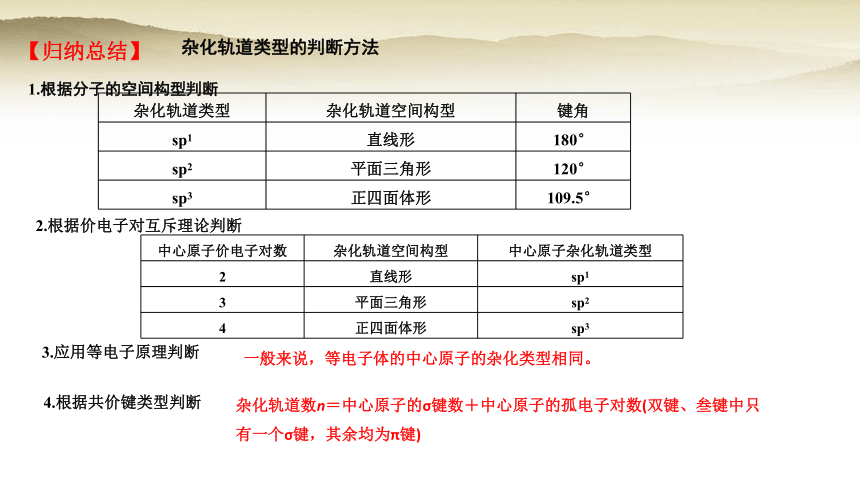
【归纳总结】
杂化轨道类型的判断方法
1.根据分子的空间构型判断
杂化轨道类型 杂化轨道空间构型 键角
sp1 直线形 180°
sp2 平面三角形 120°
sp3 正四面体形 109.5°
2.根据价电子对互斥理论判断
中心原子价电子对数 杂化轨道空间构型 中心原子杂化轨道类型
2 直线形 sp1
3 平面三角形 sp2
4 正四面体形 sp3
3.应用等电子原理判断
一般来说,等电子体的中心原子的杂化类型相同。
4.根据共价键类型判断
杂化轨道数n=中心原子的σ键数+中心原子的孤电子对数(双键、叁键中只有一个σ键,其余均为π键)
【例3】配位化合物在生产生活中有重要应用,请根据要求回答下列问题:
(1)光谱证实单质铝与强碱性溶液反应有[Al(OH)4]-生成,则[Al(OH)4]-中存在________(填字母)。
a.共价键 b.非极性键 c.配位键 d.σ键 e.π键
(2)Co(NH3)5BrSO4可形成两种钴的配合物,已知Co3+的配位数是6,为确定钴的配合物的结构,现对两种配合物进行了如下实验:在第一种配合物的溶液中加BaCl2溶液时,产生白色沉淀,在第二种配合物的溶液中加BaCl2溶液时,则无明显现象。则第一种配合物的结构可表示为_____________________,第二种配合物的结构可表示为_____________________。若在第二种配合物的溶液中滴加AgNO3溶液,则产生的现象是____________________。(提示:TiCl(H2O)5Cl2这种配合物的结构可表示为[Ti(H2O)5Cl]Cl2。)
【答案】 (1)acd
(2)[Co(NH3)5Br]SO4 [Co(SO4)(NH3)5]Br 生成淡黄色沉淀
【解析】 (1)光谱证实单质Al与强碱性溶液反应有[Al(OH)4]-生成,可看作铝原子和三个羟基形成三对共用电子对,形成三个极性共价键,形成Al(OH)3,Al(OH)3溶解在强碱性溶液中,和OH-结合形成[Al(OH)4]-,利用的是铝原子的空轨道和OH-的孤对电子形成的配位键;由两个原子轨道“头碰头”相互重叠而形成的共价键,叫σ键,所以[Al(OH)4]-中也形成了σ键。
(2)若硫酸根离子为配合物的外界,在水溶液中以离子形式存在,所以会与钡离子结合生成白色沉淀,若加入BaCl2溶液时无明显现象,说明硫酸根离子在内界;溴离子为配合物的外界,在水溶液中以离子形式存在,若加入AgNO3溶液,会产生淡黄色沉淀溴化银。
【解题指导】配合物中化学键的类型和数目判断,易错点在于对概念、微粒的组成以及结构式认识不清,导致出错。配合物中的化学键主要有离子键、共价键、配位键三种,离子键是阴、阳离子之间的作用力(阳离子包括金属离子和NH等),共价键主要是非金属原子之间的作用力,配位键是中心原子与配体之间的作用力。键的数目判断方法:两个共价原子之间形成一个σ键,中心原子和配体之间形成一个配位键。
【例4】 (1)下列关于化学键的各种叙述正确的是_______________________________(填字母)。
A.含有金属元素的化合物一定是离子化合物 B.共价化合物中一定不存在离子键
C.由多种非金属元素组成的化合物一定是共价化合物 D.由不同种元素组成的多原子分子中,一定只存在极性键
(2)铁是生活中常用的一种金属,其常见的离子有Fe2+、Fe3+,其中Fe2+可用K3[Fe(CN)6](赤血盐)溶液检验。
①铁单质中化学键为________(填名称)。
②K3[Fe(CN)6]晶体中各种微粒的作用力有________(填字母)。
a.金属键 b.共价键 c.配位键 d.离子键
【答案】 (1)B (2)①金属键 ②bcd
【解析】 (1)含有金属元素的化合物,可能为共价化合物,如氯化铝,A项错误;含离子键的化合物一定为离子化合物,则共价化合物中一定不存在离子键,B项正确;由多种非金属元素组成的化合物,可能为离子化合物,如铵盐,C项错误;由不同种元素组成的多原子分子中可存在极性键和非极性键,如H2O2中存在极性键和非极性键,D项错误。
(2)①铁单质中含金属键。②K3[Fe(CN)6]属于配位化合物又属于离子化合物,含配位键、离子键,CN-中含有共价键。
【解题指导】
(1)活泼的金属与非金属之间形成的不一定是离子键,如AlCl3,多种非金属元素之间也可形成离子键,如铵盐。
(2)物质中含有阳离子不一定含有阴离子,如金属单质中含有金属阳离子和自由电子,没有阴离子。但是物质中含有阴离子则一定含有阳离子。
【例5】下列离子的VSEPR模型与其立体构型一致的是( )
A.SO32- B.ClO4- C.NO2- D.ClO3-
【答案】 B
【解析】 SO32-的价层电子对数为4,且含有一对孤电子对,所以其VSEPR模型为四面体形,而SO32-的立体构型为三角锥形,A项错误; ClO4-的价层电子对数为4,不含孤电子对,所以其VSEPR模型与其立体构型一致,B项正确; NO2-的价层电子对数为3,其中含有一对孤电子对,其VSEPR模型与其立体构型不一致,C项错误;ClO3-的价层电子对数为4,也含有一对孤电子对,D项错误。
【解题指导】价层电子对互斥理论模型(VSEPR模型)指的是价层电子对的立体构型,而分子的立体构型指的是成键电子对的立体构型,不包括孤电子对。当中心原子无孤电子对时,分子的立体构型与价层电子对的立体构型一致;当中心原子有孤电子对时,分子的立体构型与价层电子对的立体构型不一致。
运用该理论的关键是准确计算中心原子的价电子对数,其计算方法如下:
注意:对于阳离子,a=中心原子价电子数-离子电荷数;
对于阴离子,a=中心原子价电子数+|离子电荷数|。
【例6】通常把原子总数和价电子总数相同的分子或离子称为等电子体。人们发现等电子体的立体构型相同,则下列有关说法中正确的是( )
A.CH4和NH4+是等电子体,键角均为60°
B.NO和CO是等电子体,均为平面正三角形结构
C.H3O+和PCl3是等电子体,均为三角锥形结构
D.B3N3H6和苯是等电子体,B3N3H6分子中不存在“肩并肩”式重叠的轨道
【答案】 B
【解析】CH4和NH4+为等电子体,都是正四面体结构,键角均为109.5°,A项不正确;NO和CO是等电子体,均为平面正三角形结构,B项正确;H3O+和PCl3价电子总数不相等,不是等电子体,C项不正确;B3N3H6结构与苯相似,也存在“肩并肩”式重叠的轨道,D项不正确。
判断两种微粒是否是等电子体,要牢牢抓住等电子体的定义,不要被质子数的多少、是否都是中性粒子等所迷惑。等电子体的结构具有相似性,一般来说,等电子体的中心原子的杂化类型相同。对于结构模糊或复杂的分子、离子,可将其转化成熟悉的等电子体,然后进行判断。常见的等电子体往往是同族不同元素或同周期相近元素构成的微粒。
【解题指导】
【例7】下列每组物质中化学键类型和分子的极性都相同的是( )
A.CO2和CS2 B.NaCl和HCl
C.H2O和CH4 D.O2和HBr
【答案】 A
【解析】CO2和CS2中均含极性共价键,且均为直线形对称分子,均属于非极性分子,A正确;NaCl含离子键,HCl含极性共价键,B错误;H2O和CH4中均含极性共价键,H2O为V形,属于极性分子,CH4为正四面体形,属于非极性分子,C错误;O2和HBr中分别含非极性键、极性键,分别属于非极性分子和极性分子,D错误。
(1)对于双原子分子,键的极性就是分子的极性。
①由极性键形成的双原子分子(表示为AB型分子),一定是极性分子,如CO、NO、HCl等分子。
②由非极性键形成的双原子分子(表示为A2型分子),一定是非极性分子,如O2、N2、Cl2等分子。
(2)三原子及三原子以上的分子,结构有可能对称,键的极性互相抵消,有可能为非极性分子。
【解题指导】
【例8】下列两组命题中,Ⅱ组中命题正确,且能用Ⅰ组中的命题加以解释的是( )
【答案】 D
【解析】由于相对分子质量:HCl>HF,所以范德华力:HCl>HF,但HF分子间存在氢键,而HCl分子间不存在氢键,所以沸点HCl低于HF,A中命题Ⅱ不正确;由于原子半径:OH—S键,但沸点与共价键的键能无关,H2O分子间存在氢键,所以H2O的沸点高于H2S的沸点,B中命题Ⅰ不能解释命题Ⅱ;由于相对分子质量:H2S>H2O,所以范德华力:H2S>H2O,但H2O分子间存在氢键,所以分子间作用力:H2O>H2S,由于键能:H—O键>H—S键,所以稳定性H2O强于H2S,分子的稳定性与分子间作用力无关,所以C中命题Ⅰ不能解释命题Ⅱ;由于相对分子质量:HI>HCl,所以范德华力:HI>HCl,沸点:HI高于HCl,D中命题Ⅰ能解释命题Ⅱ。
选项 Ⅰ 组 Ⅱ组
A 相对分子质量:HCl>HF 沸点:HCl高于HF
B 键能:H—O键>H—S键 沸点:H2O高于H2S
C 分子间作用力:H2O > H2S 稳定性: H2O强于H2S
D 范德华力:HI>HCl 沸点:HI高于HCl
【解题指导】
(1)利用范德华力判断物质熔、沸点高低的前提是物质的组成和结构要相似。结构相似的判断方法有两种:一是同一主族同一类别的物质的结构相似,如H2S和H2Te;二是运用价层电子对互斥理论模型判断其分子的空间构型。
(2)比较分子沸点时,一定要注意氢键的存在。分子间氢键使沸点升高,分子内氢键使沸点降低。
【课堂检测】
指出下列分子或离子的中心原子杂化轨道类型,并判断分子或离子的空间构型。
(1)GeCl4中Ge的杂化轨道类型为________,分子空间构型为________。
(2)AsCl3中As的杂化轨道类型为________,分子空间构型为________。
(3)SeO42-中Se的杂化轨道类型为________,离子空间构型为________。
【答案】(1)sp3 正四面体形 (2)sp3 三角锥形 (3)sp3 正四面体形
【解析】(1)GeCl4:Ge的价电子对数=4+×[4-4×(8-7)]=4+0=4,Ge采用sp3杂化,因为中心原子上没有孤对电子,故分子空间构型为正四面体形。
(2)AsCl3:As的价电子对数=3+×[5-3×(8-7)]=3+1=4,As采用sp3杂化,因为中心原子上有1对孤对电子,故分子空间构型为三角锥形。
(3)SeO42-:Se的价电子对数=4+×[6+2-4×(8-6)]=4+0=4,Se采用sp3杂化,因为中心原子上没有孤对电子,故离子空间构型为正四面体形。
【例1】甲、乙、丙三种有机物的结构如下:
甲: 乙:COCl2 ( ) 丙:CH2==CHCN
(1)甲分子中有______个σ键,______个π键,________(填“有”或“没有”)非极性键。
(2)乙分子中每个碳原子形成________个σ键,________个π键。
(3)丙分子中σ键与π键的数目之比为______。
(4)上述分子中既存在极性键又存在非极性键的是______。
【答案】 (1)8 2 有 (2)3 1 (3)2∶1 (4) 甲、丙
【解析】 (1)甲分子中有3个C—H σ键,2个C—C σ键,2个C—O σ键,1个O—H σ键;C==C和C==O中分别有1个π键;有C—C、C==C非极性键。(2)乙分子中C与O原子之间形成1个σ键和1个π键,C与两个Cl原子之间分别形成1个σ键。(3)丙分子中含有1个C==C键,1个C≡N键,3个C—H键和1个C—C键,故丙分子中共有6个σ键和3个π键。
【解题指导】 σ键、π键存在的规律
(1)共价单键全部是σ键。
(2)共价双键中,一个是σ键、一个是π键。
(3)共价叁键中,一个是σ键、两个是π键。
【例2】在 分子中,羰基碳原子与甲基碳原子成键时所采取的杂化方式分别为( )
A.sp2杂化;sp2杂化 B.sp3杂化;sp3杂化
C.sp2杂化;sp3杂化 D.sp杂化;sp3杂化
【答案】 C
【解析】羰基上的碳原子共形成3个σ键,为sp2杂化,两侧甲基中的碳原子共形成4个σ键,为sp3杂化。
【解题指导】有机物分子中碳原子杂化类型的判断
对于有机物分子来说,若没有形成π键则为sp3杂化,形成一个π键则为sp2杂化,形成两个π键则为sp杂化。
【归纳总结】
杂化轨道类型的判断方法
1.根据分子的空间构型判断
杂化轨道类型 杂化轨道空间构型 键角
sp1 直线形 180°
sp2 平面三角形 120°
sp3 正四面体形 109.5°
2.根据价电子对互斥理论判断
中心原子价电子对数 杂化轨道空间构型 中心原子杂化轨道类型
2 直线形 sp1
3 平面三角形 sp2
4 正四面体形 sp3
3.应用等电子原理判断
一般来说,等电子体的中心原子的杂化类型相同。
4.根据共价键类型判断
杂化轨道数n=中心原子的σ键数+中心原子的孤电子对数(双键、叁键中只有一个σ键,其余均为π键)
【例3】配位化合物在生产生活中有重要应用,请根据要求回答下列问题:
(1)光谱证实单质铝与强碱性溶液反应有[Al(OH)4]-生成,则[Al(OH)4]-中存在________(填字母)。
a.共价键 b.非极性键 c.配位键 d.σ键 e.π键
(2)Co(NH3)5BrSO4可形成两种钴的配合物,已知Co3+的配位数是6,为确定钴的配合物的结构,现对两种配合物进行了如下实验:在第一种配合物的溶液中加BaCl2溶液时,产生白色沉淀,在第二种配合物的溶液中加BaCl2溶液时,则无明显现象。则第一种配合物的结构可表示为_____________________,第二种配合物的结构可表示为_____________________。若在第二种配合物的溶液中滴加AgNO3溶液,则产生的现象是____________________。(提示:TiCl(H2O)5Cl2这种配合物的结构可表示为[Ti(H2O)5Cl]Cl2。)
【答案】 (1)acd
(2)[Co(NH3)5Br]SO4 [Co(SO4)(NH3)5]Br 生成淡黄色沉淀
【解析】 (1)光谱证实单质Al与强碱性溶液反应有[Al(OH)4]-生成,可看作铝原子和三个羟基形成三对共用电子对,形成三个极性共价键,形成Al(OH)3,Al(OH)3溶解在强碱性溶液中,和OH-结合形成[Al(OH)4]-,利用的是铝原子的空轨道和OH-的孤对电子形成的配位键;由两个原子轨道“头碰头”相互重叠而形成的共价键,叫σ键,所以[Al(OH)4]-中也形成了σ键。
(2)若硫酸根离子为配合物的外界,在水溶液中以离子形式存在,所以会与钡离子结合生成白色沉淀,若加入BaCl2溶液时无明显现象,说明硫酸根离子在内界;溴离子为配合物的外界,在水溶液中以离子形式存在,若加入AgNO3溶液,会产生淡黄色沉淀溴化银。
【解题指导】配合物中化学键的类型和数目判断,易错点在于对概念、微粒的组成以及结构式认识不清,导致出错。配合物中的化学键主要有离子键、共价键、配位键三种,离子键是阴、阳离子之间的作用力(阳离子包括金属离子和NH等),共价键主要是非金属原子之间的作用力,配位键是中心原子与配体之间的作用力。键的数目判断方法:两个共价原子之间形成一个σ键,中心原子和配体之间形成一个配位键。
【例4】 (1)下列关于化学键的各种叙述正确的是_______________________________(填字母)。
A.含有金属元素的化合物一定是离子化合物 B.共价化合物中一定不存在离子键
C.由多种非金属元素组成的化合物一定是共价化合物 D.由不同种元素组成的多原子分子中,一定只存在极性键
(2)铁是生活中常用的一种金属,其常见的离子有Fe2+、Fe3+,其中Fe2+可用K3[Fe(CN)6](赤血盐)溶液检验。
①铁单质中化学键为________(填名称)。
②K3[Fe(CN)6]晶体中各种微粒的作用力有________(填字母)。
a.金属键 b.共价键 c.配位键 d.离子键
【答案】 (1)B (2)①金属键 ②bcd
【解析】 (1)含有金属元素的化合物,可能为共价化合物,如氯化铝,A项错误;含离子键的化合物一定为离子化合物,则共价化合物中一定不存在离子键,B项正确;由多种非金属元素组成的化合物,可能为离子化合物,如铵盐,C项错误;由不同种元素组成的多原子分子中可存在极性键和非极性键,如H2O2中存在极性键和非极性键,D项错误。
(2)①铁单质中含金属键。②K3[Fe(CN)6]属于配位化合物又属于离子化合物,含配位键、离子键,CN-中含有共价键。
【解题指导】
(1)活泼的金属与非金属之间形成的不一定是离子键,如AlCl3,多种非金属元素之间也可形成离子键,如铵盐。
(2)物质中含有阳离子不一定含有阴离子,如金属单质中含有金属阳离子和自由电子,没有阴离子。但是物质中含有阴离子则一定含有阳离子。
【例5】下列离子的VSEPR模型与其立体构型一致的是( )
A.SO32- B.ClO4- C.NO2- D.ClO3-
【答案】 B
【解析】 SO32-的价层电子对数为4,且含有一对孤电子对,所以其VSEPR模型为四面体形,而SO32-的立体构型为三角锥形,A项错误; ClO4-的价层电子对数为4,不含孤电子对,所以其VSEPR模型与其立体构型一致,B项正确; NO2-的价层电子对数为3,其中含有一对孤电子对,其VSEPR模型与其立体构型不一致,C项错误;ClO3-的价层电子对数为4,也含有一对孤电子对,D项错误。
【解题指导】价层电子对互斥理论模型(VSEPR模型)指的是价层电子对的立体构型,而分子的立体构型指的是成键电子对的立体构型,不包括孤电子对。当中心原子无孤电子对时,分子的立体构型与价层电子对的立体构型一致;当中心原子有孤电子对时,分子的立体构型与价层电子对的立体构型不一致。
运用该理论的关键是准确计算中心原子的价电子对数,其计算方法如下:
注意:对于阳离子,a=中心原子价电子数-离子电荷数;
对于阴离子,a=中心原子价电子数+|离子电荷数|。
【例6】通常把原子总数和价电子总数相同的分子或离子称为等电子体。人们发现等电子体的立体构型相同,则下列有关说法中正确的是( )
A.CH4和NH4+是等电子体,键角均为60°
B.NO和CO是等电子体,均为平面正三角形结构
C.H3O+和PCl3是等电子体,均为三角锥形结构
D.B3N3H6和苯是等电子体,B3N3H6分子中不存在“肩并肩”式重叠的轨道
【答案】 B
【解析】CH4和NH4+为等电子体,都是正四面体结构,键角均为109.5°,A项不正确;NO和CO是等电子体,均为平面正三角形结构,B项正确;H3O+和PCl3价电子总数不相等,不是等电子体,C项不正确;B3N3H6结构与苯相似,也存在“肩并肩”式重叠的轨道,D项不正确。
判断两种微粒是否是等电子体,要牢牢抓住等电子体的定义,不要被质子数的多少、是否都是中性粒子等所迷惑。等电子体的结构具有相似性,一般来说,等电子体的中心原子的杂化类型相同。对于结构模糊或复杂的分子、离子,可将其转化成熟悉的等电子体,然后进行判断。常见的等电子体往往是同族不同元素或同周期相近元素构成的微粒。
【解题指导】
【例7】下列每组物质中化学键类型和分子的极性都相同的是( )
A.CO2和CS2 B.NaCl和HCl
C.H2O和CH4 D.O2和HBr
【答案】 A
【解析】CO2和CS2中均含极性共价键,且均为直线形对称分子,均属于非极性分子,A正确;NaCl含离子键,HCl含极性共价键,B错误;H2O和CH4中均含极性共价键,H2O为V形,属于极性分子,CH4为正四面体形,属于非极性分子,C错误;O2和HBr中分别含非极性键、极性键,分别属于非极性分子和极性分子,D错误。
(1)对于双原子分子,键的极性就是分子的极性。
①由极性键形成的双原子分子(表示为AB型分子),一定是极性分子,如CO、NO、HCl等分子。
②由非极性键形成的双原子分子(表示为A2型分子),一定是非极性分子,如O2、N2、Cl2等分子。
(2)三原子及三原子以上的分子,结构有可能对称,键的极性互相抵消,有可能为非极性分子。
【解题指导】
【例8】下列两组命题中,Ⅱ组中命题正确,且能用Ⅰ组中的命题加以解释的是( )
【答案】 D
【解析】由于相对分子质量:HCl>HF,所以范德华力:HCl>HF,但HF分子间存在氢键,而HCl分子间不存在氢键,所以沸点HCl低于HF,A中命题Ⅱ不正确;由于原子半径:O
选项 Ⅰ 组 Ⅱ组
A 相对分子质量:HCl>HF 沸点:HCl高于HF
B 键能:H—O键>H—S键 沸点:H2O高于H2S
C 分子间作用力:H2O > H2S 稳定性: H2O强于H2S
D 范德华力:HI>HCl 沸点:HI高于HCl
【解题指导】
(1)利用范德华力判断物质熔、沸点高低的前提是物质的组成和结构要相似。结构相似的判断方法有两种:一是同一主族同一类别的物质的结构相似,如H2S和H2Te;二是运用价层电子对互斥理论模型判断其分子的空间构型。
(2)比较分子沸点时,一定要注意氢键的存在。分子间氢键使沸点升高,分子内氢键使沸点降低。
【课堂检测】
指出下列分子或离子的中心原子杂化轨道类型,并判断分子或离子的空间构型。
(1)GeCl4中Ge的杂化轨道类型为________,分子空间构型为________。
(2)AsCl3中As的杂化轨道类型为________,分子空间构型为________。
(3)SeO42-中Se的杂化轨道类型为________,离子空间构型为________。
【答案】(1)sp3 正四面体形 (2)sp3 三角锥形 (3)sp3 正四面体形
【解析】(1)GeCl4:Ge的价电子对数=4+×[4-4×(8-7)]=4+0=4,Ge采用sp3杂化,因为中心原子上没有孤对电子,故分子空间构型为正四面体形。
(2)AsCl3:As的价电子对数=3+×[5-3×(8-7)]=3+1=4,As采用sp3杂化,因为中心原子上有1对孤对电子,故分子空间构型为三角锥形。
(3)SeO42-:Se的价电子对数=4+×[6+2-4×(8-6)]=4+0=4,Se采用sp3杂化,因为中心原子上没有孤对电子,故离子空间构型为正四面体形。
