第1章原子结构与元素性质1.2.1基态原子的核外电子排布课件(共31张PPT)鲁科版高中化学选择性必修2
文档属性
| 名称 | 第1章原子结构与元素性质1.2.1基态原子的核外电子排布课件(共31张PPT)鲁科版高中化学选择性必修2 |

|
|
| 格式 | ppt | ||
| 文件大小 | 33.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-12 00:40:28 | ||
图片预览







文档简介
(共31张PPT)
1.2.1 基态原子的核外电子排布
核心素养目标
1.宏观辨识与微观探析:
学生能够从宏观角度理解元素的性质与原子结构的关系,同时从微观层面深入认识基态原子的核外电子排布规律,明确电子在不同能级、轨道上的分布情况对元素性质产生的影响。
2.证据推理与模型认知:
基于实验事实和理论分析,如原子光谱实验,推理出核外电子具有量子化特征以及不同能级的存在。构建基态原子的核外电子排布模型,像能层、能级、轨道等模型,运用这些模型解释和预测元素的原子结构及性质变化规律,如利用电子排布式判断元素在周期表中的位置。
3.科学态度与社会责任:
认识到核外电子排布理论是经过众多科学家不断探索和完善的成果,培养严谨认真的科学态度。了解核外电子排布知识在新材料研发、能源开发等领域的应用,如通过对过渡金属元素核外电子排布的研究,开发新型催化剂,增强学生对科学知识服务社会的责任感。
学习重难点
学习重点
1.基态原子的核外电子排布规律,包括能量最低原理、泡利不相容原理和洪特规则。
2.掌握 1 - 36 号元素基态原子的核外电子排布式和轨道表示式的书写。
学习难点
1.理解洪特规则的特例,即当能量相同的原子轨道在全充满(如 p 、d 、f )、半充满(如 p 、d 、f )和全空(如 p 、d 、f )状态时,体系的能量较低,原子较稳定。
2.根据基态原子的核外电子排布推断元素的性质及在周期表中的位置。
新课导入
我们刚刚看到了这些神奇的颜色,钠是黄色、钾是紫色(透过蓝色钴玻璃)等。这些不同的颜色代表着不同的元素。为什么不同的元素会产生不同颜色的火焰呢?
这是因为在加热的过程中,原子中的电子获得能量,发生了跃迁,当它们回到原来的状态时就会释放出特定颜色的光。
而电子的这些行为是受到原子内部一种有序的电子排布规律支配的,这就是我们要学习的构造原理和电子排布式。
通过这节课的学习,我们就能明白这些奇妙现象背后的科学道理。
基态原子的核外电子排布规律
1.三个原则
研究发现,原子中的核外电子按照一定规律分布在各原子轨道上。那么,多电子原子中的电子是如何分布在各原子轨道上的呢?本节探讨能量最低状态即基态原子的核外电子排布的规律。
(1)能量最低原理
基态原子的核外电子总是尽可能先排布在能量最低的轨道上,然后由里及外依次排布在能量较高的轨道上。也可以说,核外电子遵循的排布规则使整个原子的能量处于最低状态。
氢原子有很多轨道:1s、2s、2px、2py、2pz 等,但只有一个电子,应该填在哪?氦原子的电子呢?
1s
1.三个原则
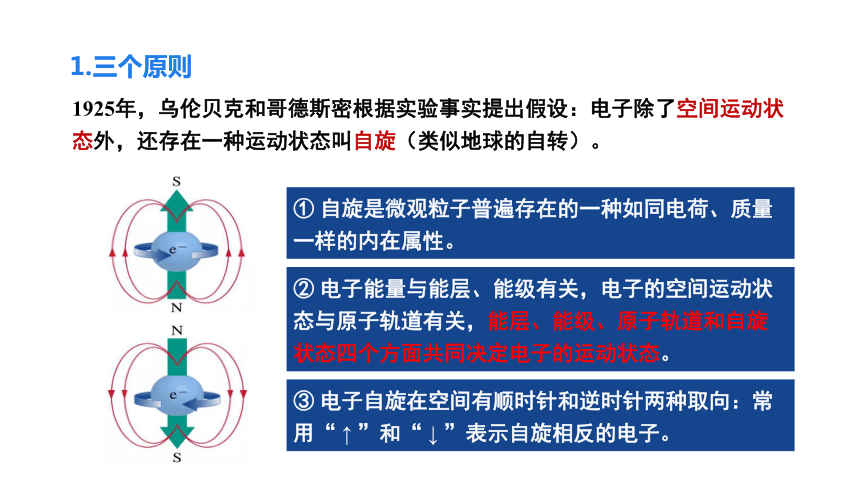
1925年,乌伦贝克和哥德斯密根据实验事实提出假设:电子除了空间运动状态外,还存在一种运动状态叫自旋(类似地球的自转)。
① 自旋是微观粒子普遍存在的一种如同电荷、质量一样的内在属性。
② 电子能量与能层、能级有关,电子的空间运动状态与原子轨道有关,能层、能级、原子轨道和自旋状态四个方面共同决定电子的运动状态。
③ 电子自旋在空间有顺时针和逆时针两种取向:常用“ ↑ ”和“ ↓ ”表示自旋相反的电子。
1.三个原则
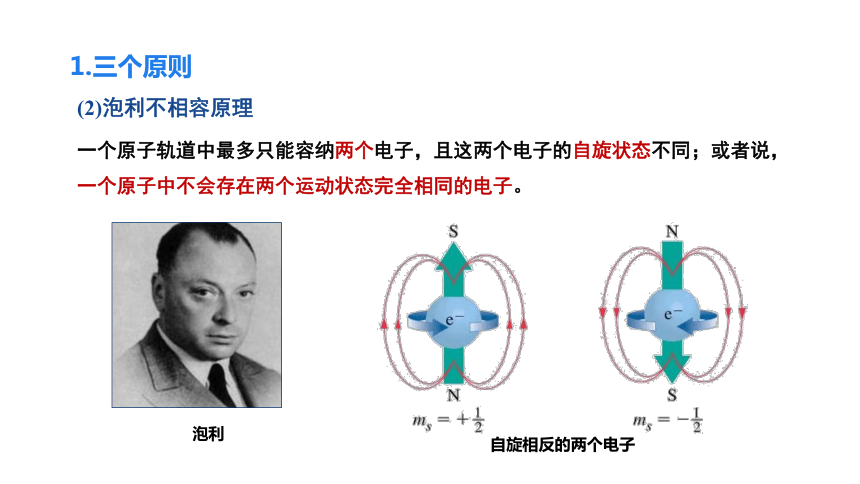
(2)泡利不相容原理
一个原子轨道中最多只能容纳两个电子,且这两个电子的自旋状态不同;或者说,一个原子中不会存在两个运动状态完全相同的电子。
自旋相反的两个电子
泡利
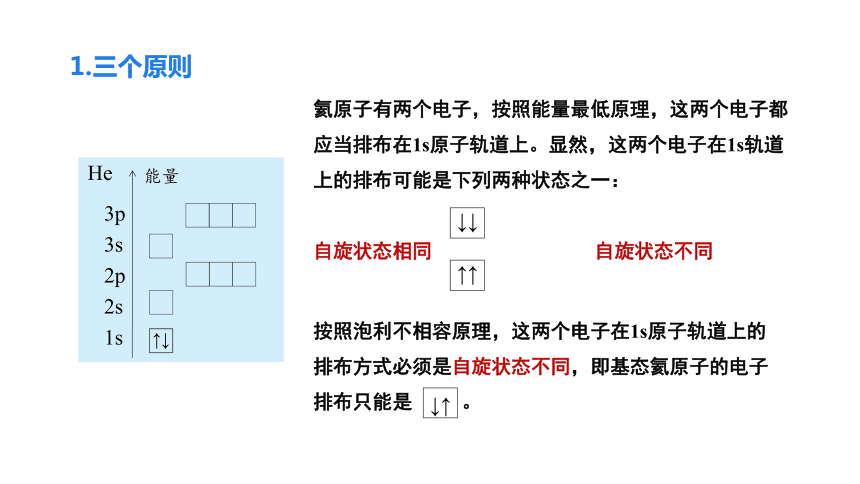
1.三个原则
He
3p
3s
2p
2s
1s
↑↓
能量
↓↑
↓↓
↑↑
1.三个原则
电子排布式与轨道排布式
电子排布式是表示原子核外电子排布的一种方式。在ns、np、nd等各能级符号的右上角用数字表示出该能级中的电子数目,如基态锂原子的电子排布式为1s22s1。
轨道表示式用方框(或小圆圈、短线)表示一个原子轨道,用箭头“↑”或“↓”来区别
自旋状态不同的电子,如基态锂原子的轨道表示式为 。
↓↓
↑
1s 2s
根据能量最低原理和泡利不相容原理,可以推断基态碳原子的核外电子排布式为1s22s22p2。由于三个p轨道的能量完全一样,那么,你认为p轨道上的两个电子应当采取以下哪中排布方式呢?
1.三个原则
↑
2p
↑
(1)
(2)
↑↓
2p
(3)
↑
↓
2p
(4)其他
√
基态原子中,填入简并轨道的电子总是优先以自旋平行方式分别占据不同轨道,称为洪特规则。
1925年,洪特在诠释复杂原子光谱时,得出判断基态原子光谱的三条经验规则,后人归并简化为一条:
(3)洪特规则
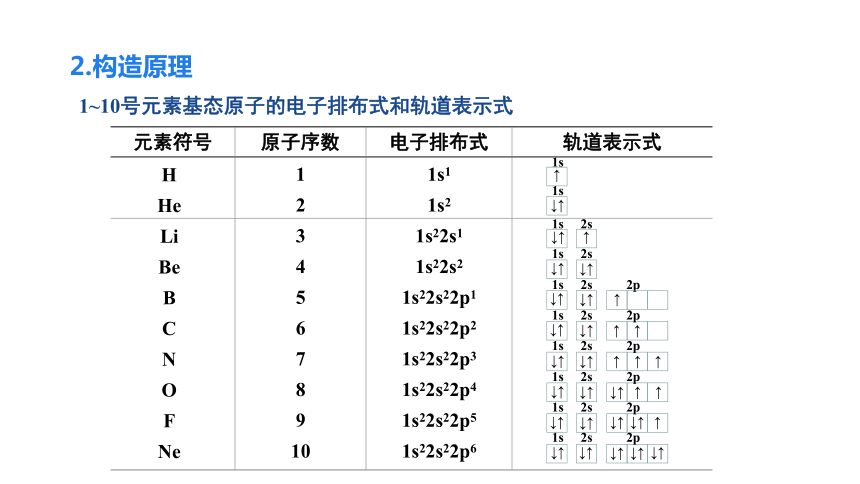
2.构造原理
1~10号元素基态原子的电子排布式和轨道表示式
元素符号 原子序数 电子排布式 轨道表示式
H
He
Li
Be
B
C
N
O
F
Ne
1
2
3
4
5
6
7
8
9
10
1s1
1s2
1s22s1
1s22s2
1s22s22p1
1s22s22p2
1s22s22p3
1s22s22p4
1s22s22p5
1s22s22p6
↓↑
1s 2s
1s 2s
1s 2s 2p
1s
1s
1s 2s 2p
1s 2s 2p
1s 2s 2p
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↑
↑
1s 2s 2p
1s 2s 2p
↓↑
↓↑
↓↑
↑
↑
↑
↑
↑
↑
↑
↑
↑
2.构造原理
思考:基态原子核外电子在原子轨道上是先排3d轨道还是先排4s轨道
2.构造原理
实验和理论都证实,为了使整个原子体系的能量最低,基态原子核外电子在原子轨道上的排布顺序按照箭头的方向依次排布在各原子轨道上:
1s、2s、2p、3s、3p、4s、3d、4p、5s、4d、5p……
如图所示为构造原理示意图
每一行对应一个能层
每个小圆圈表示一个能级
箭头引导的曲线显示递增电子填入能级的顺序
2.构造原理
电子填满一个能级,开始填入下一能级,由此,构建了元素周期系中各元素基态原子的电子排布。
多电子原子中:
1、E(K)< E(L)< E(M)< E(N)< E(O)< E(P)< E(Q)
2、E(ns)< E(np)< E(nd)< E(nf)……
3、当n=4、5时 ns→(n-1)d→np
4、当n=6、7时 ns→(n-2)f→(n-1)d→np
2.构造原理
1s
2s 2p
3s 3p
4s 3d 4p
5s 4d 5p
6s 4f 5d 6p
7s 5f 6d 7p ……
2.构造原理
构造原理是以光谱学事实为基础得出的一个思维模型,是经验的,而非任何理论推导的结果。
根据构造原理,绝大多数基态原子核外电子的排布都遵循1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→6s→4f→5d......
并非全部,有些过渡金属元素基态原子的电子排布不符合构造原理,如Cr和Cu的最后两个能级的电子排布分别为3d54s1和3d104s1
能级交错现象是从第三能层开始的
电子排布式
1.电子排布式的书写
将能级上所容纳的电子数标在该能级符号的右上角,并按照能层从左到右的顺序排列的式子。
Na: 1s2 2s2 2p6 3s1
K
L
M
1.电子排布式的书写
按照构造原理写出电子填入能级的顺序
分析基态原子的核外电子数,根据各能级容纳的电子数填充电子
去掉空能级,并按能层顺序书写
1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→6s→4f→5d......
如基态Fe原子核外电子数为26,电子填充顺序为1s2→2s2→2p6→3s2→3p6→4s2→3d6
Fe:1s22s22p63s23p63d64s2
不能写成1s22s22p63s23p64s23d6
构造原理是书写基态原子电子排布式的依据
能层低的能级写在左边,而不是按构造原理顺序书写
2.书写电子排布式的方法
铬(24Cr)元素
先按构造原理从低到高排列
1S2 2S22P6 3S23p63d44s2
3d5为半充满状态,较稳定,因此需将4s能级上的一个电子调整到3d能级上
1S2 2S22P6 3S23p63d54s1
能量相同的原子轨道在全充满、半充满和全空状态时,体系的能量较低,这称为洪特规则的特例。
1.电子排布式的书写
铜(29Cu)元素
先按构造原理从低到高排列
1S2 2S22P6 3S23p63d94s2
3d10为半充满状态,较稳定,因此需将4s能级上的一个电子调整到3d能级上
1S2 2S22P6 3S23p63d104s1
1.电子排布式的书写
试写出稀有气体元素的电子排布式。
1s2
He
1s22s22p6
Ne
1s22s22p63s23p6
Ar
1s22s22p63s23p63d104s24p6
Kr
1s22s22p63s23p63d104s24p64d105s25p6
Xe
1s22s22p63s23p63d104s24p64d104f145s25p65d106s26p6
Rn
按照稀有气体氦、氖、氩、氪、氙、氡和气的基态原子的最外层电子排布;除氦外它们的通式是什么?
2.简化电子排布式
将电子排布式中内层电子达到稀有气体元素原子结构的部分用相应的稀有气体元素符号外加方括号表示的式子称为简化电子排布式。
如Na的电子排布式可简化为[Ne]3s1
其中[Ne]表示:Na的内层电子排布与稀有气体元素Ne的核外电子排布相同
2.简化电子排布式
写出原子序数为29 的原子的电子排布式及简化电子排布式。
原子序数
29
电子排布式
1s22s22p63s23p63d104s1
元素符号
Cu
简化电子排布式
[Ar]3d104s1
3d10为全充满状态,较稳定。
3.离子电子排布式
(1)判断该原子变成离子时会得到或失去的电子数。
(2)原子得到电子形成阴离子,则得到的电子填充在最外一个能层的某一个能级上。
(3)原子失去电子时,总是从最外的能层失去电子,即失去电子的顺序是由外向里。
Cl 1s22s22p63s23p5
Cl- 1s22s22p63s23p6
一般来说,主族元素只失去它们的最外层电子,而副族和Ⅷ族元素可能还会进一步向里失去内层电子。
Fe
Fe2+
Fe3+
[Ar]3d64s2
[Ar]3d6
[Ar]3d5
失2e-
失2e-
失2e-
失2e-
4.价层电子排布式
为突出化合价与电子排布的关系,将在化学反应中可能发生电子变动的能级称为价电子层(简称价层)。通常元素周期表只给出价层电子排布。
Li 1s22s1 [He] 2s1
O 1s22s22p4 [He] 2s22p4
F 1s22s22p5 [He] 2s22p5
Si 1s22s22p63s23p2 [Ne] 3s23p2
P 1s22s22p63s23p3 [Ne] 3s23p3
K 1s22s22p63s23p64s1 [Ar] 4s1
Cr 1s22s22p63s23p63d54s1 [Ar] 3d54s1
Zn 1s22s22p63s23p63d104s2 [Ar] 3d104s2
2s1
2s22p4
2s22p5
3s23p2
3s23p3
4s1
3d54s1
3d104s2
价电子的位置
主族、零族元素:最外层电子。
副族和第VIII族元素:价电子除最外层电子外,还可能包括次外层电子
思考与讨论
试依据基态原子核外电子在原子轨道上的排布顺序分析:为什么原子核外最外层电子不超过8个?次外层不超过18个电子?
由于E(nd)>E[(n+1)s],当ns和np轨道电子排满时,多余的电子不是填入nd轨道,而是首先填入(n+1)s轨道,因此最外层电子数不可能超过2+6=8。同理次外层由(n-1)s(n-1)p(n-1)d组成,所容纳的电子数不大于2+6+10=18。
1)最外层不超过8个
2)倒数第二层电子数不超过18个
3)倒数第三层电子数不超过32个
ns2 np6
构造原理的规律 ns→(n-2)f→(n-1)d→np (n为能层序数)
随堂测试
1.下列各基态原子或离子的电子排布式书写错误的是
A.K 1s22s22p63s23p6
B.F 1s22s22p5
C.Mg2+ 1s22s22p6
D.O2- 1s22s22p6
A
随堂测试
2.A、B、C、D是四种短周期元素。A、B、C同周期,C、D同主族,
A的原子结构示意图为 ,B是同周期除稀有气体外半径最大的
元素,C的最外层有五个电子。回答下列问题:
(1)A为____(写出元素符号,下同)。
(2)B为_____,简化电子排布式是________。
(3)C为___,核外电子排布式是______________。
(4)D为___,价层电子排布式是______。
Si
Na
[Ne]3s1
P
1s22s22p63s23p3
N
2s22p3
随堂测试
3.判断正误
(1)p能级的能量一定比s能级的能量高( )
(2)同一原子中,2p、3p、4p能级的轨道数依次增多( )
(3)2p和3p轨道形状均为哑铃形,能量也相等( )
(4)2px、2py、2pz的能量相等( )
(5)铁元素基态原子的电子排布式为1s22s22p63s23p64s23d6( )
(6)Cr的基态原子的简化电子排布式为[Ar]3d44s2( )
×
×
×
×
√
×
1.2.1 基态原子的核外电子排布
核心素养目标
1.宏观辨识与微观探析:
学生能够从宏观角度理解元素的性质与原子结构的关系,同时从微观层面深入认识基态原子的核外电子排布规律,明确电子在不同能级、轨道上的分布情况对元素性质产生的影响。
2.证据推理与模型认知:
基于实验事实和理论分析,如原子光谱实验,推理出核外电子具有量子化特征以及不同能级的存在。构建基态原子的核外电子排布模型,像能层、能级、轨道等模型,运用这些模型解释和预测元素的原子结构及性质变化规律,如利用电子排布式判断元素在周期表中的位置。
3.科学态度与社会责任:
认识到核外电子排布理论是经过众多科学家不断探索和完善的成果,培养严谨认真的科学态度。了解核外电子排布知识在新材料研发、能源开发等领域的应用,如通过对过渡金属元素核外电子排布的研究,开发新型催化剂,增强学生对科学知识服务社会的责任感。
学习重难点
学习重点
1.基态原子的核外电子排布规律,包括能量最低原理、泡利不相容原理和洪特规则。
2.掌握 1 - 36 号元素基态原子的核外电子排布式和轨道表示式的书写。
学习难点
1.理解洪特规则的特例,即当能量相同的原子轨道在全充满(如 p 、d 、f )、半充满(如 p 、d 、f )和全空(如 p 、d 、f )状态时,体系的能量较低,原子较稳定。
2.根据基态原子的核外电子排布推断元素的性质及在周期表中的位置。
新课导入
我们刚刚看到了这些神奇的颜色,钠是黄色、钾是紫色(透过蓝色钴玻璃)等。这些不同的颜色代表着不同的元素。为什么不同的元素会产生不同颜色的火焰呢?
这是因为在加热的过程中,原子中的电子获得能量,发生了跃迁,当它们回到原来的状态时就会释放出特定颜色的光。
而电子的这些行为是受到原子内部一种有序的电子排布规律支配的,这就是我们要学习的构造原理和电子排布式。
通过这节课的学习,我们就能明白这些奇妙现象背后的科学道理。
基态原子的核外电子排布规律
1.三个原则
研究发现,原子中的核外电子按照一定规律分布在各原子轨道上。那么,多电子原子中的电子是如何分布在各原子轨道上的呢?本节探讨能量最低状态即基态原子的核外电子排布的规律。
(1)能量最低原理
基态原子的核外电子总是尽可能先排布在能量最低的轨道上,然后由里及外依次排布在能量较高的轨道上。也可以说,核外电子遵循的排布规则使整个原子的能量处于最低状态。
氢原子有很多轨道:1s、2s、2px、2py、2pz 等,但只有一个电子,应该填在哪?氦原子的电子呢?
1s
1.三个原则
1925年,乌伦贝克和哥德斯密根据实验事实提出假设:电子除了空间运动状态外,还存在一种运动状态叫自旋(类似地球的自转)。
① 自旋是微观粒子普遍存在的一种如同电荷、质量一样的内在属性。
② 电子能量与能层、能级有关,电子的空间运动状态与原子轨道有关,能层、能级、原子轨道和自旋状态四个方面共同决定电子的运动状态。
③ 电子自旋在空间有顺时针和逆时针两种取向:常用“ ↑ ”和“ ↓ ”表示自旋相反的电子。
1.三个原则
(2)泡利不相容原理
一个原子轨道中最多只能容纳两个电子,且这两个电子的自旋状态不同;或者说,一个原子中不会存在两个运动状态完全相同的电子。
自旋相反的两个电子
泡利
1.三个原则
He
3p
3s
2p
2s
1s
↑↓
能量
↓↑
↓↓
↑↑
1.三个原则
电子排布式与轨道排布式
电子排布式是表示原子核外电子排布的一种方式。在ns、np、nd等各能级符号的右上角用数字表示出该能级中的电子数目,如基态锂原子的电子排布式为1s22s1。
轨道表示式用方框(或小圆圈、短线)表示一个原子轨道,用箭头“↑”或“↓”来区别
自旋状态不同的电子,如基态锂原子的轨道表示式为 。
↓↓
↑
1s 2s
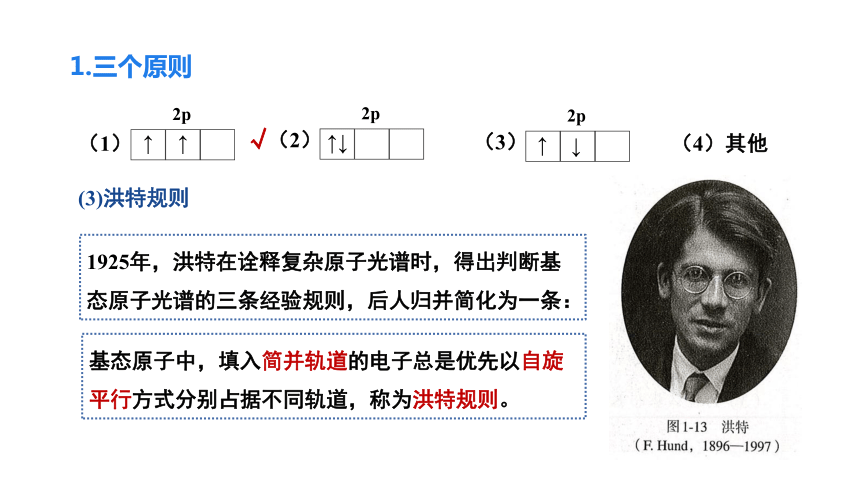
根据能量最低原理和泡利不相容原理,可以推断基态碳原子的核外电子排布式为1s22s22p2。由于三个p轨道的能量完全一样,那么,你认为p轨道上的两个电子应当采取以下哪中排布方式呢?
1.三个原则
↑
2p
↑
(1)
(2)
↑↓
2p
(3)
↑
↓
2p
(4)其他
√
基态原子中,填入简并轨道的电子总是优先以自旋平行方式分别占据不同轨道,称为洪特规则。
1925年,洪特在诠释复杂原子光谱时,得出判断基态原子光谱的三条经验规则,后人归并简化为一条:
(3)洪特规则
2.构造原理
1~10号元素基态原子的电子排布式和轨道表示式
元素符号 原子序数 电子排布式 轨道表示式
H
He
Li
Be
B
C
N
O
F
Ne
1
2
3
4
5
6
7
8
9
10
1s1
1s2
1s22s1
1s22s2
1s22s22p1
1s22s22p2
1s22s22p3
1s22s22p4
1s22s22p5
1s22s22p6
↓↑
1s 2s
1s 2s
1s 2s 2p
1s
1s
1s 2s 2p
1s 2s 2p
1s 2s 2p
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↑
↑
1s 2s 2p
1s 2s 2p
↓↑
↓↑
↓↑
↑
↑
↑
↑
↑
↑
↑
↑
↑
2.构造原理
思考:基态原子核外电子在原子轨道上是先排3d轨道还是先排4s轨道
2.构造原理
实验和理论都证实,为了使整个原子体系的能量最低,基态原子核外电子在原子轨道上的排布顺序按照箭头的方向依次排布在各原子轨道上:
1s、2s、2p、3s、3p、4s、3d、4p、5s、4d、5p……
如图所示为构造原理示意图
每一行对应一个能层
每个小圆圈表示一个能级
箭头引导的曲线显示递增电子填入能级的顺序
2.构造原理
电子填满一个能级,开始填入下一能级,由此,构建了元素周期系中各元素基态原子的电子排布。
多电子原子中:
1、E(K)< E(L)< E(M)< E(N)< E(O)< E(P)< E(Q)
2、E(ns)< E(np)< E(nd)< E(nf)……
3、当n=4、5时 ns→(n-1)d→np
4、当n=6、7时 ns→(n-2)f→(n-1)d→np
2.构造原理
1s
2s 2p
3s 3p
4s 3d 4p
5s 4d 5p
6s 4f 5d 6p
7s 5f 6d 7p ……
2.构造原理
构造原理是以光谱学事实为基础得出的一个思维模型,是经验的,而非任何理论推导的结果。
根据构造原理,绝大多数基态原子核外电子的排布都遵循1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→6s→4f→5d......
并非全部,有些过渡金属元素基态原子的电子排布不符合构造原理,如Cr和Cu的最后两个能级的电子排布分别为3d54s1和3d104s1
能级交错现象是从第三能层开始的
电子排布式
1.电子排布式的书写
将能级上所容纳的电子数标在该能级符号的右上角,并按照能层从左到右的顺序排列的式子。
Na: 1s2 2s2 2p6 3s1
K
L
M
1.电子排布式的书写
按照构造原理写出电子填入能级的顺序
分析基态原子的核外电子数,根据各能级容纳的电子数填充电子
去掉空能级,并按能层顺序书写
1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→6s→4f→5d......
如基态Fe原子核外电子数为26,电子填充顺序为1s2→2s2→2p6→3s2→3p6→4s2→3d6
Fe:1s22s22p63s23p63d64s2
不能写成1s22s22p63s23p64s23d6
构造原理是书写基态原子电子排布式的依据
能层低的能级写在左边,而不是按构造原理顺序书写
2.书写电子排布式的方法
铬(24Cr)元素
先按构造原理从低到高排列
1S2 2S22P6 3S23p63d44s2
3d5为半充满状态,较稳定,因此需将4s能级上的一个电子调整到3d能级上
1S2 2S22P6 3S23p63d54s1
能量相同的原子轨道在全充满、半充满和全空状态时,体系的能量较低,这称为洪特规则的特例。
1.电子排布式的书写
铜(29Cu)元素
先按构造原理从低到高排列
1S2 2S22P6 3S23p63d94s2
3d10为半充满状态,较稳定,因此需将4s能级上的一个电子调整到3d能级上
1S2 2S22P6 3S23p63d104s1
1.电子排布式的书写
试写出稀有气体元素的电子排布式。
1s2
He
1s22s22p6
Ne
1s22s22p63s23p6
Ar
1s22s22p63s23p63d104s24p6
Kr
1s22s22p63s23p63d104s24p64d105s25p6
Xe
1s22s22p63s23p63d104s24p64d104f145s25p65d106s26p6
Rn
按照稀有气体氦、氖、氩、氪、氙、氡和气的基态原子的最外层电子排布;除氦外它们的通式是什么?
2.简化电子排布式
将电子排布式中内层电子达到稀有气体元素原子结构的部分用相应的稀有气体元素符号外加方括号表示的式子称为简化电子排布式。
如Na的电子排布式可简化为[Ne]3s1
其中[Ne]表示:Na的内层电子排布与稀有气体元素Ne的核外电子排布相同
2.简化电子排布式
写出原子序数为29 的原子的电子排布式及简化电子排布式。
原子序数
29
电子排布式
1s22s22p63s23p63d104s1
元素符号
Cu
简化电子排布式
[Ar]3d104s1
3d10为全充满状态,较稳定。
3.离子电子排布式
(1)判断该原子变成离子时会得到或失去的电子数。
(2)原子得到电子形成阴离子,则得到的电子填充在最外一个能层的某一个能级上。
(3)原子失去电子时,总是从最外的能层失去电子,即失去电子的顺序是由外向里。
Cl 1s22s22p63s23p5
Cl- 1s22s22p63s23p6
一般来说,主族元素只失去它们的最外层电子,而副族和Ⅷ族元素可能还会进一步向里失去内层电子。
Fe
Fe2+
Fe3+
[Ar]3d64s2
[Ar]3d6
[Ar]3d5
失2e-
失2e-
失2e-
失2e-
4.价层电子排布式
为突出化合价与电子排布的关系,将在化学反应中可能发生电子变动的能级称为价电子层(简称价层)。通常元素周期表只给出价层电子排布。
Li 1s22s1 [He] 2s1
O 1s22s22p4 [He] 2s22p4
F 1s22s22p5 [He] 2s22p5
Si 1s22s22p63s23p2 [Ne] 3s23p2
P 1s22s22p63s23p3 [Ne] 3s23p3
K 1s22s22p63s23p64s1 [Ar] 4s1
Cr 1s22s22p63s23p63d54s1 [Ar] 3d54s1
Zn 1s22s22p63s23p63d104s2 [Ar] 3d104s2
2s1
2s22p4
2s22p5
3s23p2
3s23p3
4s1
3d54s1
3d104s2
价电子的位置
主族、零族元素:最外层电子。
副族和第VIII族元素:价电子除最外层电子外,还可能包括次外层电子
思考与讨论
试依据基态原子核外电子在原子轨道上的排布顺序分析:为什么原子核外最外层电子不超过8个?次外层不超过18个电子?
由于E(nd)>E[(n+1)s],当ns和np轨道电子排满时,多余的电子不是填入nd轨道,而是首先填入(n+1)s轨道,因此最外层电子数不可能超过2+6=8。同理次外层由(n-1)s(n-1)p(n-1)d组成,所容纳的电子数不大于2+6+10=18。
1)最外层不超过8个
2)倒数第二层电子数不超过18个
3)倒数第三层电子数不超过32个
ns2 np6
构造原理的规律 ns→(n-2)f→(n-1)d→np (n为能层序数)
随堂测试
1.下列各基态原子或离子的电子排布式书写错误的是
A.K 1s22s22p63s23p6
B.F 1s22s22p5
C.Mg2+ 1s22s22p6
D.O2- 1s22s22p6
A
随堂测试
2.A、B、C、D是四种短周期元素。A、B、C同周期,C、D同主族,
A的原子结构示意图为 ,B是同周期除稀有气体外半径最大的
元素,C的最外层有五个电子。回答下列问题:
(1)A为____(写出元素符号,下同)。
(2)B为_____,简化电子排布式是________。
(3)C为___,核外电子排布式是______________。
(4)D为___,价层电子排布式是______。
Si
Na
[Ne]3s1
P
1s22s22p63s23p3
N
2s22p3
随堂测试
3.判断正误
(1)p能级的能量一定比s能级的能量高( )
(2)同一原子中,2p、3p、4p能级的轨道数依次增多( )
(3)2p和3p轨道形状均为哑铃形,能量也相等( )
(4)2px、2py、2pz的能量相等( )
(5)铁元素基态原子的电子排布式为1s22s22p63s23p64s23d6( )
(6)Cr的基态原子的简化电子排布式为[Ar]3d44s2( )
×
×
×
×
√
×
