第2章微粒间相互作用与物质性质2.2.3分子的空间结构与分子性质课件(共16张PPT)鲁科版高中化学选择性必修2
文档属性
| 名称 | 第2章微粒间相互作用与物质性质2.2.3分子的空间结构与分子性质课件(共16张PPT)鲁科版高中化学选择性必修2 |

|
|
| 格式 | ppt | ||
| 文件大小 | 38.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-12 00:00:00 | ||
图片预览





文档简介
(共16张PPT)
2.2.3 分子的空间结构与分子性质
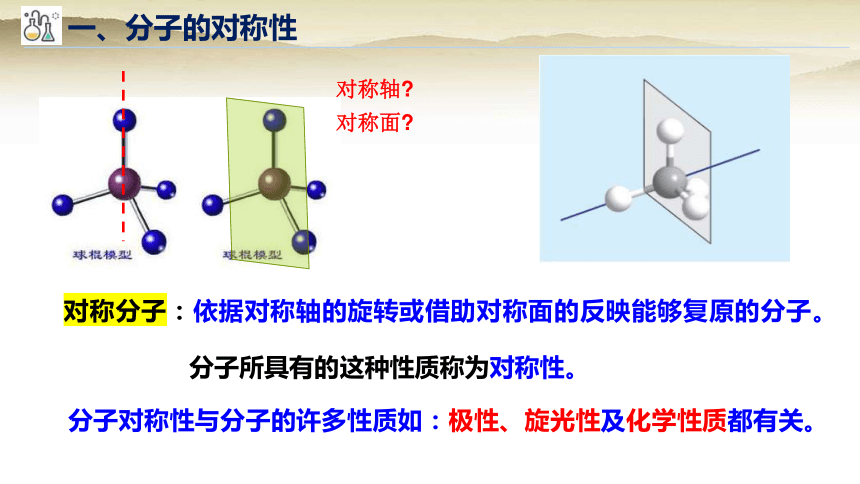
一、分子的对称性
一、分子的对称性
对称轴
对称面
分子对称性与分子的许多性质如:极性、旋光性及化学性质都有关。
分子所具有的这种性质称为对称性。
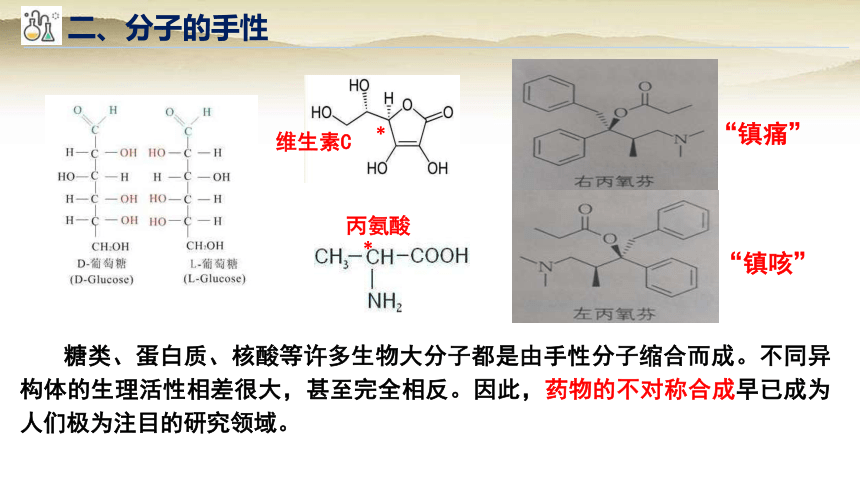
二、分子的手性
二、分子的手性
手性碳原子:
(不对称碳原子)
碳原子结合的4个原子或原子团各不同,
该C是手性碳原子,记作﹡C。
1、对称性比较低,不具有对称面。
2、存在对映异构体,具有相反的旋光性。
3、等物质的量浓度对映异构体溶液,不表现旋光性。
手性分子性质特点:
不对称碳原子采取sp3杂化
二、分子的手性
糖类、蛋白质、核酸等许多生物大分子都是由手性分子缩合而成。不同异构体的生理活性相差很大,甚至完全相反。因此,药物的不对称合成早已成为人们极为注目的研究领域。
丙氨酸
*
维生素C
*
“镇痛”
“镇咳”
二、分子的手性
21世纪的第一个诺贝尔化学奖:
手性催化反应领域
(美)诺尔斯
(日)野依良治
(美)夏普莱斯
三、分子的极性
极性键
极性键
δ+
δ-
δ+
δ-
δ-
δ-
δ-
δ+
正电重心和负电重心不重合;
H2O中存在着带正电荷的正极和带负电荷的负极。
正电重心和负电重心重合;CCl4分子中无正极和负极之分。
【思考】四氯化碳和水中的化学键是极性键还是非极性键、电荷在化学键乃至整个分子中如何分布,这对你解释实验现象有什么启示
现象: H2O流弯曲;CCl4液流不弯曲。
三、分子的极性
即:正、负电荷重心不重合的分子。
三、分子的极性
1、双原子分子的极性
非极性键→非极性分子
极性键→极性分子
三、分子的极性
2、多原子分子的极性
大多数情况下,分子的化学键均为非极性键,分子的正负电荷重心重合,则分子为非极性分子。
O3除外
C60
三、分子的极性
2、多原子分子的极性
NH3
含有极性键的多原子分子,正、负电荷重心不重合的是极性分子。
H2O
δ+
δ-
δ+
δ+
δ-
δ+
δ+
三、分子的极性
2、多原子分子的极性
含有极性键的多原子分子,正、负电荷重心重合的是非极性分子。
δ+
δ-
δ-
δ-
CO2
δ+
δ-
δ-
δ+
δ-
δ+
δ+
δ+
三、分子的极性
从物理学视角判断共价键和分子极性
在ABn分子中,A-B键看作AB原子间的相互作用力,根据中心原子A所受合力是否为零来判断:
F合=0,为非极性分子(极性抵消)
F合≠0,为极性分子(极性不抵消)
分子的极性是分子中化学键的极性的向量和。
三、分子的极性
从物理学视角判断共价键和分子极性
NH3:
F合≠0
BF3:
F1
F2
F3
F合=0
F1
F2
F3
F4
F合=0
CCl4
极性键
极性分子
极性键
非极性分子
极性键
非极性分子
共价键的极性
分子空间构型
决定分子极性
结论
三、分子的极性
①分子的极性对物质的熔、沸点有一定影响
相对分子质量相等的分子,分子极性大,分子间的电性作用强,分子间作用力大,熔、沸点较高。
②“相似相溶”原则
一般情况下,由极性分子构成的物质易溶于极性溶剂,由非极性分子构成的物质易溶于非极性溶剂。
2.2.3 分子的空间结构与分子性质
一、分子的对称性
一、分子的对称性
对称轴
对称面
分子对称性与分子的许多性质如:极性、旋光性及化学性质都有关。
分子所具有的这种性质称为对称性。
二、分子的手性
二、分子的手性
手性碳原子:
(不对称碳原子)
碳原子结合的4个原子或原子团各不同,
该C是手性碳原子,记作﹡C。
1、对称性比较低,不具有对称面。
2、存在对映异构体,具有相反的旋光性。
3、等物质的量浓度对映异构体溶液,不表现旋光性。
手性分子性质特点:
不对称碳原子采取sp3杂化
二、分子的手性
糖类、蛋白质、核酸等许多生物大分子都是由手性分子缩合而成。不同异构体的生理活性相差很大,甚至完全相反。因此,药物的不对称合成早已成为人们极为注目的研究领域。
丙氨酸
*
维生素C
*
“镇痛”
“镇咳”
二、分子的手性
21世纪的第一个诺贝尔化学奖:
手性催化反应领域
(美)诺尔斯
(日)野依良治
(美)夏普莱斯
三、分子的极性
极性键
极性键
δ+
δ-
δ+
δ-
δ-
δ-
δ-
δ+
正电重心和负电重心不重合;
H2O中存在着带正电荷的正极和带负电荷的负极。
正电重心和负电重心重合;CCl4分子中无正极和负极之分。
【思考】四氯化碳和水中的化学键是极性键还是非极性键、电荷在化学键乃至整个分子中如何分布,这对你解释实验现象有什么启示
现象: H2O流弯曲;CCl4液流不弯曲。
三、分子的极性
即:正、负电荷重心不重合的分子。
三、分子的极性
1、双原子分子的极性
非极性键→非极性分子
极性键→极性分子
三、分子的极性
2、多原子分子的极性
大多数情况下,分子的化学键均为非极性键,分子的正负电荷重心重合,则分子为非极性分子。
O3除外
C60
三、分子的极性
2、多原子分子的极性
NH3
含有极性键的多原子分子,正、负电荷重心不重合的是极性分子。
H2O
δ+
δ-
δ+
δ+
δ-
δ+
δ+
三、分子的极性
2、多原子分子的极性
含有极性键的多原子分子,正、负电荷重心重合的是非极性分子。
δ+
δ-
δ-
δ-
CO2
δ+
δ-
δ-
δ+
δ-
δ+
δ+
δ+
三、分子的极性
从物理学视角判断共价键和分子极性
在ABn分子中,A-B键看作AB原子间的相互作用力,根据中心原子A所受合力是否为零来判断:
F合=0,为非极性分子(极性抵消)
F合≠0,为极性分子(极性不抵消)
分子的极性是分子中化学键的极性的向量和。
三、分子的极性
从物理学视角判断共价键和分子极性
NH3:
F合≠0
BF3:
F1
F2
F3
F合=0
F1
F2
F3
F4
F合=0
CCl4
极性键
极性分子
极性键
非极性分子
极性键
非极性分子
共价键的极性
分子空间构型
决定分子极性
结论
三、分子的极性
①分子的极性对物质的熔、沸点有一定影响
相对分子质量相等的分子,分子极性大,分子间的电性作用强,分子间作用力大,熔、沸点较高。
②“相似相溶”原则
一般情况下,由极性分子构成的物质易溶于极性溶剂,由非极性分子构成的物质易溶于非极性溶剂。
