人教版高中化学必修第一册第二章海水中的重要元素——钠和氯2.2.2氯气的实验室制法氯离子的检验课件(19页ppt)
文档属性
| 名称 | 人教版高中化学必修第一册第二章海水中的重要元素——钠和氯2.2.2氯气的实验室制法氯离子的检验课件(19页ppt) |

|
|
| 格式 | ppt | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-12 00:00:00 | ||
图片预览




文档简介
(共19张PPT)
第二节 氯及其化合物
第2课时 氯气的实验室制法 氯离子的检验
掌握氯气的实验室制法
01
了解实验室制气体的制备思路
02
掌握氯离子的检验
03
本节重点
本节难点
*
一、氯气的实验室制法
MnO2 + 4HCl(浓) MnCl2 +Cl2 ↑+ 2H2O
舍勒是怎样在实验室制取氯气的?
知识回顾:
氧化剂
还原剂
2e-
思考:参与反应的氧化剂与还原剂的物质的量之比
1:2
酸性
离子方程式呢?
舍勒将软锰矿(主要成分MnO2 )与浓盐酸混合并加热时,产生了一种黄绿色的气体(氯气)。书写此反应的化学方程式并单线桥分析。
*
一、氯气的实验室制法
问题1:气体发生装置的选择
固-固 加热
液-液/固-液不加热
液-液/固-液加热
实验室制取气体需要哪些装置?
*
一、氯气的实验室制法
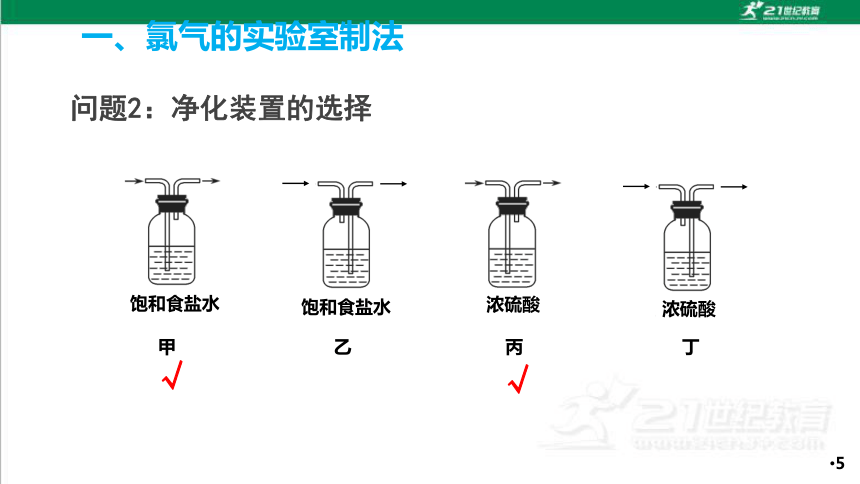
问题2:净化装置的选择
饱和食盐水
甲
饱和食盐水
乙
浓硫酸
丙
浓硫酸
丁
√
√
*
一、氯气的实验室制法
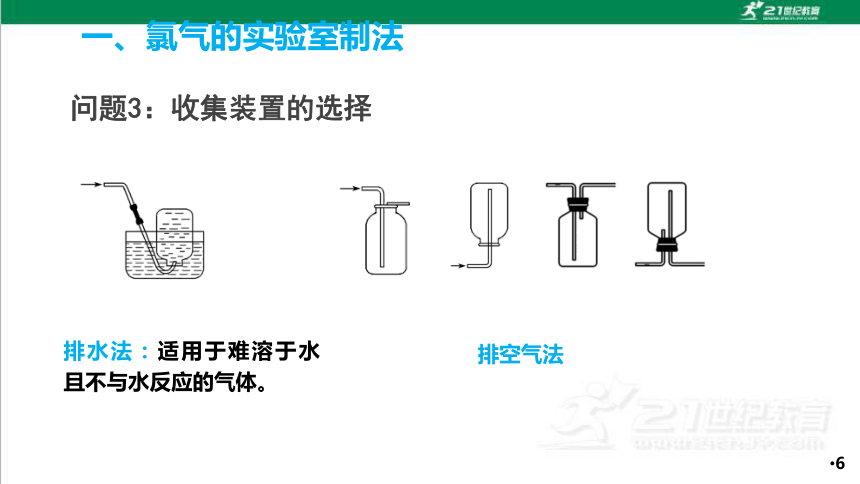
问题3:收集装置的选择
排水法:适用于难溶于水且不与水反应的气体。
排空气法
*
一、氯气的实验室制法
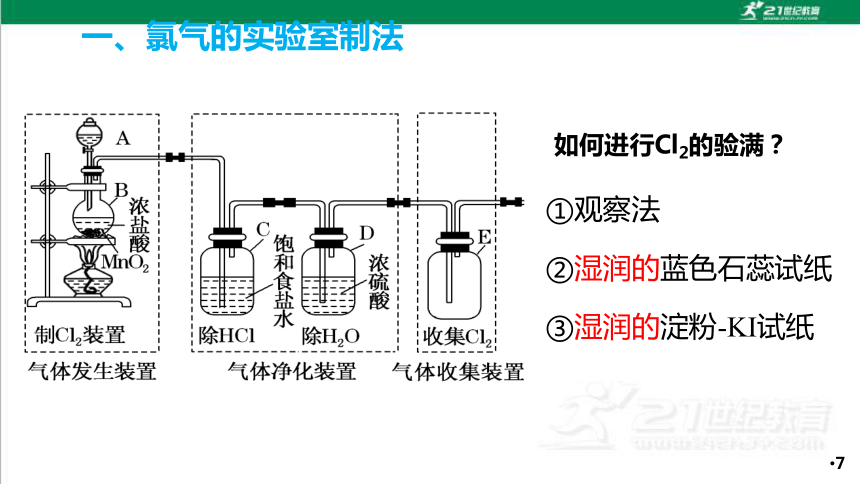
如何进行Cl2的验满?
①观察法
②湿润的蓝色石蕊试纸
③湿润的淀粉-KI试纸
*
一、氯气的实验室制法
问题4:尾气处理装置的选择
水
NaOH溶液
√
*
拓展:快速制氯气
NaClO + 2HCl === Cl2↑ + NaCl + H2O
禁止将洁厕灵和84消毒液混合使用
①2KMnO4+16HCl(浓)===2MnCl2+2KCl+5Cl2↑+8H2O
②KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O
③Ca(ClO)2+4HCl(浓)===CaCl2+2Cl2↑+2H2O
④K2Cr2O7+14HCl(浓)===2CrCl3+2KCl+3Cl2↑+7H2O
⑤PbO2+4HCl(浓)===PbCl2+Cl2↑+2H2O
*
一、氯气的实验室制法
饱和食盐水
提取
精制
电解
Cl2
H2
NaOH
很多自来水厂用氯气来杀菌、消毒。
氯气的工业制法(氯碱工业):
*
二、氯离子的检验
实验探究
在三支试管中分别加入2~3mL稀盐酸、NaCl溶液、 Na2CO3溶液,然后各滴入几滴AgNO3溶液,观察现象。再分别加入少量稀硝酸,观察现象。
*
二、氯离子的检验
试液2~3 mL 实验现象 离子方程式
滴入几滴硝酸银溶液 加入少量稀硝酸
①稀盐酸 ______________ __________ __________________
②氯化钠溶液 ______________ __________ __________________
③碳酸钠溶液 ______________ __________
__________ _____________________________________________________________________________________________
有白色沉淀生成
沉淀不溶解
有白色沉淀生成
沉淀不溶解
有白色沉淀生成
沉淀溶解,
有气泡产生
Cl-+Ag+===AgCl↓
Cl-+Ag+===AgCl↓
Ag2CO3+2H+===2Ag++CO2↑+H2O
CO32-+2Ag+===Ag2CO3↓
*
二、氯离子的检验
方法总结:
试剂:_______、___________。
稀硝酸
AgNO3溶液
不溶于稀硝酸
白
现象:产生_____________的___色沉淀。
氯离子检验的答题模板
取少量被检测溶液于试管中,滴加适量稀硝酸,然后滴入AgNO3溶液,若产生白色沉淀则被检测液中含有Cl-,若无白色沉淀则无Cl-。
注意:加稀硝酸酸化的目的是排除CO32-等的干扰,因为Ag2CO3可溶于稀硝酸,而AgCl不溶。
取样
加试剂
现象
结论
*
三、实验室制气体的思路
设计气体制备装置的基本思路
明确气体制备的原理,写出相应的化学方程式
根据药品状态、反应条件,选择合适的反应装置
分析气体是否含有杂质,根据气体和杂质性质的差异选择除杂、净化方法
根据气体性质,选择收集装置,分析是否需要尾气处理装置
第一步
第二步
第三步
第四步
*
三、实验室制气体的思路
气体制备装置的连接顺序
气体发生装置
气体净化装置
气体干燥装置
气体收集或性质检验装置
尾气吸收装置
*
三、实验室制气体的思路
选择依据
反应原理、反应物的状态、反应条件等。
装置的基本类型
固体+固体 气体
固体+液体 气体
固体+液体 气体
KMnO4、KClO3(MnO2)制备氧气
HCl + CaCO3
HCl(浓) + MnO2
*
三、实验室制气体的思路
净化原则
实验室制备气体的净化装置的选择
装置Ⅰ(洗气瓶):长管进,短管出。
不减少被净化气体的量;不引入新杂质;操作简便,易于分离。
净化装置
装置Ⅱ(干燥管):粗口进,细口出。
液体干燥剂:浓硫酸
固体干燥剂:五氧化二磷、无水CaCl2、碱石灰、硅胶等
*
三、实验室制气体的思路
实验室制备气体的收集装置的选择
选择依据
根据气体的密度、水溶性及是否与水或空气中的O2发生反应来确定气体的收集方法。
方法选择
排水法:适用于难溶于水且不与水反应的气体,如O2、H2等。
向上排空气法:气体不与空气反应,且密度比空气大,如O2、CO2、Cl2等。
向下排空气法:气体不与空气反应,且密度比空气小,如H2等。
*
三、实验室制气体的思路
实验室制备气体的尾气处理装置的选择
选择依据:
根据气体的物理、化学性质,将气体转化成无毒物质或吸收。
A
B
C
D
难吸收易燃的可以点燃处理,选用C;
难吸收的少量尾气可以先收集,选用D。
其他在液体中溶解度不大的气体用装置A;
溶解度极大的气体易倒吸,选用B可防倒吸。
Cl2 、HCl 、CO、NO
A B C D
*
第二节 氯及其化合物
第2课时 氯气的实验室制法 氯离子的检验
掌握氯气的实验室制法
01
了解实验室制气体的制备思路
02
掌握氯离子的检验
03
本节重点
本节难点
*
一、氯气的实验室制法
MnO2 + 4HCl(浓) MnCl2 +Cl2 ↑+ 2H2O
舍勒是怎样在实验室制取氯气的?
知识回顾:
氧化剂
还原剂
2e-
思考:参与反应的氧化剂与还原剂的物质的量之比
1:2
酸性
离子方程式呢?
舍勒将软锰矿(主要成分MnO2 )与浓盐酸混合并加热时,产生了一种黄绿色的气体(氯气)。书写此反应的化学方程式并单线桥分析。
*
一、氯气的实验室制法
问题1:气体发生装置的选择
固-固 加热
液-液/固-液不加热
液-液/固-液加热
实验室制取气体需要哪些装置?
*
一、氯气的实验室制法
问题2:净化装置的选择
饱和食盐水
甲
饱和食盐水
乙
浓硫酸
丙
浓硫酸
丁
√
√
*
一、氯气的实验室制法
问题3:收集装置的选择
排水法:适用于难溶于水且不与水反应的气体。
排空气法
*
一、氯气的实验室制法
如何进行Cl2的验满?
①观察法
②湿润的蓝色石蕊试纸
③湿润的淀粉-KI试纸
*
一、氯气的实验室制法
问题4:尾气处理装置的选择
水
NaOH溶液
√
*
拓展:快速制氯气
NaClO + 2HCl === Cl2↑ + NaCl + H2O
禁止将洁厕灵和84消毒液混合使用
①2KMnO4+16HCl(浓)===2MnCl2+2KCl+5Cl2↑+8H2O
②KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O
③Ca(ClO)2+4HCl(浓)===CaCl2+2Cl2↑+2H2O
④K2Cr2O7+14HCl(浓)===2CrCl3+2KCl+3Cl2↑+7H2O
⑤PbO2+4HCl(浓)===PbCl2+Cl2↑+2H2O
*
一、氯气的实验室制法
饱和食盐水
提取
精制
电解
Cl2
H2
NaOH
很多自来水厂用氯气来杀菌、消毒。
氯气的工业制法(氯碱工业):
*
二、氯离子的检验
实验探究
在三支试管中分别加入2~3mL稀盐酸、NaCl溶液、 Na2CO3溶液,然后各滴入几滴AgNO3溶液,观察现象。再分别加入少量稀硝酸,观察现象。
*
二、氯离子的检验
试液2~3 mL 实验现象 离子方程式
滴入几滴硝酸银溶液 加入少量稀硝酸
①稀盐酸 ______________ __________ __________________
②氯化钠溶液 ______________ __________ __________________
③碳酸钠溶液 ______________ __________
__________ _____________________________________________________________________________________________
有白色沉淀生成
沉淀不溶解
有白色沉淀生成
沉淀不溶解
有白色沉淀生成
沉淀溶解,
有气泡产生
Cl-+Ag+===AgCl↓
Cl-+Ag+===AgCl↓
Ag2CO3+2H+===2Ag++CO2↑+H2O
CO32-+2Ag+===Ag2CO3↓
*
二、氯离子的检验
方法总结:
试剂:_______、___________。
稀硝酸
AgNO3溶液
不溶于稀硝酸
白
现象:产生_____________的___色沉淀。
氯离子检验的答题模板
取少量被检测溶液于试管中,滴加适量稀硝酸,然后滴入AgNO3溶液,若产生白色沉淀则被检测液中含有Cl-,若无白色沉淀则无Cl-。
注意:加稀硝酸酸化的目的是排除CO32-等的干扰,因为Ag2CO3可溶于稀硝酸,而AgCl不溶。
取样
加试剂
现象
结论
*
三、实验室制气体的思路
设计气体制备装置的基本思路
明确气体制备的原理,写出相应的化学方程式
根据药品状态、反应条件,选择合适的反应装置
分析气体是否含有杂质,根据气体和杂质性质的差异选择除杂、净化方法
根据气体性质,选择收集装置,分析是否需要尾气处理装置
第一步
第二步
第三步
第四步
*
三、实验室制气体的思路
气体制备装置的连接顺序
气体发生装置
气体净化装置
气体干燥装置
气体收集或性质检验装置
尾气吸收装置
*
三、实验室制气体的思路
选择依据
反应原理、反应物的状态、反应条件等。
装置的基本类型
固体+固体 气体
固体+液体 气体
固体+液体 气体
KMnO4、KClO3(MnO2)制备氧气
HCl + CaCO3
HCl(浓) + MnO2
*
三、实验室制气体的思路
净化原则
实验室制备气体的净化装置的选择
装置Ⅰ(洗气瓶):长管进,短管出。
不减少被净化气体的量;不引入新杂质;操作简便,易于分离。
净化装置
装置Ⅱ(干燥管):粗口进,细口出。
液体干燥剂:浓硫酸
固体干燥剂:五氧化二磷、无水CaCl2、碱石灰、硅胶等
*
三、实验室制气体的思路
实验室制备气体的收集装置的选择
选择依据
根据气体的密度、水溶性及是否与水或空气中的O2发生反应来确定气体的收集方法。
方法选择
排水法:适用于难溶于水且不与水反应的气体,如O2、H2等。
向上排空气法:气体不与空气反应,且密度比空气大,如O2、CO2、Cl2等。
向下排空气法:气体不与空气反应,且密度比空气小,如H2等。
*
三、实验室制气体的思路
实验室制备气体的尾气处理装置的选择
选择依据:
根据气体的物理、化学性质,将气体转化成无毒物质或吸收。
A
B
C
D
难吸收易燃的可以点燃处理,选用C;
难吸收的少量尾气可以先收集,选用D。
其他在液体中溶解度不大的气体用装置A;
溶解度极大的气体易倒吸,选用B可防倒吸。
Cl2 、HCl 、CO、NO
A B C D
*
