人教版高中化学必修第一册第二章海水中的重要元素——钠和氯2.3.2气体摩尔体积课件(24页ppt)
文档属性
| 名称 | 人教版高中化学必修第一册第二章海水中的重要元素——钠和氯2.3.2气体摩尔体积课件(24页ppt) |

|
|
| 格式 | ppt | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-12 00:00:00 | ||
图片预览






文档简介
(共24张PPT)
第二章 海水中的重要元素—钠和氯
第三节 物质的量
第2课时 气体摩尔体积
了解气体摩尔体积的概念;
能从宏观和微观两个方面了解影响气体体积的因素;
能进行气体摩尔体积的简单判断和计算。
认识阿伏加德罗定律及推论,学会有关的简单计算。
掌握气体物质的摩尔质量的计算方法。
巩固物质的量与粒子数、摩尔质量及摩尔体积之间的相关计算公式。
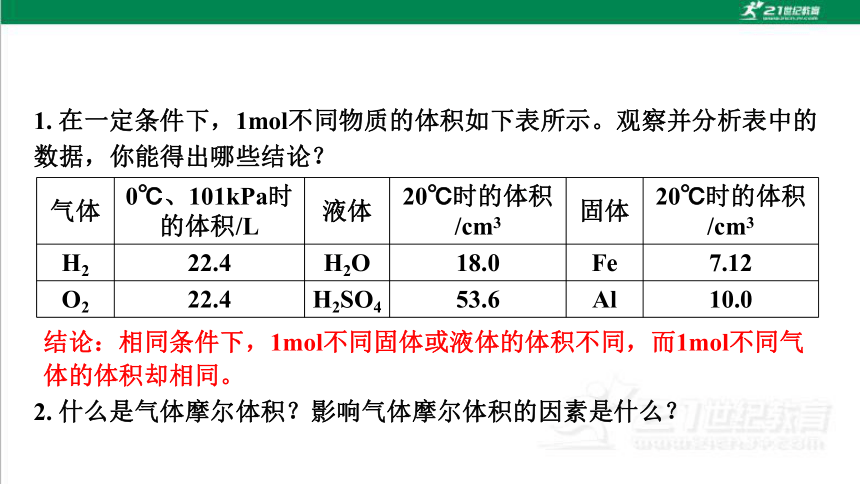
1. 在一定条件下,1mol不同物质的体积如下表所示。观察并分析表中的数据,你能得出哪些结论?
气体 0℃、101kPa时的体积/L 液体 20℃时的体积/cm3 固体 20℃时的体积/cm3
H2 22.4 H2O 18.0 Fe 7.12
O2 22.4 H2SO4 53.6 Al 10.0
2. 什么是气体摩尔体积?影响气体摩尔体积的因素是什么?
结论:相同条件下,1mol不同固体或液体的体积不同,而1mol不同气体的体积却相同。
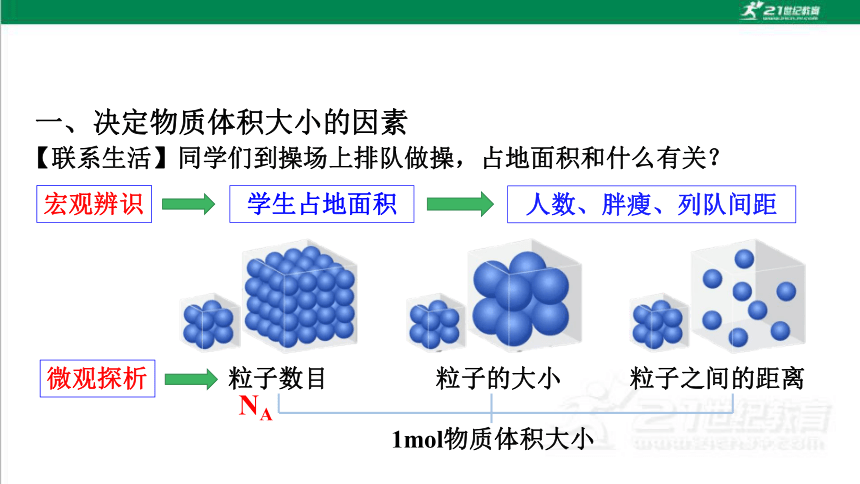
一、决定物质体积大小的因素
粒子数目
粒子的大小
粒子之间的距离
1mol物质体积大小
NA
【联系生活】同学们到操场上排队做操,占地面积和什么有关?
人数、胖瘦、列队间距
宏观辨识
学生占地面积
微观探析
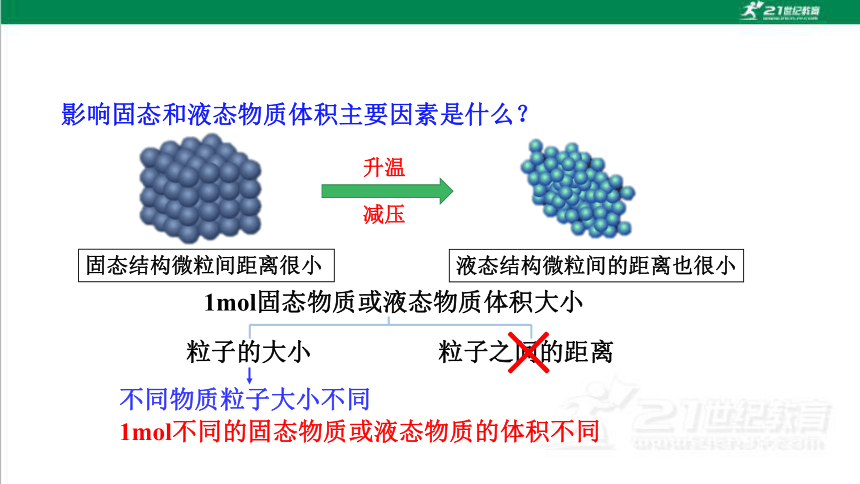
1mol固态物质或液态物质体积大小
粒子的大小
粒子之间的距离
×
不同物质粒子大小不同
1mol不同的固态物质或液态物质的体积不同
升温
减压
固态结构微粒间距离很小
液态结构微粒间的距离也很小
影响固态和液态物质体积主要因素是什么?
1mol气体体积大小
粒子的大小
粒子之间的距离
任何气体粒子之间的距离近似相等
1mol任何气体的体积大致相同
<
影响气态物质体积主要因素是什么?
【联系生活】生活中燃烧的液化石油气的主要成分有乙烯、乙烷、丙烯、丙烷和丁烷等,在气瓶内呈液态状,一旦流出会汽化成比原体积大约二百五十倍的可燃气体,并极易扩散,遇到明火就会燃烧或爆炸。
升温
减压
二、气体摩尔体积
22.4L
(标准状况)
6.02×1023分子
标准状况下的气体摩尔体积示意图
Vm的大小与温度和压强有关
1. 概念:
2. 符号:
单位:
3. 数值:
标准状况下,
1mol任何气体的体积约为22.4L
1 mol 任何气体,可以是单一纯净气体,也可以是混合气体
单位物质的量的气体所占的体积
Vm
L/mol(或L·mol-1)、m3/mol(或m3·mol-1)
0℃(273K)、 101kPa下,Vm ≈ 22.4L/mol
25℃、101kPa下,
Vm ≈ 24.5L/mol
标况(0℃,101 kPa)下,HF、H2O、SO3、CCl4、酒精等不属于气态
练习:判断下列说法是否正确?
(1) 标况下,1 mol任何物质的体积都约为22.4 L。
(2) 1 mol H2的体积约为22.4 L。
(3) 标况下,1 mol O2和N2混合气的体积约为22.4 L。
(4 ) 22.4 L气体所含分子数一定大于11.2 L气体所含的分子数。
(5)只有在标况下,气体的摩尔体积才能是22.4 L。
强调:①气体摩尔体积不适用于固体和液体,仅适用于气体。
×
×
×
×
②谈到气体体积时必须注明外界条件。
(纯气体、混合气体)
标况下Vm ≈ 22.4 L/mol,非标况下Vm不一定等于22.4 L/mol。
摩尔质量 气体摩尔体积
概念
符号
单位
影响因素
计算公式
单位物质的量的物质所具有的质量
单位物质的量的气体所占有的体积
M
Vm
g/mol或g·mol-1
L/mol(或L·mol-1)和m3/mol
定值,
与质量、物质的量无关
温度、压强
n =
m
M
n =
V
Vm
【公式的运用】
例:标准状况下,67.2L的O2物质的量是多少?含有多少个O2分子?
解:
n(O2) =
V(O2)
Vm
=
67.2L
22.4L/mol
= 3mol
或 V=n·Vm
n=V/Vm
Vm=V/n
变式
N(O2) = n(O2) · NA(O2) = 3mol · NA = 3NA
标准状况下的气体摩尔体积(Vm=22.4 L/mol)理解要点:
结论
3. 单位:
Vm=
V
n
4. 公式:
2. 符号:
1. 概念:
体积约占22.4L
Vm
单位物质的量的气体所占的体积
L/mol (L · mol-1) 和 m3/mol
气体摩尔体积
条件:标准状况
对象:任何气体
物质的量:1mol
3. 标准状况下,同质量的下列气体,体积最大的是( )
A. H2 B. NH3 C. N2 D. CO2
1. 下列说法正确的是( )
标准状况下任何气体的摩尔体积都是22.4 L
B. 非标准状况下,1 mol 任何气体的体积不可能为22.4 L
C. 标准状况下,22.4 L任何气体都含有约6.02×1023个原子
D. 1 mol H2和O2的混合气体在标准状况下的体积约为22.4 L
2. 0.5 mol O2的体积为( )
A. 11.2 L B. 16 L C. 22.4 L D. 无法确定
4. (1)标况下,33.6 L H2的物质的量是 mol。
(2)标况下,11.2 L N2 中含有N2分子的个数是 。
(3)在标准状况下,测得1.92 g某气体的体积为672 mL。
则此气体的摩尔质量是 。
5. (1)等质量的O2和SO2,物质的量之比为_______,在相同条件下的体积之比为_______,原子数之比为_______。
(2)同温同压下,相同体积的CO2和O2的质量比为_______。
【答案】1. D 2. D 3. A 4.(1)1.5 (2)0.5NA (3)64g/mol
2:1
2:1
4:3
11:8
气体分子间的平均距离随温度、压强的变化而变化
阿伏加德罗定律
同温同压下,如果气体体积相同,则气体的物质的量是否也相同呢? 所含分子数呢?
同温同压下,相同体积气体的物质的量相等,所含分子个数也相等。
在一定温度和压强下,各种气体分子间的平均距离相等
一、理想气体状态方程
pV=nRT
气体体积
压强
物质的量
开氏温度,T(K)=273 + t(℃)
常数,数值约8.314Pa·m3/(K·mol)
1.含义:同温同压下,相同体积的任何气体都含有相同数目的粒子。
2. 适用范围:任何气体,可以是单一气体,也可以是混合气体。
即:V1 = V2,则n1 = n2,N1 = N2
二、阿伏加德罗定律
3. “三同定一同”规律:同温、同压、同体积、同分子数。只要有“三同”则必有第“四同”。
例:如图为两瓶体积相等的气体,同温同压下二者不相同的是( )
A. 物质的量 B. 分子数
C. 原子数 D. 质量
D
例1:相同条件下,下列气体所占体积最大的是( )
A. 6.02×1023个 SO2 B. 32 g O2
C. 标况下11.2 L H2S D. 3 g H2
推论1:同温同压下,气体体积之比 = 物质的量之比 = 分子数之比
D
变式1:瓦斯中甲烷与氧气的质量比为 1:4 时极易爆炸,此时甲烷与氧气的体积比为( )
A. 1:4 B. 1:2 C. 1:1 D. 2:1
B
N1
=
N2
三、阿伏加德罗定律推论
推论2:同温同压下,气体密度之比 = 摩尔质量之比
M
M
m
m
=
2
1
2
1
气体体积相同时
气体质量相同时
M
M
V
V
=
2
1
1
2
例2:同温同压下,在体积相同的气球中分别充入H2、O2、CO2、SO2,质量最小的气球是( )
A. H2 B. O2 C. CO2 D. SO2
A
变式2:标准状况下,32 g某气体的分子数目与22 g CO2的分子数目相同,则该气体的摩尔质量为( )
A. 32 B. 32 g/mol C. 64 g/mol D. 64
C
变式3:同温同压下,A容器中充满O2,B容器中充满O3。
(1)若所含分子总数相等,则A容器和B容器的容积之比是________。
(2)若两容器中所含气体原子总数相等,则A容器和B容器的容积之比是________。
(3)若两容器的容积之比为3:2,则O2和O3的物质的量之比为________,质量之比为_________,密度之比为__________。
1:1
3:2
3:2
1:1
2:3
例3:一密闭容器中有一可自由滑动的隔板(厚度不计)将容器分为两部分,当右边充入0.1mol C2H4,左边充入一定量SO2时,隔板处于如图位置(保持温度不变),下列说法正确的是( )
A. 右边与左边的分子数之比为4:1
B. 左侧SO2所含氧原子数为1.2NA
C. 左侧气体密度是相同条件下氢气密度的16倍
D. 若使左右两边体积相同,可在容器右边再充入8.4gN2
推论3:同温同体积下,气体压强之比 = 物质的量之比 = 分子数之比
2
1
2
1
n
n
P
P
=
N1
=
N2
D
一、理想气体状态方程
pV=nRT
二、阿伏加德罗定律
同温同压下,相同体积的任何气体都含有相同数目的粒子。
推1:同温同压下,气体体积之比 = 物质的量之比 = 分子数之比
推2:同温同压下,气体密度之比 = 摩尔质量之比
推3:同温同体积下,气体压强之比 = 物质的量之比 = 分子数之比
3. 在一定温度和压强下,1体积X2(气)和3体积Y2(气)化合生成2体积化合物,则该化合物的分子式是( )
A. XY3 B. XY C. X3Y D. X2Y3
1. 体积相同的甲乙两容器,一个充满CO,另一个充满CH4气体。同温同压下,两容器内气体一定具有相同的( )
A. 原子总数 B. 分子总数 C. 电子总数 D. 质子总数
2. 同温同压下,在两个容积相同的容器中,一个盛有C2H4气体,另一个盛有N2和CO的混合气体。两容器内的气体一定具有相同的( )
①分子数 ②密度 ③质量 ④质子数 ⑤原子数 ⑥电子数
A. ①④⑥ B. ①②⑤ C. ③④⑥ D. ①②③
4. 同温同压下,16.5 g气体X 所占体积与12 g O2的体积相同,则X的相对分子质量是( )
A. 22 B. 28 C . 44 D. 88
5. 在相同温度压强下,实验室制得的下列体积的气体密度由大到小的顺序正确的是( )
①10mL O2 ②20mL H2 ③30mL Cl2 ④40mL CO2
A. ③④①② B. ④③②① C. ①②③④ D. 无法确定
【答案】BDACA
6. 下列说法中正确的是(NA代表阿伏加德罗常数的数值)( )
A. 同温同压下,相同体积的任何气体单质所含的原子数目相同
B. 22gCO2的物质的量是0.5mol,其体积为11.2L
C. 常温常压下,11.2L氮气所含的原子数目为NA
D. 17gNH3所含电子数目为10NA
D
7. 在同温同压下,同体积CH4和CO2分子数之比为_____,物质的量之比为_____,原子总数之比为_____,质量之比为_____,密度之比为_____。
8. 在标准状况下,4g H2、11.2L O2、1mol H2O中,所含分子数最多的是________,含原子数最多的是_________,质量最大的是_________,体积最小的是_________。
1:1
1:1
5:3
4:11
4:11
H2
H2
H2O
H2O
第二章 海水中的重要元素—钠和氯
第三节 物质的量
第2课时 气体摩尔体积
了解气体摩尔体积的概念;
能从宏观和微观两个方面了解影响气体体积的因素;
能进行气体摩尔体积的简单判断和计算。
认识阿伏加德罗定律及推论,学会有关的简单计算。
掌握气体物质的摩尔质量的计算方法。
巩固物质的量与粒子数、摩尔质量及摩尔体积之间的相关计算公式。
1. 在一定条件下,1mol不同物质的体积如下表所示。观察并分析表中的数据,你能得出哪些结论?
气体 0℃、101kPa时的体积/L 液体 20℃时的体积/cm3 固体 20℃时的体积/cm3
H2 22.4 H2O 18.0 Fe 7.12
O2 22.4 H2SO4 53.6 Al 10.0
2. 什么是气体摩尔体积?影响气体摩尔体积的因素是什么?
结论:相同条件下,1mol不同固体或液体的体积不同,而1mol不同气体的体积却相同。
一、决定物质体积大小的因素
粒子数目
粒子的大小
粒子之间的距离
1mol物质体积大小
NA
【联系生活】同学们到操场上排队做操,占地面积和什么有关?
人数、胖瘦、列队间距
宏观辨识
学生占地面积
微观探析
1mol固态物质或液态物质体积大小
粒子的大小
粒子之间的距离
×
不同物质粒子大小不同
1mol不同的固态物质或液态物质的体积不同
升温
减压
固态结构微粒间距离很小
液态结构微粒间的距离也很小
影响固态和液态物质体积主要因素是什么?
1mol气体体积大小
粒子的大小
粒子之间的距离
任何气体粒子之间的距离近似相等
1mol任何气体的体积大致相同
<
影响气态物质体积主要因素是什么?
【联系生活】生活中燃烧的液化石油气的主要成分有乙烯、乙烷、丙烯、丙烷和丁烷等,在气瓶内呈液态状,一旦流出会汽化成比原体积大约二百五十倍的可燃气体,并极易扩散,遇到明火就会燃烧或爆炸。
升温
减压
二、气体摩尔体积
22.4L
(标准状况)
6.02×1023分子
标准状况下的气体摩尔体积示意图
Vm的大小与温度和压强有关
1. 概念:
2. 符号:
单位:
3. 数值:
标准状况下,
1mol任何气体的体积约为22.4L
1 mol 任何气体,可以是单一纯净气体,也可以是混合气体
单位物质的量的气体所占的体积
Vm
L/mol(或L·mol-1)、m3/mol(或m3·mol-1)
0℃(273K)、 101kPa下,Vm ≈ 22.4L/mol
25℃、101kPa下,
Vm ≈ 24.5L/mol
标况(0℃,101 kPa)下,HF、H2O、SO3、CCl4、酒精等不属于气态
练习:判断下列说法是否正确?
(1) 标况下,1 mol任何物质的体积都约为22.4 L。
(2) 1 mol H2的体积约为22.4 L。
(3) 标况下,1 mol O2和N2混合气的体积约为22.4 L。
(4 ) 22.4 L气体所含分子数一定大于11.2 L气体所含的分子数。
(5)只有在标况下,气体的摩尔体积才能是22.4 L。
强调:①气体摩尔体积不适用于固体和液体,仅适用于气体。
×
×
×
×
②谈到气体体积时必须注明外界条件。
(纯气体、混合气体)
标况下Vm ≈ 22.4 L/mol,非标况下Vm不一定等于22.4 L/mol。
摩尔质量 气体摩尔体积
概念
符号
单位
影响因素
计算公式
单位物质的量的物质所具有的质量
单位物质的量的气体所占有的体积
M
Vm
g/mol或g·mol-1
L/mol(或L·mol-1)和m3/mol
定值,
与质量、物质的量无关
温度、压强
n =
m
M
n =
V
Vm
【公式的运用】
例:标准状况下,67.2L的O2物质的量是多少?含有多少个O2分子?
解:
n(O2) =
V(O2)
Vm
=
67.2L
22.4L/mol
= 3mol
或 V=n·Vm
n=V/Vm
Vm=V/n
变式
N(O2) = n(O2) · NA(O2) = 3mol · NA = 3NA
标准状况下的气体摩尔体积(Vm=22.4 L/mol)理解要点:
结论
3. 单位:
Vm=
V
n
4. 公式:
2. 符号:
1. 概念:
体积约占22.4L
Vm
单位物质的量的气体所占的体积
L/mol (L · mol-1) 和 m3/mol
气体摩尔体积
条件:标准状况
对象:任何气体
物质的量:1mol
3. 标准状况下,同质量的下列气体,体积最大的是( )
A. H2 B. NH3 C. N2 D. CO2
1. 下列说法正确的是( )
标准状况下任何气体的摩尔体积都是22.4 L
B. 非标准状况下,1 mol 任何气体的体积不可能为22.4 L
C. 标准状况下,22.4 L任何气体都含有约6.02×1023个原子
D. 1 mol H2和O2的混合气体在标准状况下的体积约为22.4 L
2. 0.5 mol O2的体积为( )
A. 11.2 L B. 16 L C. 22.4 L D. 无法确定
4. (1)标况下,33.6 L H2的物质的量是 mol。
(2)标况下,11.2 L N2 中含有N2分子的个数是 。
(3)在标准状况下,测得1.92 g某气体的体积为672 mL。
则此气体的摩尔质量是 。
5. (1)等质量的O2和SO2,物质的量之比为_______,在相同条件下的体积之比为_______,原子数之比为_______。
(2)同温同压下,相同体积的CO2和O2的质量比为_______。
【答案】1. D 2. D 3. A 4.(1)1.5 (2)0.5NA (3)64g/mol
2:1
2:1
4:3
11:8
气体分子间的平均距离随温度、压强的变化而变化
阿伏加德罗定律
同温同压下,如果气体体积相同,则气体的物质的量是否也相同呢? 所含分子数呢?
同温同压下,相同体积气体的物质的量相等,所含分子个数也相等。
在一定温度和压强下,各种气体分子间的平均距离相等
一、理想气体状态方程
pV=nRT
气体体积
压强
物质的量
开氏温度,T(K)=273 + t(℃)
常数,数值约8.314Pa·m3/(K·mol)
1.含义:同温同压下,相同体积的任何气体都含有相同数目的粒子。
2. 适用范围:任何气体,可以是单一气体,也可以是混合气体。
即:V1 = V2,则n1 = n2,N1 = N2
二、阿伏加德罗定律
3. “三同定一同”规律:同温、同压、同体积、同分子数。只要有“三同”则必有第“四同”。
例:如图为两瓶体积相等的气体,同温同压下二者不相同的是( )
A. 物质的量 B. 分子数
C. 原子数 D. 质量
D
例1:相同条件下,下列气体所占体积最大的是( )
A. 6.02×1023个 SO2 B. 32 g O2
C. 标况下11.2 L H2S D. 3 g H2
推论1:同温同压下,气体体积之比 = 物质的量之比 = 分子数之比
D
变式1:瓦斯中甲烷与氧气的质量比为 1:4 时极易爆炸,此时甲烷与氧气的体积比为( )
A. 1:4 B. 1:2 C. 1:1 D. 2:1
B
N1
=
N2
三、阿伏加德罗定律推论
推论2:同温同压下,气体密度之比 = 摩尔质量之比
M
M
m
m
=
2
1
2
1
气体体积相同时
气体质量相同时
M
M
V
V
=
2
1
1
2
例2:同温同压下,在体积相同的气球中分别充入H2、O2、CO2、SO2,质量最小的气球是( )
A. H2 B. O2 C. CO2 D. SO2
A
变式2:标准状况下,32 g某气体的分子数目与22 g CO2的分子数目相同,则该气体的摩尔质量为( )
A. 32 B. 32 g/mol C. 64 g/mol D. 64
C
变式3:同温同压下,A容器中充满O2,B容器中充满O3。
(1)若所含分子总数相等,则A容器和B容器的容积之比是________。
(2)若两容器中所含气体原子总数相等,则A容器和B容器的容积之比是________。
(3)若两容器的容积之比为3:2,则O2和O3的物质的量之比为________,质量之比为_________,密度之比为__________。
1:1
3:2
3:2
1:1
2:3
例3:一密闭容器中有一可自由滑动的隔板(厚度不计)将容器分为两部分,当右边充入0.1mol C2H4,左边充入一定量SO2时,隔板处于如图位置(保持温度不变),下列说法正确的是( )
A. 右边与左边的分子数之比为4:1
B. 左侧SO2所含氧原子数为1.2NA
C. 左侧气体密度是相同条件下氢气密度的16倍
D. 若使左右两边体积相同,可在容器右边再充入8.4gN2
推论3:同温同体积下,气体压强之比 = 物质的量之比 = 分子数之比
2
1
2
1
n
n
P
P
=
N1
=
N2
D
一、理想气体状态方程
pV=nRT
二、阿伏加德罗定律
同温同压下,相同体积的任何气体都含有相同数目的粒子。
推1:同温同压下,气体体积之比 = 物质的量之比 = 分子数之比
推2:同温同压下,气体密度之比 = 摩尔质量之比
推3:同温同体积下,气体压强之比 = 物质的量之比 = 分子数之比
3. 在一定温度和压强下,1体积X2(气)和3体积Y2(气)化合生成2体积化合物,则该化合物的分子式是( )
A. XY3 B. XY C. X3Y D. X2Y3
1. 体积相同的甲乙两容器,一个充满CO,另一个充满CH4气体。同温同压下,两容器内气体一定具有相同的( )
A. 原子总数 B. 分子总数 C. 电子总数 D. 质子总数
2. 同温同压下,在两个容积相同的容器中,一个盛有C2H4气体,另一个盛有N2和CO的混合气体。两容器内的气体一定具有相同的( )
①分子数 ②密度 ③质量 ④质子数 ⑤原子数 ⑥电子数
A. ①④⑥ B. ①②⑤ C. ③④⑥ D. ①②③
4. 同温同压下,16.5 g气体X 所占体积与12 g O2的体积相同,则X的相对分子质量是( )
A. 22 B. 28 C . 44 D. 88
5. 在相同温度压强下,实验室制得的下列体积的气体密度由大到小的顺序正确的是( )
①10mL O2 ②20mL H2 ③30mL Cl2 ④40mL CO2
A. ③④①② B. ④③②① C. ①②③④ D. 无法确定
【答案】BDACA
6. 下列说法中正确的是(NA代表阿伏加德罗常数的数值)( )
A. 同温同压下,相同体积的任何气体单质所含的原子数目相同
B. 22gCO2的物质的量是0.5mol,其体积为11.2L
C. 常温常压下,11.2L氮气所含的原子数目为NA
D. 17gNH3所含电子数目为10NA
D
7. 在同温同压下,同体积CH4和CO2分子数之比为_____,物质的量之比为_____,原子总数之比为_____,质量之比为_____,密度之比为_____。
8. 在标准状况下,4g H2、11.2L O2、1mol H2O中,所含分子数最多的是________,含原子数最多的是_________,质量最大的是_________,体积最小的是_________。
1:1
1:1
5:3
4:11
4:11
H2
H2
H2O
H2O
