人教版高中化学必修第一册第二章海水中的重要元素——钠和氯2.1.1活泼的金属单质—钠课件(20页ppt)
文档属性
| 名称 | 人教版高中化学必修第一册第二章海水中的重要元素——钠和氯2.1.1活泼的金属单质—钠课件(20页ppt) |

|
|
| 格式 | ppt | ||
| 文件大小 | 7.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-12 09:08:52 | ||
图片预览






文档简介
(共20张PPT)
第二章 海水中的重要元素——钠和氯
海洋是一个巨大的化学资源宝库,含有80多种元素。
钠、氯是其中含量较高的元素,也是典型的金属元素和非金属元素。
课时
安排
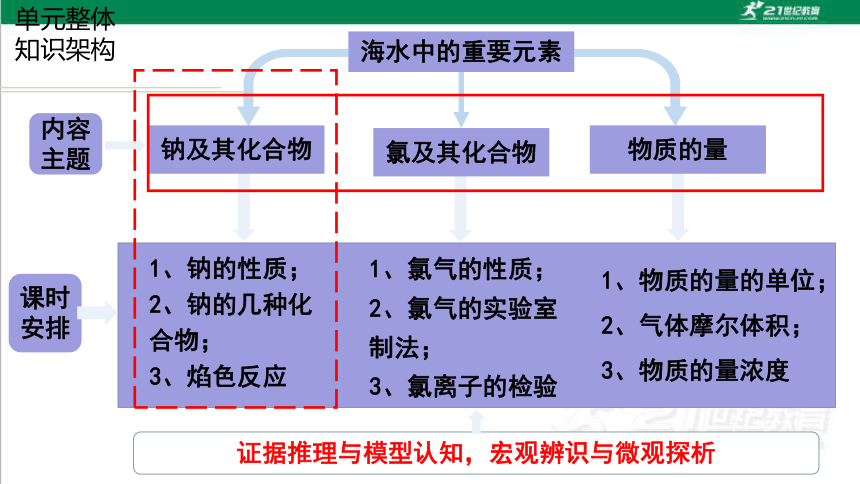
海水中的重要元素
单元整体
知识架构
钠及其化合物
氯及其化合物
物质的量
内容
主题
1、钠的性质;
2、钠的几种化合物;
3、焰色反应
1、氯气的性质;
2、氯气的实验室制法;
3、氯离子的检验
1、物质的量的单位;
2、气体摩尔体积;
3、物质的量浓度
证据推理与模型认知,宏观辨识与微观探析
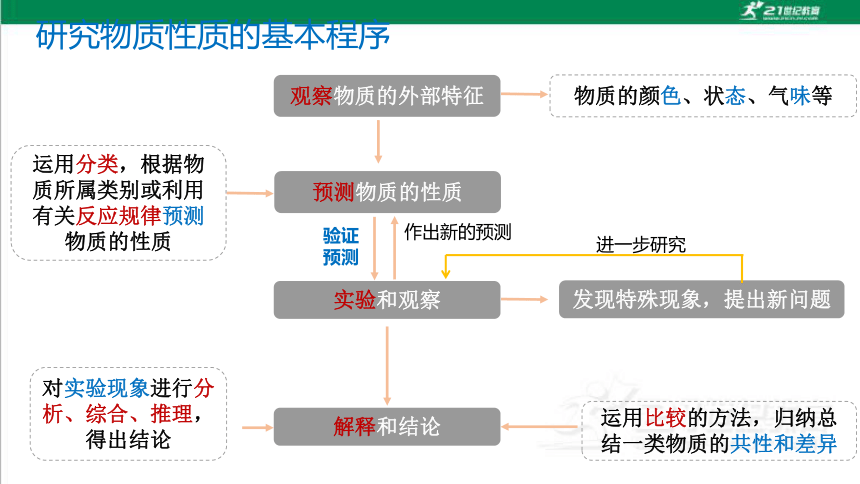
观察物质的外部特征
预测物质的性质
实验和观察
解释和结论
物质的颜色、状态、气味等
运用分类,根据物质所属类别或利用有关反应规律预测物质的性质
对实验现象进行分析、综合、推理,得出结论
运用比较的方法,归纳总结一类物质的共性和差异
研究物质性质的基本程序
验证预测
作出新的预测
发现特殊现象,提出新问题
进一步研究
第一节
钠及其化合物
第二章 海水中的重要元素——钠和氯
第1课时 活泼的金属单质——钠
核心素养发展目标
1.能从物质类别、元素价态的角度,依据复分解反应和氧化还原反应原理预测钠的化学性质,并尝试设计实验验证、分析解释有关实验现象。
2.通过实验探究钠的性质,掌握研究物质性质的一般程序和科学方法(观察、实验、分类、比较)。
01 钠的物理性质
02 钠的化学性质
03 钠的用途
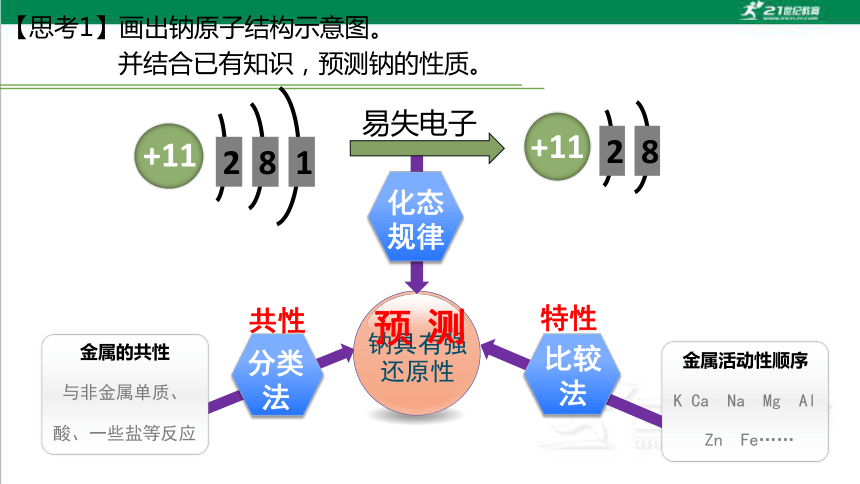
【思考1】画出钠原子结构示意图。
并结合已有知识,预测钠的性质。
钠具有强还原性
金属的共性
与非金属单质、
酸、一些盐等反应
预
测
金属活动性顺序
K Ca Na Mg Al
Zn Fe……
共性
分类法
特性
比较法
+11
2
1
8
+11
2
8
易失电子
化态规律
实验一:钠的切割
如何取用金属钠?
实验室应该如何保存金属钠?
钠的物理性质?
切开后的现象和原因?
【观察与思考】
一:钠的物理性质
图2-2 切割钠
二、钠的化学性质—与氧气反应
切开后的现象和原因:
4Na + O2 2Na2O
(2)
剧烈反应
Na2O2(过氧化钠)
(1)
受热后熔化
(4)
生成淡黄色固体
(3)
发出黄色火焰
2Na + O2
△
二、钠的化学性质—与氧气反应
条件不同,现象不同,产物不同。
结
论
二、钠的化学性质—与氧气反应
【预测】从物质组成及氧化还原反应的角度,预测钠与水反应的生成物: 。
实验三:钠与水的反应
Na→Na+
H2O→H2↑
化合价↓
化合价↑
氧化还原反应
物质组成
OH-
实验三:钠与水的反应
钠在水中的位置,
钠的形状的变化,
溶液颜色的变化,
分析实验现象,
能得出哪些结论?
【观察与思考】
实验现象 分析和结论
浮在水面上
熔化成小球
水面四处游动
发出嘶嘶的响声
溶液成红色
思考:如何验证生成的气体是氢气?
点燃
二、钠的化学性质—与水反应
隔绝空气和水,
钠的密度大于煤油,且不与煤油反应
学以致用
钠着火时,能否用水灭火
不能用水灭火,
应用干燥的沙土盖灭。
钠为什么保存在煤油或石蜡油中?
思考1:钠与酸反应吗?
如果能,请写出钠与盐酸的反应方程式。
思考2:钠比铜活泼,那么钠能从硫酸铜溶液中置换出铜单质吗?
2NaOH+CuSO4=====Cu(OH)2+Na2SO4
Na
代表物
物理
性质
化学
性质
研究内容
金属单质
物质类别
硬度小
熔点低
密度比水的小
电和热的良导体
银白色固体,有金属光泽
课堂小结
强还原性
与氧气反应(化合)
与水反应(置换)
与酸反应(置换)
与盐溶液反应(先与水反应)
制备过氧化钠
1
除水剂
2
冶炼钛等贵金属
3
制备钠-硫新型电池、
制备染料、 制药的中间体
4
核反应堆冷却剂
5
高压钠灯
6
三、钠的用途
结构决定性质
性质决定用途
第二章 海水中的重要元素——钠和氯
海洋是一个巨大的化学资源宝库,含有80多种元素。
钠、氯是其中含量较高的元素,也是典型的金属元素和非金属元素。
课时
安排
海水中的重要元素
单元整体
知识架构
钠及其化合物
氯及其化合物
物质的量
内容
主题
1、钠的性质;
2、钠的几种化合物;
3、焰色反应
1、氯气的性质;
2、氯气的实验室制法;
3、氯离子的检验
1、物质的量的单位;
2、气体摩尔体积;
3、物质的量浓度
证据推理与模型认知,宏观辨识与微观探析
观察物质的外部特征
预测物质的性质
实验和观察
解释和结论
物质的颜色、状态、气味等
运用分类,根据物质所属类别或利用有关反应规律预测物质的性质
对实验现象进行分析、综合、推理,得出结论
运用比较的方法,归纳总结一类物质的共性和差异
研究物质性质的基本程序
验证预测
作出新的预测
发现特殊现象,提出新问题
进一步研究
第一节
钠及其化合物
第二章 海水中的重要元素——钠和氯
第1课时 活泼的金属单质——钠
核心素养发展目标
1.能从物质类别、元素价态的角度,依据复分解反应和氧化还原反应原理预测钠的化学性质,并尝试设计实验验证、分析解释有关实验现象。
2.通过实验探究钠的性质,掌握研究物质性质的一般程序和科学方法(观察、实验、分类、比较)。
01 钠的物理性质
02 钠的化学性质
03 钠的用途
【思考1】画出钠原子结构示意图。
并结合已有知识,预测钠的性质。
钠具有强还原性
金属的共性
与非金属单质、
酸、一些盐等反应
预
测
金属活动性顺序
K Ca Na Mg Al
Zn Fe……
共性
分类法
特性
比较法
+11
2
1
8
+11
2
8
易失电子
化态规律
实验一:钠的切割
如何取用金属钠?
实验室应该如何保存金属钠?
钠的物理性质?
切开后的现象和原因?
【观察与思考】
一:钠的物理性质
图2-2 切割钠
二、钠的化学性质—与氧气反应
切开后的现象和原因:
4Na + O2 2Na2O
(2)
剧烈反应
Na2O2(过氧化钠)
(1)
受热后熔化
(4)
生成淡黄色固体
(3)
发出黄色火焰
2Na + O2
△
二、钠的化学性质—与氧气反应
条件不同,现象不同,产物不同。
结
论
二、钠的化学性质—与氧气反应
【预测】从物质组成及氧化还原反应的角度,预测钠与水反应的生成物: 。
实验三:钠与水的反应
Na→Na+
H2O→H2↑
化合价↓
化合价↑
氧化还原反应
物质组成
OH-
实验三:钠与水的反应
钠在水中的位置,
钠的形状的变化,
溶液颜色的变化,
分析实验现象,
能得出哪些结论?
【观察与思考】
实验现象 分析和结论
浮在水面上
熔化成小球
水面四处游动
发出嘶嘶的响声
溶液成红色
思考:如何验证生成的气体是氢气?
点燃
二、钠的化学性质—与水反应
隔绝空气和水,
钠的密度大于煤油,且不与煤油反应
学以致用
钠着火时,能否用水灭火
不能用水灭火,
应用干燥的沙土盖灭。
钠为什么保存在煤油或石蜡油中?
思考1:钠与酸反应吗?
如果能,请写出钠与盐酸的反应方程式。
思考2:钠比铜活泼,那么钠能从硫酸铜溶液中置换出铜单质吗?
2NaOH+CuSO4=====Cu(OH)2+Na2SO4
Na
代表物
物理
性质
化学
性质
研究内容
金属单质
物质类别
硬度小
熔点低
密度比水的小
电和热的良导体
银白色固体,有金属光泽
课堂小结
强还原性
与氧气反应(化合)
与水反应(置换)
与酸反应(置换)
与盐溶液反应(先与水反应)
制备过氧化钠
1
除水剂
2
冶炼钛等贵金属
3
制备钠-硫新型电池、
制备染料、 制药的中间体
4
核反应堆冷却剂
5
高压钠灯
6
三、钠的用途
结构决定性质
性质决定用途
