人教版高中化学必修第一册第二章海水中的重要元素——钠和氯2.4整理与提升课件(30页ppt)
文档属性
| 名称 | 人教版高中化学必修第一册第二章海水中的重要元素——钠和氯2.4整理与提升课件(30页ppt) |

|
|
| 格式 | ppt | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-12 00:00:00 | ||
图片预览








文档简介
(共30张PPT)
知识整理与能力提升
第二章 海水中的重要元素——钠和氯
学习目标
1.能从物质类别、元素价态的角度,依据复分解反应和氧化还原反应原理,掌握钠及其化合物、氯及其化合物的化学性质和变化。
2.能利用钠和氯的典型代表物的性质和反应,设计常见物质制备、分离、提纯、检验等简单任务的方案。
3.能根据钠及其化合物、氯及其化合物等物质的性质分析实验室、生产、生活以及环境中的某些常见问题,说明妥善保存、合理使用化学品的常用方法。
4.能说明钠及其化合物、氯及其化合物的应用对社会发展的价值、对环境的影响。能有意识运用所学的知识或寻求相关证据参与有关环境保护、工业生产等社会性议题的讨论。
5.能基于物质的量认识物质组成及其化学变化,运用物质的量、摩尔质量、气体摩尔体积、物质的量浓度之间的相互关系进行简单计算
知识体系构建
一.物质的性质与转化
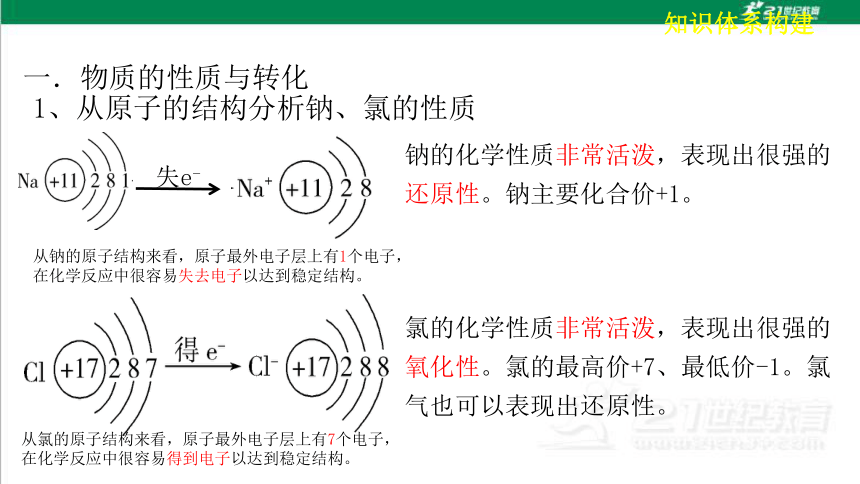
1、从原子的结构分析钠、氯的性质
失e-
氯的化学性质非常活泼,表现出很强的氧化性。氯的最高价+7、最低价-1。氯气也可以表现出还原性。
钠的化学性质非常活泼,表现出很强的还原性。钠主要化合价+1。
从钠的原子结构来看,原子最外电子层上有1个电子,在化学反应中很容易失去电子以达到稳定结构。
从氯的原子结构来看,原子最外电子层上有7个电子,在化学反应中很容易得到电子以达到稳定结构。
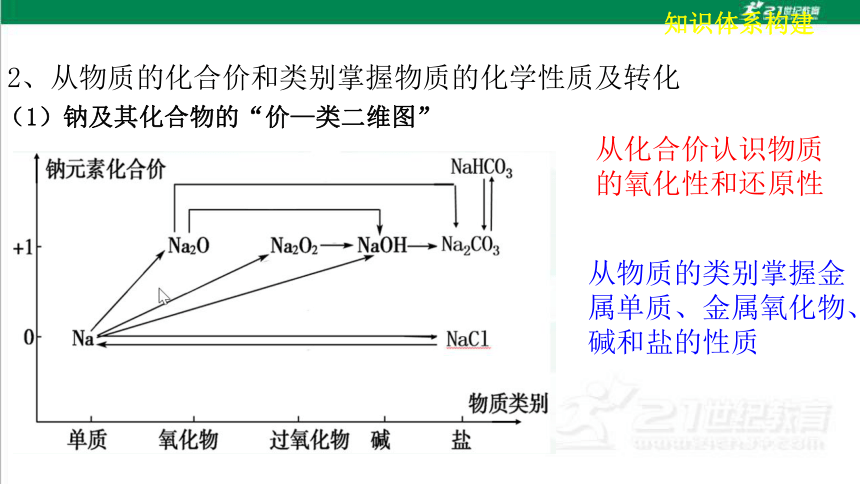
2、从物质的化合价和类别掌握物质的化学性质及转化
知识体系构建
从化合价认识物质的氧化性和还原性
从物质的类别掌握金属单质、金属氧化物、碱和盐的性质
(1)钠及其化合物的“价—类二维图”
涉及的主要反应有(写化学方程或离子方程式)
①Na和H2O反应
②Na在空气中燃烧
③Na2O2和H2O反应
④Na2O2和CO2反应
⑤向NaOH溶液中通入过量CO2
⑥将Na2CO3溶液与石灰乳混合
⑦向Na2CO3稀溶液中通入过量CO2
知识体系构建
⑧将NaHCO3溶液和NaOH溶液等物质的量混合
⑨将NaHCO3溶液与澄清石灰水等物质的量混合:
⑩将NaHCO3溶液与少量澄清石灰水混合
知识体系构建
知识能力运用
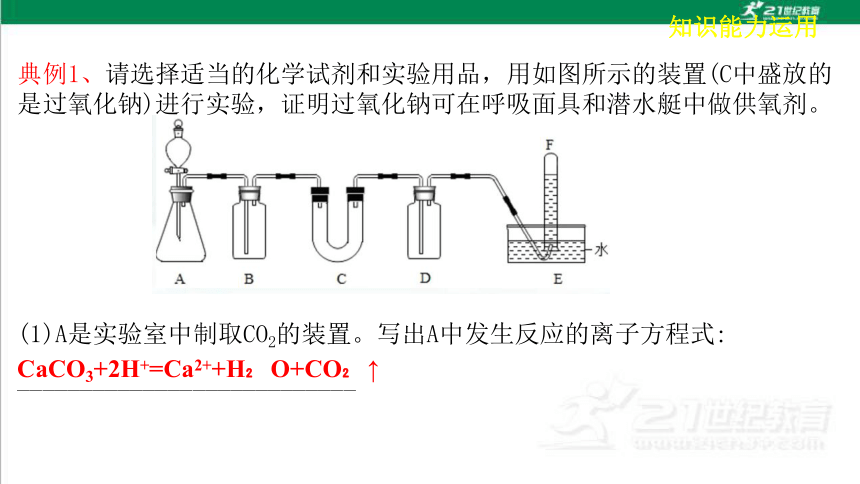
典例1、请选择适当的化学试剂和实验用品,用如图所示的装置(C中盛放的是过氧化钠)进行实验,证明过氧化钠可在呼吸面具和潜水艇中做供氧剂。
(1)A是实验室中制取CO2的装置。写出A中发生反应的离子方程式:
___________________________
CaCO3+2H+=Ca2++H O+CO ↑
(2)填写下表中的空白。
(3)写出C中发生反应的化学方程式__________________________
(4)F中得到的是_______如何验证
_________________________________________________________________________________________________________________________________________
装置序号 加入的试剂 加入该试剂的 目的
B 饱和 NaHCO3溶 液
D
把E中的导管移出水面,关闭分液漏斗活塞,用拇指堵住试管口,取出试管,将试管正立,松开拇指,立即把带火星的木条伸入试管内,木条复燃,证明试管中收集的气体是氧气。
氧气
2Na2O2+2H2O=4NaOH+O2↑ 2Na2O2+2CO2=2Na2CO3+O2
除去二氧化碳中混有的氯化氢气体
氢氧化钠溶液
除去生成氧气中混有的未反应的二氧化碳气体
(2)氯及其化合物的“价——类二维图”
知识体系构建
同种元素不同价态之间的转化分“歧化” 和“归中”
同价态之间的转化主要是酸性氧化物、酸和盐之间的化合反应或复分解反应
涉及的主要反应有(写化学方程式或离子方程式)
①Cl2与水反应:
②制漂白液:
③制漂白粉:
④实验室制Cl2:
⑤次氯酸分解:
知识体系构建
典例2、氯水中含有多种成分,因而具有多种性质,根据氯水分别与如图四种物质发生的反应填空(a、b、c、d重合部分代表物质间反应,且氯水足量)。
(1)能证明氯水具有漂白性的是____ (填“a、b 、c或d)。
(2)c过程中的现象是__________________________________,
b过程中反应的离子方程式为________________________。
(3)a过程中反应的化学方程式为______________________。
d
产生白色沉淀
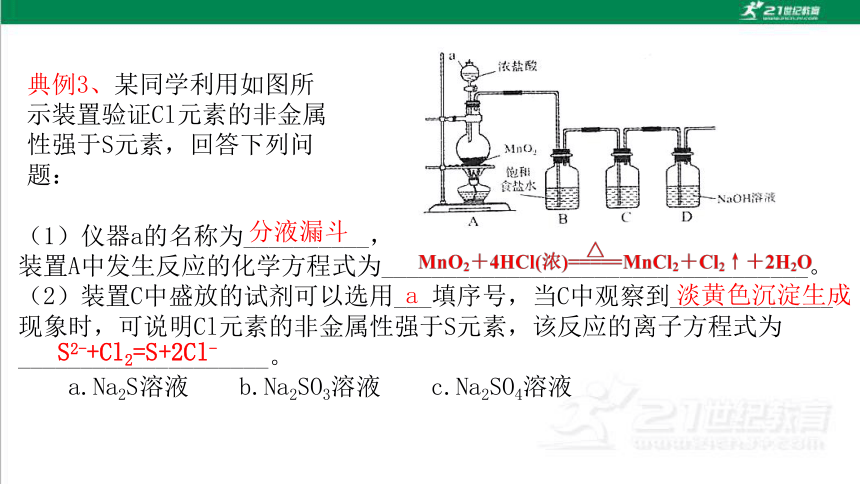
典例3、某同学利用如图所示装置验证Cl元素的非金属性强于S元素,回答下列问题:
(1)仪器a的名称为__________,
装置A中发生反应的化学方程式为__________________________________。
(2)装置C中盛放的试剂可以选用___填序号,当C中观察到_____________
现象时,可说明Cl元素的非金属性强于S元素,该反应的离子方程式为____________________。
a.Na2S溶液 b.Na2SO3溶液 c.Na2SO4溶液
分液漏斗
a
淡黄色沉淀生成
S2-+Cl2=S+2Cl-
发生装置
净化装置
收集装置
模块:
尾气处理
常见气体制备方法的模块化分析
发生装置
核心素养提升
二、宏观物质与微观粒子间的计量关系
1.物质的量
2.物质的量浓度
知识体系构建
典例4、(1)现有m g某气体,它由双原子分子构成,它的摩尔质量为
M g·mol-1。若阿伏加德罗常数值用NA表示,则:
①该气体的物质的量为 mol。
②该气体所含原子总数为 个。
③该气体在标准状况下的体积为 L。
(2)利用“化学计量在实验中的应用”的相关知识进行填空。
①含有6.02×1023个氧原子的H2SO4的物质的量是 mol。
②与标准状况下V L CO2所含氧原子数目相同的水的质量是________ (用分式表示)g。
③在一定的温度和压强下,1体积X2(g)跟3体积Y2(g)化合生成2体积化合
物,则该化合物的化学式是 。
m/M
2mNA/M
22.4m/M
0.25
45v/28
XY3
典例5、某品牌84消毒液,经折算,有效成分NaClO的含量为105 g/L。该消毒液NaClO的物质的量浓度是多少?
以1 L 消毒液为例进行计算
NaClO质量为 105 g
n
m
M
105 g
35.5 g/mol
1.41 mol
c
n
V(aq)
1 L
1.41 mol/L
1.41 mol
NaClO的物质的量为
分析过程:
NaClO的物质的量浓度为
典例6、以配制480 mL 1 mol·L-1 NaOH溶液为例,所需容量瓶的规格:________。
(1)计算(填写计算过程与结果):
m(NaOH)=____________________________________。
(2)称量:根据计算结果,称量固体质量。
(3)溶解:将称量好的固体放入烧杯中,加适量蒸馏水溶解,并用______搅拌;溶解过程中玻璃棒的作用为_______________。
(4)转移(移液):
①移液前需要将溶液冷却至室温。
②移液中玻璃棒的作用为_____。
(5)洗涤:用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,将洗涤液也都注入容量瓶
500 mL
1 mol·L-1×0.5 L×40 g·mol-1=20.0 g
玻璃棒
搅拌,加速溶解
引流
(6)定容:
①将蒸馏水注入容量瓶,在液面离容量瓶颈刻度线下________时,改用胶头滴管滴加蒸馏水。
②定容时要平视刻度线,至凹液面最低处与刻度线_____。
(7)摇匀:盖好瓶塞,上下反复颠倒,摇匀。
1~2 cm
相切
(8)误差分析,下列哪些操作会产生误差?对配制溶液浓度产生怎样的影响?(填“偏大”、“偏小”、“无影响”。)
1.引流时有少许液体溅出容量瓶外
2.定容后摇匀,液面低于刻度线,不施加措施
3.定容时加水高于刻度线,将多余液体吸出
4.用于溶解的小烧杯未洗涤
5.定容时俯视
偏小
无影响
偏小
偏小
偏大
课堂小结
1、有两试管分别装有Na2CO3和NaHCO3溶液,下列操作或判断正确的是( )
方案 操作 判断
A 分别加入澄清石灰水 产生沉淀的为Na2CO3
B 分别加入等浓度的稀盐酸 反应较剧烈的为Na2CO3
C 分别加入CaCl2溶液 产生沉淀的为Na2CO3
D 逐渐加入等浓度的盐酸 立即产生气泡的为Na2CO3
课堂达标
C
2、下列解释实验现象的化学(或离子)方程式正确的是( )
A.切开的金属Na露置于空气中,光亮表面逐渐变暗:2Na+O2=Na2O2
C.Na2O2在潮湿的空气中放置一段时间后,变成白色黏稠物:
2Na2O2+2CO2=2Na2CO3+O2
D.向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀:
2NaHCO3 Na2CO3 + H2O + CO2↑
B.除去碳酸钠固体中的少量碳酸氢钠杂质:
B
3.焰火晚会中的焰火与高中化学中“焰色试验”知识有关。下列有关“焰色试验”说法中正确的是( )
A.非金属单质燃烧时火焰均为无色
B.NaCl与Na2CO3灼烧时火焰颜色相同
C.焰色试验均应透过蓝色钴玻璃观察
D.所有金属及其化合物灼烧时火焰均有颜色
B
4.下列关于氯及其化合物的说法正确的是( )
A.漂白粉在空气中久置变质是因为漂白粉中的CaCl2与空气中的CO2反应生成CaCO3
B.ClO2具有强氧化性,可用于自来水的杀菌消毒
C.将Cl2与HCl混合气体通过饱和食盐水可得到纯净的Cl2
D.因漂白粉在空气中不稳定,故可用于漂白纸张
B
5.在体积相同的两个密闭容器中分别充满O2、O3气体,当这两个容器内温度和气体密度相等时,下列说法正确的是( )
A.两种气体的压强相等
B.O2比O3的质量小
C.两种气体的分子数目相等
D.两种气体的氧原子数目相等
D
6、如图是实验室配制好的两瓶NaOH溶液的标签(14%的NaOH溶液的密度为1.14 g·cm-3)。
14%的NaOH溶液的物质的量浓度及从瓶中取出20 mL该溶液中含有溶质的质量分别是( )
A.4.0 mol·L-1 3.2 g B.2.0 mol·L-1 3.2 g
C.4.0 mol·L-1 6.4 g D.2.0 mol·L-1 6.4 g
A
试回答下列问题:
(1)W、X、Y、Z的化学式分别是
W 、X 、
Y 、Z 。
(2)以上4个化学反应,属于氧化还原反应的是 (填反应序号),反应中氧化剂是 (写化学式), 还原剂是 (写化学式)。
(3)若④在溶液中进行,写出其离子方程式以及能用该离子方程式表示的另一个化学反应的化学方程式:
离子方程式:
7、有4种钠的化合物W、X、Y、Z,它们之间存在如下关系:
NaHCO3
Na2CO3
NaOH
Na2O2
Na2O2
Na2O2
②③
Ca(OH)2+K2CO3=2KOH+CaCO3↓
Ca2++C O32- =CaCO3↓
8、如图所涉及的物质均为中学化学中的常见物质,其中C为气态单质,D为黄绿色气体,E为固态单质,它们存在如下转化关系,反应中生成的水及次要产物均已略去。
(1)写出有关物质的化学式:
F__________,H__________
(2)指出MnO2在相关反应中的作用:
反应①中是_______剂,
反应②中是_______剂。
(3)若反应①是在加热条件下进行的,则A是__________ (填化学式,下同),
若反应①是在常温条件下进行的,则A是_______________。
(4)写出B与MnO2共热获得D的化学方程式:__________________________
Fe3O4
FeCl3
催化
氧化
KClO3
H2O2
9、洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病暴发的有效方法之一。漂白粉是常用的消毒剂。
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学方程式为 。
(2)漂白粉的有效成分是 (填化学式)。
(3)漂白粉溶于水后,受空气中CO2的作用,即产生有漂白、杀菌作用的次氯酸,发生化学反应的离子方程式为 。
(4)反应(1)和反应(3)中,属于氧化还原反应的是反应 (填编号)。
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
Ca(ClO)2
Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO
(1)
(5)瓶装漂白粉久置于空气中呈稀粥状而失效。试用化学方程式表示漂白
粉在空气中易失效的原因: 。
(6)已知浓盐酸和次氯酸钙能发生反应
Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O。用贮存很久的漂白粉与浓
盐酸制得的氯气中,可能含有的杂质气体是 (填字母)。
①CO2 ②HCl ③H2O ④H2
A.①②③ B.②③④ C.只有②③ D.只有①④
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,2HClO=2HCl+O2↑
A
10、某医用环境,次氯酸钠浓度需840 mg/L,每1体积该消毒液需要加多少体积水稀释,才能符合医用消毒液浓度要求
c(浓溶液)·V(浓溶液)
c(稀溶液)·V(稀溶液)
以1 L 消毒液为例进行计算
105 g/L·1 L
0.84 g/L·V(稀溶液)
840 mg/L 相当于 0.84 g/L
V(稀溶液)
125 L
每1体积消毒液加124体积水
知识整理与能力提升
第二章 海水中的重要元素——钠和氯
学习目标
1.能从物质类别、元素价态的角度,依据复分解反应和氧化还原反应原理,掌握钠及其化合物、氯及其化合物的化学性质和变化。
2.能利用钠和氯的典型代表物的性质和反应,设计常见物质制备、分离、提纯、检验等简单任务的方案。
3.能根据钠及其化合物、氯及其化合物等物质的性质分析实验室、生产、生活以及环境中的某些常见问题,说明妥善保存、合理使用化学品的常用方法。
4.能说明钠及其化合物、氯及其化合物的应用对社会发展的价值、对环境的影响。能有意识运用所学的知识或寻求相关证据参与有关环境保护、工业生产等社会性议题的讨论。
5.能基于物质的量认识物质组成及其化学变化,运用物质的量、摩尔质量、气体摩尔体积、物质的量浓度之间的相互关系进行简单计算
知识体系构建
一.物质的性质与转化
1、从原子的结构分析钠、氯的性质
失e-
氯的化学性质非常活泼,表现出很强的氧化性。氯的最高价+7、最低价-1。氯气也可以表现出还原性。
钠的化学性质非常活泼,表现出很强的还原性。钠主要化合价+1。
从钠的原子结构来看,原子最外电子层上有1个电子,在化学反应中很容易失去电子以达到稳定结构。
从氯的原子结构来看,原子最外电子层上有7个电子,在化学反应中很容易得到电子以达到稳定结构。
2、从物质的化合价和类别掌握物质的化学性质及转化
知识体系构建
从化合价认识物质的氧化性和还原性
从物质的类别掌握金属单质、金属氧化物、碱和盐的性质
(1)钠及其化合物的“价—类二维图”
涉及的主要反应有(写化学方程或离子方程式)
①Na和H2O反应
②Na在空气中燃烧
③Na2O2和H2O反应
④Na2O2和CO2反应
⑤向NaOH溶液中通入过量CO2
⑥将Na2CO3溶液与石灰乳混合
⑦向Na2CO3稀溶液中通入过量CO2
知识体系构建
⑧将NaHCO3溶液和NaOH溶液等物质的量混合
⑨将NaHCO3溶液与澄清石灰水等物质的量混合:
⑩将NaHCO3溶液与少量澄清石灰水混合
知识体系构建
知识能力运用
典例1、请选择适当的化学试剂和实验用品,用如图所示的装置(C中盛放的是过氧化钠)进行实验,证明过氧化钠可在呼吸面具和潜水艇中做供氧剂。
(1)A是实验室中制取CO2的装置。写出A中发生反应的离子方程式:
___________________________
CaCO3+2H+=Ca2++H O+CO ↑
(2)填写下表中的空白。
(3)写出C中发生反应的化学方程式__________________________
(4)F中得到的是_______如何验证
_________________________________________________________________________________________________________________________________________
装置序号 加入的试剂 加入该试剂的 目的
B 饱和 NaHCO3溶 液
D
把E中的导管移出水面,关闭分液漏斗活塞,用拇指堵住试管口,取出试管,将试管正立,松开拇指,立即把带火星的木条伸入试管内,木条复燃,证明试管中收集的气体是氧气。
氧气
2Na2O2+2H2O=4NaOH+O2↑ 2Na2O2+2CO2=2Na2CO3+O2
除去二氧化碳中混有的氯化氢气体
氢氧化钠溶液
除去生成氧气中混有的未反应的二氧化碳气体
(2)氯及其化合物的“价——类二维图”
知识体系构建
同种元素不同价态之间的转化分“歧化” 和“归中”
同价态之间的转化主要是酸性氧化物、酸和盐之间的化合反应或复分解反应
涉及的主要反应有(写化学方程式或离子方程式)
①Cl2与水反应:
②制漂白液:
③制漂白粉:
④实验室制Cl2:
⑤次氯酸分解:
知识体系构建
典例2、氯水中含有多种成分,因而具有多种性质,根据氯水分别与如图四种物质发生的反应填空(a、b、c、d重合部分代表物质间反应,且氯水足量)。
(1)能证明氯水具有漂白性的是____ (填“a、b 、c或d)。
(2)c过程中的现象是__________________________________,
b过程中反应的离子方程式为________________________。
(3)a过程中反应的化学方程式为______________________。
d
产生白色沉淀
典例3、某同学利用如图所示装置验证Cl元素的非金属性强于S元素,回答下列问题:
(1)仪器a的名称为__________,
装置A中发生反应的化学方程式为__________________________________。
(2)装置C中盛放的试剂可以选用___填序号,当C中观察到_____________
现象时,可说明Cl元素的非金属性强于S元素,该反应的离子方程式为____________________。
a.Na2S溶液 b.Na2SO3溶液 c.Na2SO4溶液
分液漏斗
a
淡黄色沉淀生成
S2-+Cl2=S+2Cl-
发生装置
净化装置
收集装置
模块:
尾气处理
常见气体制备方法的模块化分析
发生装置
核心素养提升
二、宏观物质与微观粒子间的计量关系
1.物质的量
2.物质的量浓度
知识体系构建
典例4、(1)现有m g某气体,它由双原子分子构成,它的摩尔质量为
M g·mol-1。若阿伏加德罗常数值用NA表示,则:
①该气体的物质的量为 mol。
②该气体所含原子总数为 个。
③该气体在标准状况下的体积为 L。
(2)利用“化学计量在实验中的应用”的相关知识进行填空。
①含有6.02×1023个氧原子的H2SO4的物质的量是 mol。
②与标准状况下V L CO2所含氧原子数目相同的水的质量是________ (用分式表示)g。
③在一定的温度和压强下,1体积X2(g)跟3体积Y2(g)化合生成2体积化合
物,则该化合物的化学式是 。
m/M
2mNA/M
22.4m/M
0.25
45v/28
XY3
典例5、某品牌84消毒液,经折算,有效成分NaClO的含量为105 g/L。该消毒液NaClO的物质的量浓度是多少?
以1 L 消毒液为例进行计算
NaClO质量为 105 g
n
m
M
105 g
35.5 g/mol
1.41 mol
c
n
V(aq)
1 L
1.41 mol/L
1.41 mol
NaClO的物质的量为
分析过程:
NaClO的物质的量浓度为
典例6、以配制480 mL 1 mol·L-1 NaOH溶液为例,所需容量瓶的规格:________。
(1)计算(填写计算过程与结果):
m(NaOH)=____________________________________。
(2)称量:根据计算结果,称量固体质量。
(3)溶解:将称量好的固体放入烧杯中,加适量蒸馏水溶解,并用______搅拌;溶解过程中玻璃棒的作用为_______________。
(4)转移(移液):
①移液前需要将溶液冷却至室温。
②移液中玻璃棒的作用为_____。
(5)洗涤:用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,将洗涤液也都注入容量瓶
500 mL
1 mol·L-1×0.5 L×40 g·mol-1=20.0 g
玻璃棒
搅拌,加速溶解
引流
(6)定容:
①将蒸馏水注入容量瓶,在液面离容量瓶颈刻度线下________时,改用胶头滴管滴加蒸馏水。
②定容时要平视刻度线,至凹液面最低处与刻度线_____。
(7)摇匀:盖好瓶塞,上下反复颠倒,摇匀。
1~2 cm
相切
(8)误差分析,下列哪些操作会产生误差?对配制溶液浓度产生怎样的影响?(填“偏大”、“偏小”、“无影响”。)
1.引流时有少许液体溅出容量瓶外
2.定容后摇匀,液面低于刻度线,不施加措施
3.定容时加水高于刻度线,将多余液体吸出
4.用于溶解的小烧杯未洗涤
5.定容时俯视
偏小
无影响
偏小
偏小
偏大
课堂小结
1、有两试管分别装有Na2CO3和NaHCO3溶液,下列操作或判断正确的是( )
方案 操作 判断
A 分别加入澄清石灰水 产生沉淀的为Na2CO3
B 分别加入等浓度的稀盐酸 反应较剧烈的为Na2CO3
C 分别加入CaCl2溶液 产生沉淀的为Na2CO3
D 逐渐加入等浓度的盐酸 立即产生气泡的为Na2CO3
课堂达标
C
2、下列解释实验现象的化学(或离子)方程式正确的是( )
A.切开的金属Na露置于空气中,光亮表面逐渐变暗:2Na+O2=Na2O2
C.Na2O2在潮湿的空气中放置一段时间后,变成白色黏稠物:
2Na2O2+2CO2=2Na2CO3+O2
D.向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀:
2NaHCO3 Na2CO3 + H2O + CO2↑
B.除去碳酸钠固体中的少量碳酸氢钠杂质:
B
3.焰火晚会中的焰火与高中化学中“焰色试验”知识有关。下列有关“焰色试验”说法中正确的是( )
A.非金属单质燃烧时火焰均为无色
B.NaCl与Na2CO3灼烧时火焰颜色相同
C.焰色试验均应透过蓝色钴玻璃观察
D.所有金属及其化合物灼烧时火焰均有颜色
B
4.下列关于氯及其化合物的说法正确的是( )
A.漂白粉在空气中久置变质是因为漂白粉中的CaCl2与空气中的CO2反应生成CaCO3
B.ClO2具有强氧化性,可用于自来水的杀菌消毒
C.将Cl2与HCl混合气体通过饱和食盐水可得到纯净的Cl2
D.因漂白粉在空气中不稳定,故可用于漂白纸张
B
5.在体积相同的两个密闭容器中分别充满O2、O3气体,当这两个容器内温度和气体密度相等时,下列说法正确的是( )
A.两种气体的压强相等
B.O2比O3的质量小
C.两种气体的分子数目相等
D.两种气体的氧原子数目相等
D
6、如图是实验室配制好的两瓶NaOH溶液的标签(14%的NaOH溶液的密度为1.14 g·cm-3)。
14%的NaOH溶液的物质的量浓度及从瓶中取出20 mL该溶液中含有溶质的质量分别是( )
A.4.0 mol·L-1 3.2 g B.2.0 mol·L-1 3.2 g
C.4.0 mol·L-1 6.4 g D.2.0 mol·L-1 6.4 g
A
试回答下列问题:
(1)W、X、Y、Z的化学式分别是
W 、X 、
Y 、Z 。
(2)以上4个化学反应,属于氧化还原反应的是 (填反应序号),反应中氧化剂是 (写化学式), 还原剂是 (写化学式)。
(3)若④在溶液中进行,写出其离子方程式以及能用该离子方程式表示的另一个化学反应的化学方程式:
离子方程式:
7、有4种钠的化合物W、X、Y、Z,它们之间存在如下关系:
NaHCO3
Na2CO3
NaOH
Na2O2
Na2O2
Na2O2
②③
Ca(OH)2+K2CO3=2KOH+CaCO3↓
Ca2++C O32- =CaCO3↓
8、如图所涉及的物质均为中学化学中的常见物质,其中C为气态单质,D为黄绿色气体,E为固态单质,它们存在如下转化关系,反应中生成的水及次要产物均已略去。
(1)写出有关物质的化学式:
F__________,H__________
(2)指出MnO2在相关反应中的作用:
反应①中是_______剂,
反应②中是_______剂。
(3)若反应①是在加热条件下进行的,则A是__________ (填化学式,下同),
若反应①是在常温条件下进行的,则A是_______________。
(4)写出B与MnO2共热获得D的化学方程式:__________________________
Fe3O4
FeCl3
催化
氧化
KClO3
H2O2
9、洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病暴发的有效方法之一。漂白粉是常用的消毒剂。
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学方程式为 。
(2)漂白粉的有效成分是 (填化学式)。
(3)漂白粉溶于水后,受空气中CO2的作用,即产生有漂白、杀菌作用的次氯酸,发生化学反应的离子方程式为 。
(4)反应(1)和反应(3)中,属于氧化还原反应的是反应 (填编号)。
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
Ca(ClO)2
Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO
(1)
(5)瓶装漂白粉久置于空气中呈稀粥状而失效。试用化学方程式表示漂白
粉在空气中易失效的原因: 。
(6)已知浓盐酸和次氯酸钙能发生反应
Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O。用贮存很久的漂白粉与浓
盐酸制得的氯气中,可能含有的杂质气体是 (填字母)。
①CO2 ②HCl ③H2O ④H2
A.①②③ B.②③④ C.只有②③ D.只有①④
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,2HClO=2HCl+O2↑
A
10、某医用环境,次氯酸钠浓度需840 mg/L,每1体积该消毒液需要加多少体积水稀释,才能符合医用消毒液浓度要求
c(浓溶液)·V(浓溶液)
c(稀溶液)·V(稀溶液)
以1 L 消毒液为例进行计算
105 g/L·1 L
0.84 g/L·V(稀溶液)
840 mg/L 相当于 0.84 g/L
V(稀溶液)
125 L
每1体积消毒液加124体积水
