人教版高中化学必修第一册第一章物质及其变化1.4整理与提升课件(36页ppt)
文档属性
| 名称 | 人教版高中化学必修第一册第一章物质及其变化1.4整理与提升课件(36页ppt) |  | |
| 格式 | ppt | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-12 09:38:09 | ||
图片预览







文档简介
(共36张PPT)
第一章
物质及其变化
章末知识整理与素养检测
学业要求
1. 能依据物质类别列举Ca、C等元素的典型代表物。
2. 能举例说明胶体的典型特征。
3. 能用电离方程式表示某些酸、碱、盐的电离。
4. 能利用离子反应、氧化还原反应等概念对常见的反应进行分类和分析说明。
5. 能运用实验基本操作实施实验方案,具有安全意识和环保意识。
6. 能观察并如实记录实验现象和数据,进行分析和推理,得出合理的结论。
7. 能从物质类别和元素价态变化的视角说明物质的转化路径。
8. 能举例说明与化学有关的职业,简单分析这些职业与化学的关系。
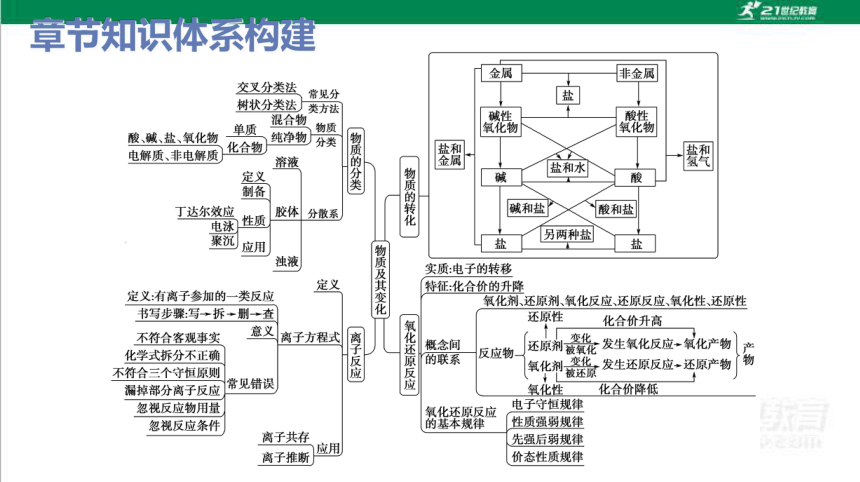
章节知识体系构建
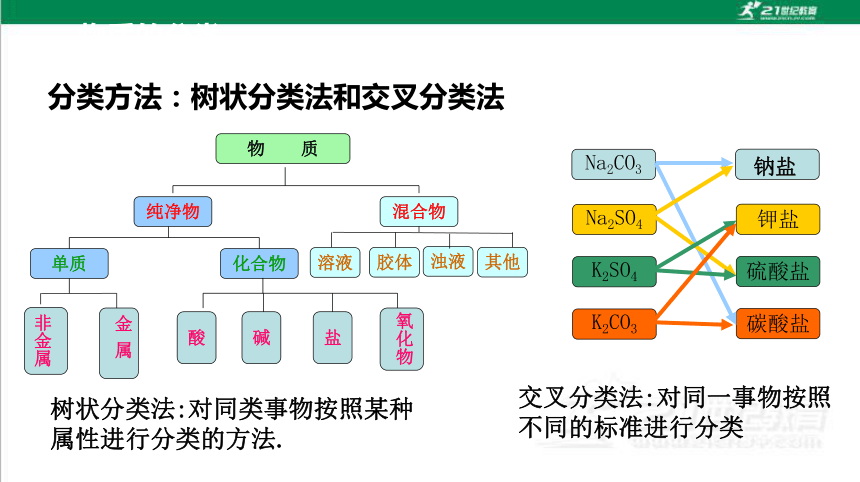
Na2SO4
K2SO4
K2CO3
碳酸盐
硫酸盐
钾盐
Na2CO3
钠盐
树状分类法:对同类事物按照某种属性进行分类的方法.
其他
物 质
纯净物
混合物
溶液
化合物
单质
盐
碱
酸
非金属
金 属
氧化物
胶体
浊液
交叉分类法:对同一事物按照不同的标准进行分类
分类方法:树状分类法和交叉分类法
物质的分类
1.单质、同素异形体
(1)单质:由同种元素组成的纯净物;
(2)同素异形体:由同种元素形成的几种性质不同的单质;
如金刚石、石墨、C60都是碳元素形成的单质,它们是碳元素的同素异形体;
如氧气O2、臭氧O3是氧元素的同素异形体。
2.化合物:由不同的元素形成的纯净物就是化合物。
如CO2、H2O、NaCl等。
物质的分类
金属氧化物:
非金属氧化物:
氧化物
CuO MgO CaO
CO2 SO2
碱性氧化物:
定义:元素与氧化合生成的化合物。有且只有两种元素组成
能跟酸起反应只生成盐和水的氧化物
能跟碱起反应只生成盐和水的氧化物
酸性氧化物:
两性氧化物:
不成盐氧化物:
同时能跟碱和酸起反应只生成盐和水
既不跟酸反应也不跟碱反应的氧化物
H2O、NO、CO、N2O、NO2、MnO2
Al2O3 : Al2O3+2NaOH=2NaAlO2+H2O
SO3、P2O5、Mn2O7、CrO3
Na2O、CaO、Fe2O3、CrO、MnO
氧化物的分类
正盐:
酸式盐:
碱式盐:
组成中是否有可电离的H+、OH-
复盐:
既不含能电离的氢离子,又不含氢氧根离子的盐.Na2CO3、KCl、Ba(NO3)2
电离时生成的阳离子除金属离子(或NH4+)外还有氢离子,阴离子为酸根离子的盐。NaHCO3、Ca(HCO3)2
电离时生成的阴离子除酸根离子外还有氢氧根离子,阳离子为金属离子(或NH4+)的盐.
Cu2(OH)2CO3
是由两种或两种以上的简单盐类组成的同晶型化合物. KAl(SO4)2·12H2O (明矾)
定义:阳离子由金属离子或NH4+、阴离子由酸根离子组成的化合物
盐的分类
化
学
反
应
根据反应物和生成物的类别
以及反应前后物质种类的多少
化合反应
分解反应
置换反应
复分解反应
根据
反应
中是
否有
电子
转移
氧化
还原
反应
非氧化还原反应
实质:
有电子转移(得失或偏移)
特征:
反应前后元素的化合价有变化
概念
及其
相互
关系
反
应
物
氧化剂
还原剂
有氧化性
得电子
化合价降低
有还原性
失电子
化合价升高
根据反应中是
否有离子参加
离子
反应
分子
反应
定义:
有离子参加的一类反应
离子
方程式
定义:
用实际参加反应的离子符号
来表示离子反应的式子
意义:
不仅表示一定物质间的某个反应,
而且表示所有同一类型的离子反应
发生还原反应
发生氧化反应
化学反应的分类
解析
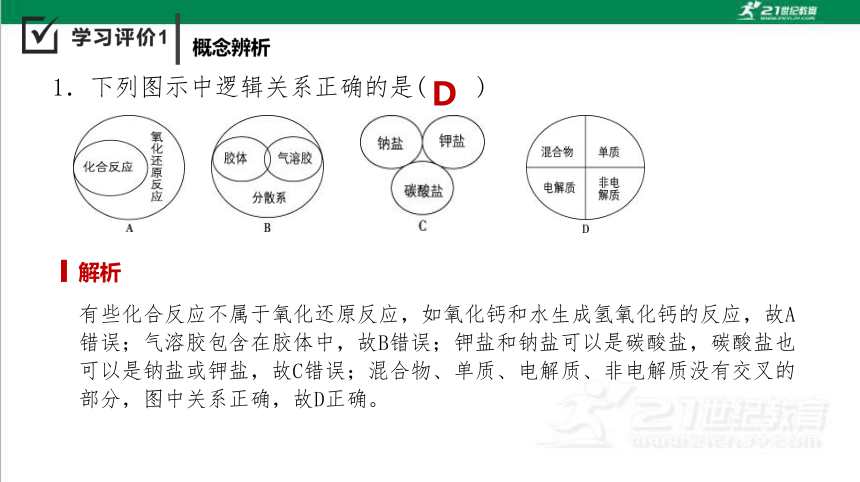
D
1.下列图示中逻辑关系正确的是( )
有些化合反应不属于氧化还原反应,如氧化钙和水生成氢氧化钙的反应,故A错误;气溶胶包含在胶体中,故B错误;钾盐和钠盐可以是碳酸盐,碳酸盐也可以是钠盐或钾盐,故C错误;混合物、单质、电解质、非电解质没有交叉的部分,图中关系正确,故D正确。
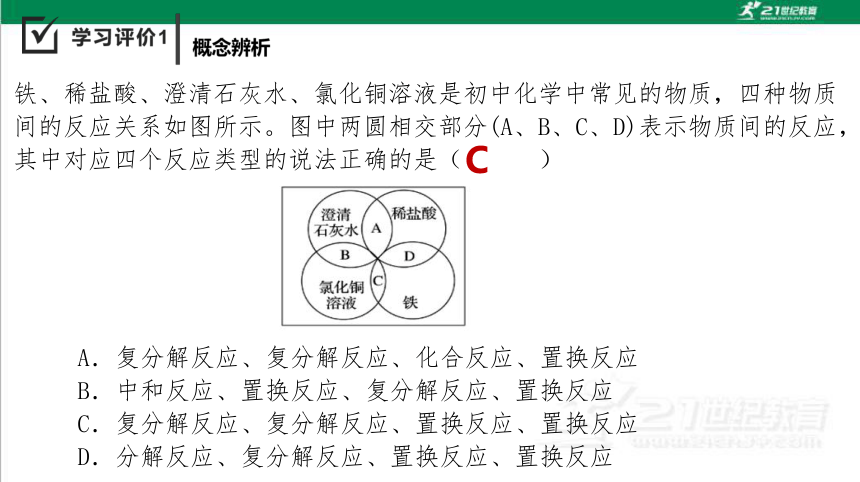
铁、稀盐酸、澄清石灰水、氯化铜溶液是初中化学中常见的物质,四种物质间的反应关系如图所示。图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应四个反应类型的说法正确的是( )
A.复分解反应、复分解反应、化合反应、置换反应
B.中和反应、置换反应、复分解反应、置换反应
C.复分解反应、复分解反应、置换反应、置换反应
D.分解反应、复分解反应、置换反应、置换反应
C
C
2.下列分类或归类正确的是( )①液氯、氨水、干冰、碘化银均为纯净物②CaCl2、NaOH、HCl、IBr均为化合物③明矾、水银、烧碱、硫酸均为电解质④火碱、纯碱、碳酸钙都是电解质⑤碘酒、淀粉、云雾、纳米材料均为胶体A.①③④ B.②③ C.②④ D.②③④⑤
①氨水是氨气的水溶液,属于混合物,错误;②CaCl2、NaOH、HCl、IBr均是由不同种元素组成的纯净物,属于化合物,正确;③水银是单质,既不是电解质也不是非电解质,错误;④碳酸钙是电解质,火碱是氢氧化钠,纯碱是碳酸钠,二者也都是电解质,正确;⑤碘酒是碘单质的酒精溶液,淀粉、纳米材料不是分散系,云雾是胶体,错误。综上所述,C正确。
解析
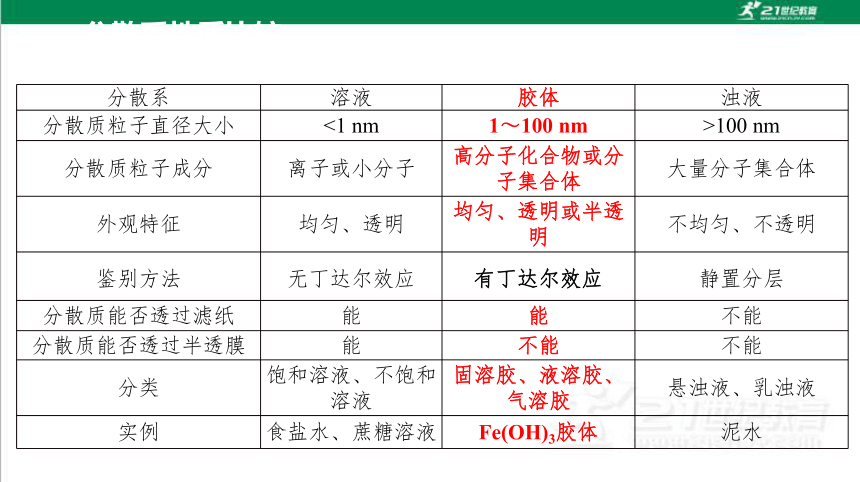
分散系 溶液 胶体 浊液
分散质粒子直径大小 <1 nm 1~100 nm >100 nm
分散质粒子成分 离子或小分子 高分子化合物或分子集合体 大量分子集合体
外观特征 均匀、透明 均匀、透明或半透明 不均匀、不透明
鉴别方法 无丁达尔效应 有丁达尔效应 静置分层
分散质能否透过滤纸 能 能 不能
分散质能否透过半透膜 能 不能 不能
分类 饱和溶液、不饱和溶液 固溶胶、液溶胶、气溶胶 悬浊液、乳浊液
实例 食盐水、蔗糖溶液 Fe(OH)3胶体 泥水
分散系性质比较
某课外活动小组进行氢氧化铁胶体的制备实验并检验其性质。
(1)将饱和氯化铁溶液分别滴入沸腾的下列物质中,能形成胶体的是_____ (填字母)。A.自来水 B.蒸馏水 C.氢氧化钠溶液 D.氯化钠溶液
(2)现有甲、乙、丙三名同学进行氢氧化铁胶体的制备,其中正确的是________(填序号)。
①甲同学的操作:取一小烧杯,加入25mL蒸馏水加热至沸腾,向沸水中逐滴加入1~2mL氯化铁饱和溶液,继续煮沸至混合液呈红褐色,停止加热
②乙直接加热饱和氯化铁溶液
③丙向沸水中滴加饱和氯化铁溶液,为了使反应进行充分,煮沸10分钟
(3)制备氢氧化铁胶体的化学方程式是_______________________________证明有氢氧化铁胶体生成的实验操作是_____________________________
________________________________________________
B
①
FeCl3 + 3H2O Fe(OH)3(胶体)+3HCl
△
让一束可见光通过制得的分散系,
从侧面观察到一条光亮的“通路”说明制得的是胶体
胶体的应用
(1)静电除尘
(2)土壤的保肥
(3)石膏或卤水点豆腐、制造果冻和皮冻
(4)明矾净水原理
(5)江河入海处形成沙洲
(6)使用蓝色墨水的钢笔抽黑色墨水容易堵塞
(7)喝豆浆放糖不放盐
……
常见胶体及其应用
1.下列分散系最稳定的是 ( )
A.悬浊液 B.乳浊液 C.胶体 D.溶液
2.下列关于胶体和溶液的说法不正确的是( )
A.胶体和溶液都是分散系,静置不易产生沉淀
B.蔗糖、淀粉、蛋白质的水溶液均能产生丁达尔效应
C.光线通过时,胶体产生丁达尔效应,溶液则无丁达尔效应
D.向Fe(OH)3胶体中逐滴加入稀硫酸先产生沉淀而后沉淀逐渐溶解
D
B
3.下列应用或事实与胶体的性质没有关系的是 ( )
A.用明矾净化饮用水
B.用石膏或盐卤点制豆腐
C.在FeCl3溶液中滴加NaOH溶液出现红褐色沉淀
D.清晨阳光穿过茂密的林木枝叶所产生的美丽景象(美丽的光线)
C
单质、氧化物、酸(或碱)和盐的转化关系
物质的转化
①金属单质及其化合物的转化:如:
Na Na2O NaOH Na2SO4
Ca
请写出Ca的相关反应方程式并注明反应类型:
O2
H2O
H2SO4
O2
H2O
H2SO4
2Ca+O2===2CaO; 化合反应
CaO+H2O===Ca(OH)2; 化合反应
Ca(OH)2+Na2CO3===CaCO3↓+2NaOH; 复分解反应
总结:
金属单质
O2
碱性氧化物
H2O
碱
酸或酸性氧化物
盐
CaO
Ca(OH)2
CaSO4
单质及其化合物的转化
②非金属单质及其化合物的转化:如:
C CO2 H2CO3 Na2CO3
S
O2
H2O
NaOH
O2
SO2
H2O
H2SO3
NaOH
Na2SO3
请写出C的相关反应方程式并注明反应类型:
C+O2===CO2; 化合反应
CO2+H2O===H2CO3; 化合反应
H2CO3+Ca(OH)2===CaCO3↓+2H2O; 复分解反应
总结:非金属单质
O2
酸性氧化物
H2O
酸
碱或碱性氧化物
盐
单质及其化合物的转化
单质、氧化物、酸、碱和盐的相互关系,可以用图简单表示。限选择铁、碳、氧气、盐酸、氧化钙、二氧化碳、水、氢氧化钙8种物质作为反应物,将图中指定序号的转变用化学方程式表示(所写化学方程式不得重复)。
①_______________________________ ;
②___________________________________;
③___________________________________;
④___________________________________;
⑤___________________________________;
⑥___________________________________;
⑦___________________________________。
CO2+H2O=H2CO3 CO2+Ca(OH)2=CaCO3↓+H2O Fe+2HCl=FeCl2+H2↑ CaO+2HCl=CaCl2+H2O Ca(OH)2+2HCl=CaCl2+2H2O CaO+H2O=Ca(OH)2
写、拆、删、查
在水溶液或熔融状态系能够导电的化合物
电离方程式
电解质
离子方程式
六强酸、四强碱。可溶盐
生成沉淀/水/放出气体
三者缺一不可
弱酸、弱碱、难溶盐、
单质、氧化物
性质
在水溶液或熔融状态电离
性质
常见物质
反应类型
概念
酸、碱、盐和活泼金属氧化物
离子反应
表示
性质
写法
质量守恒和离子守恒
拆
复分解型的离子反应
发生条件
不拆
离子反应
(1)电解质、非电解质都是化合物。
单质、混合物既不是电解质也不是非电解质。
比如盐酸,它能导电,但它是氯化氢气体的水溶液,
是混合物,所以不属于电解质。HCl是电解质。
(2)电解质导电须有外界条件:水溶液或熔融状态。
只要满足在其中一种情况下能够导电的化合物就是电解质。
(3)电解质应是在一定条件下本身电离出自由移动离子而导电的化合物。
比如像SO3、SO2、CO2、NH3,它们的水溶液虽能导电,却是生成物电离而导电,并非它们本身电离导电,所以它们是非电解质。
(4)某些难溶于水的化合物。如BaSO4、AgCl等,由于它们溶解度太小,难测其水溶液的导电性,它们溶解的部分是完全电离的,另外,它们在熔融状态能够导电,所以是电解质。
(5)共价化合物水溶液中,在水分子作用下,共价化合物可电离并且导电。
而共价化合物在熔融状态下不能导电;离子化合物在两种状态下都可以导电,这点可以用来区别共价化合物和离子化合物。
电解质与非电解质的异同
有自由移动的电子或离子
现有以下物质:①NaCl晶体; ②液态CO2;③醋酸;④汞;⑤Na2SO4固体;⑥蔗糖;⑦酒精;⑧熔化的KNO3 请回答下列问题(用序号):
④
⑧
酸、碱、盐、氧化物、水
①
③
⑤
⑧
(1)以上物质能导电的是________
(2)以上物质属于电解质的是__________
运用知识能力
1.电离:电解质在水溶液中或熔融状态下,离解成自由移动离子的过程。
2.电离方程式
(1)强电解质:完全电离,用“=”连接。
(2)弱电解质:部分电离,用“ ”连接。
①多元弱酸(如H2CO3、H2SO3、H2S等均为二元弱酸)分步电离,且电离程度逐步减弱,酸性由第一步电离决定,
如H2CO3电离方程式:H2CO3 H++HCO3- 、HCO3- H++CO32-
②多元弱碱[如Cu(OH)2、Mg(OH)2、Fe(OH)3等]分步电离,但一步写出,
如Fe(OH)3电离方程式:Fe(OH)3 Fe3++3OH-
③酸式盐的电离:多元强酸酸式盐与多元弱酸酸式盐的阴离子电离方式不同,
如NaHSO4溶于水中: NaHSO4===Na++H++SO42-
在熔融状态下: NaHSO4===Na++HSO4-
NaHCO3溶于水中: NaHCO3===Na++HCO3-,HCO3- H++CO32-
电解质的电离
写出下列物质的电离方程式。
(1)CH3COOH:______________________
(2)Ba(OH)2:______________________
(3)NH3·H2O:______________________
(4)BaSO4:______________________
(5)KAl(SO4)2:______________________
可分成“写、拆、删、查”四步
①写:写出反应的化学方程式。
②拆:把易溶于水,易电离的物质写成离子形式。
③删:把不参加反应的离子从方程式两边删去。
④查:检查方程式两边是否符合原子守恒和电荷守恒。
【例题】请写出硝酸银和氯化钾反应的离子方程式
写:AgNO3 + KCl == AgCl↓ + KNO3
改:Ag++NO3-+K++Cl-= AgCl↓+K++NO3-
删:Ag++NO3-+K++Cl-= AgCl↓+K++NO3-
查: Ag+ + Cl- == AgCl↓
离子方程式的书写
化学方程式只表示某一具体的反应,而离子方程式不仅可以表示某一个具体的反应,而且还可以表示同一类型的离子反应。
例如,完成下列反应的离子方程式。
① HCl+NaOH
② HCl+KOH
③ NaOH + H2SO4
④ H2SO4+KOH
离子方程式都是
H++OH-==H2O
【思考】是否所有的酸碱中和反应的离子方程式都可表示为:
H++OH-==H2O
不是,强酸、强碱中和生成可溶性盐的反应通常可用H++OH-==H2O表示。
离子方程式的意义
下列反应的离子方程式书写正确的是( )
A.H2SO4溶液与氨水反应:H++OH-=H2O
B.CuO与稀盐酸反应:CuO+2H+=Cu2++H2O
C.AlCl3溶液与氢氧化钠溶液反应:
AlCl3+3OH-=Al(OH)3↓+3Cl-
D.大理石与盐酸反应:CO32-+H+=CO2↑+H2O
C
1.无限定条件下的离子共存
(1)离子间发生复分解反应
①生成难电离物质(水、弱酸、一水合氨等)的离子不能大量共存。
如:H+与CH3COO-、CO32-、HCO3-、S2-等生成弱酸不能大量共存;OH-与NH4+(稀溶液)生成弱碱不能大量共存;H+与OH-生成水不能大量共存。
②生成难溶物或微溶物的离子不能大量共存。
如:Ba2+、Ca2+ 与 CO32-、SO42- 、SO32- 生成难(微)溶物不能大量共存。
③生成气体及挥发性物质的离子不能大量共存。
如:H+ 与 CO32-、HCO3-、SO32-、HSO3-生成气体不能大量共存。
离子共存
(2)氧化还原反应类型
离子之间发生氧化还原反应而不能大量共存。
离子共存
2.有限定条件(隐含条件)下的离子共存
(1)无色溶液:有色离子不能大量存在。
Cu2+(蓝色)、Fe2+(浅绿色)、Fe3+(棕黄色)、MnO4-(紫红色)、Cr2O42-(橙红色)等
(2)溶液显酸性:
无大量的OH-及弱酸的酸根离子或酸式酸根离子。
(3)溶液显碱性:
无大量的H+及弱碱的阳离子、弱酸的酸式酸根离子。
(4)“一定”“可能”还是“不能”大量共存:
确定是“可能”还是“肯定”
水溶液中能大量共存的一组离子是( )
A.NH4+、Ba2+、Br-、CO32-
B.Cl-、SO32-、Fe2+、H+
C.K+、Na+、SO42-、MnO4-
D.Na+、H+、NO3-、HCO3-
C
A
室温下,下列各组离子在指定溶液中能大量共存的是( )A.0.1 mol·L-1 NaOH溶液:Na+、K+、CO32-、AlO2-B.0.1 mol·L-1 FeCl2溶液:K+、Mg2+、SO42-、MnO4-C.0.1 mol·L-1 K2CO3溶液:Na+、Ba2+、Cl-、OH-D.0.1 mol·L-1 H2SO4溶液:K+、NH4+、NO3-、HSO3-
Na+、K+、CO32-、AlO2-之间都不反应,且都不与OH-反应,可以大量共存,A正确;FeCl2溶液由于Fe2+的水解而呈酸性,酸性条件下,Fe2+可被MnO4-氧化为Fe3+,Cl-也能被MnO4-氧化,不能大量共存,B错误;Ba2+与CO32-反应生成BaCO3沉淀而不能大量共存,C错误;HSO3-能与H+反应而不能大量存在,且酸性条件下,NO3-有强氧化性,能够氧化HSO3-,D错误。
解析
得电子、化合价降低、被还原、发生还原反应
失电子、化合价升高、被氧化、发生氧化反应
本质
标志
结果
反应类型
微观视角
宏观视角
口诀:升失氧化还原剂 降得还原氧化剂
双线桥法
单线桥法
还原剂 + 氧化剂 = 氧化产物+还原产物
氧化还原反应反应
四大规律
配平原则
氧化还原反应应用
先后规律
强弱规律
价态规律
守恒规律
得失升降
前强后弱
强完弱继
就近变价
三守恒
四种比较强弱的方法
根据方程式比较
根据金属(非金属)活动比较
根据反应进行的程度比较
根据反应难易比较
氧化还原反应反应
A.有氧元素参加的反应一定是氧化还原反应 ( )
B.分解反应一定是氧化还原反应 ( )
C.有单质生成的反应一定是氧化还原反应 ( )
D.在反应中不一定所有元素的化合价都发生了变化 ( )
E.肯定有一种元素被氧化,就有另一种元素被还原 ( )
F.某元素从化合态变成游离态时,该元素一定被还原 ( )
G.非金属单质在反应中只作氧化剂 ( )
H.金属阳离子被还原不一定得到金属单质 ( )
【答案】× × × √ × × × √
下列化学反应中溴元素仅被氧化的是( )A.2NaBr+Cl2== 2NaCl+Br2B.Br2+2NaI== 2NaBr+I2C.3Br2+6NaOH 5NaBr+NaBrO3+3H2OD.HBr+NaOH==NaBr+H2O
A
2NaBr+Cl2==2NaCl+Br2中Br元素化合价升高,被氧化,A正确;Br2+2NaI==2NaBr+I2中Br元素化合价降低,被还原,B错误;3Br2+6NaOH 5NaBr+NaBrO3+3H2O中Br元素化合价既有升高又有降低,溴元素既被氧化又被还原,C错误;HBr+NaOH==NaBr+H2O中Br元素化合价不变,D错误。
解析
为消除碘缺乏病在食盐中可加入适量的碘酸钾,检验食盐中是否加碘,可利用如下反应:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
(1)用双线桥法表示该方程式电子转移的方向与数目。
KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
(2)该反应中氧化剂和还原剂的物质的量之比为________。
(3)如果反应中转移1 mol电子,则生成碘的物质的量为________。
5∶1
5 ×
5 ×
0.6 mol
第一章
物质及其变化
章末知识整理与素养检测
学业要求
1. 能依据物质类别列举Ca、C等元素的典型代表物。
2. 能举例说明胶体的典型特征。
3. 能用电离方程式表示某些酸、碱、盐的电离。
4. 能利用离子反应、氧化还原反应等概念对常见的反应进行分类和分析说明。
5. 能运用实验基本操作实施实验方案,具有安全意识和环保意识。
6. 能观察并如实记录实验现象和数据,进行分析和推理,得出合理的结论。
7. 能从物质类别和元素价态变化的视角说明物质的转化路径。
8. 能举例说明与化学有关的职业,简单分析这些职业与化学的关系。
章节知识体系构建
Na2SO4
K2SO4
K2CO3
碳酸盐
硫酸盐
钾盐
Na2CO3
钠盐
树状分类法:对同类事物按照某种属性进行分类的方法.
其他
物 质
纯净物
混合物
溶液
化合物
单质
盐
碱
酸
非金属
金 属
氧化物
胶体
浊液
交叉分类法:对同一事物按照不同的标准进行分类
分类方法:树状分类法和交叉分类法
物质的分类
1.单质、同素异形体
(1)单质:由同种元素组成的纯净物;
(2)同素异形体:由同种元素形成的几种性质不同的单质;
如金刚石、石墨、C60都是碳元素形成的单质,它们是碳元素的同素异形体;
如氧气O2、臭氧O3是氧元素的同素异形体。
2.化合物:由不同的元素形成的纯净物就是化合物。
如CO2、H2O、NaCl等。
物质的分类
金属氧化物:
非金属氧化物:
氧化物
CuO MgO CaO
CO2 SO2
碱性氧化物:
定义:元素与氧化合生成的化合物。有且只有两种元素组成
能跟酸起反应只生成盐和水的氧化物
能跟碱起反应只生成盐和水的氧化物
酸性氧化物:
两性氧化物:
不成盐氧化物:
同时能跟碱和酸起反应只生成盐和水
既不跟酸反应也不跟碱反应的氧化物
H2O、NO、CO、N2O、NO2、MnO2
Al2O3 : Al2O3+2NaOH=2NaAlO2+H2O
SO3、P2O5、Mn2O7、CrO3
Na2O、CaO、Fe2O3、CrO、MnO
氧化物的分类
正盐:
酸式盐:
碱式盐:
组成中是否有可电离的H+、OH-
复盐:
既不含能电离的氢离子,又不含氢氧根离子的盐.Na2CO3、KCl、Ba(NO3)2
电离时生成的阳离子除金属离子(或NH4+)外还有氢离子,阴离子为酸根离子的盐。NaHCO3、Ca(HCO3)2
电离时生成的阴离子除酸根离子外还有氢氧根离子,阳离子为金属离子(或NH4+)的盐.
Cu2(OH)2CO3
是由两种或两种以上的简单盐类组成的同晶型化合物. KAl(SO4)2·12H2O (明矾)
定义:阳离子由金属离子或NH4+、阴离子由酸根离子组成的化合物
盐的分类
化
学
反
应
根据反应物和生成物的类别
以及反应前后物质种类的多少
化合反应
分解反应
置换反应
复分解反应
根据
反应
中是
否有
电子
转移
氧化
还原
反应
非氧化还原反应
实质:
有电子转移(得失或偏移)
特征:
反应前后元素的化合价有变化
概念
及其
相互
关系
反
应
物
氧化剂
还原剂
有氧化性
得电子
化合价降低
有还原性
失电子
化合价升高
根据反应中是
否有离子参加
离子
反应
分子
反应
定义:
有离子参加的一类反应
离子
方程式
定义:
用实际参加反应的离子符号
来表示离子反应的式子
意义:
不仅表示一定物质间的某个反应,
而且表示所有同一类型的离子反应
发生还原反应
发生氧化反应
化学反应的分类
解析
D
1.下列图示中逻辑关系正确的是( )
有些化合反应不属于氧化还原反应,如氧化钙和水生成氢氧化钙的反应,故A错误;气溶胶包含在胶体中,故B错误;钾盐和钠盐可以是碳酸盐,碳酸盐也可以是钠盐或钾盐,故C错误;混合物、单质、电解质、非电解质没有交叉的部分,图中关系正确,故D正确。
铁、稀盐酸、澄清石灰水、氯化铜溶液是初中化学中常见的物质,四种物质间的反应关系如图所示。图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应四个反应类型的说法正确的是( )
A.复分解反应、复分解反应、化合反应、置换反应
B.中和反应、置换反应、复分解反应、置换反应
C.复分解反应、复分解反应、置换反应、置换反应
D.分解反应、复分解反应、置换反应、置换反应
C
C
2.下列分类或归类正确的是( )①液氯、氨水、干冰、碘化银均为纯净物②CaCl2、NaOH、HCl、IBr均为化合物③明矾、水银、烧碱、硫酸均为电解质④火碱、纯碱、碳酸钙都是电解质⑤碘酒、淀粉、云雾、纳米材料均为胶体A.①③④ B.②③ C.②④ D.②③④⑤
①氨水是氨气的水溶液,属于混合物,错误;②CaCl2、NaOH、HCl、IBr均是由不同种元素组成的纯净物,属于化合物,正确;③水银是单质,既不是电解质也不是非电解质,错误;④碳酸钙是电解质,火碱是氢氧化钠,纯碱是碳酸钠,二者也都是电解质,正确;⑤碘酒是碘单质的酒精溶液,淀粉、纳米材料不是分散系,云雾是胶体,错误。综上所述,C正确。
解析
分散系 溶液 胶体 浊液
分散质粒子直径大小 <1 nm 1~100 nm >100 nm
分散质粒子成分 离子或小分子 高分子化合物或分子集合体 大量分子集合体
外观特征 均匀、透明 均匀、透明或半透明 不均匀、不透明
鉴别方法 无丁达尔效应 有丁达尔效应 静置分层
分散质能否透过滤纸 能 能 不能
分散质能否透过半透膜 能 不能 不能
分类 饱和溶液、不饱和溶液 固溶胶、液溶胶、气溶胶 悬浊液、乳浊液
实例 食盐水、蔗糖溶液 Fe(OH)3胶体 泥水
分散系性质比较
某课外活动小组进行氢氧化铁胶体的制备实验并检验其性质。
(1)将饱和氯化铁溶液分别滴入沸腾的下列物质中,能形成胶体的是_____ (填字母)。A.自来水 B.蒸馏水 C.氢氧化钠溶液 D.氯化钠溶液
(2)现有甲、乙、丙三名同学进行氢氧化铁胶体的制备,其中正确的是________(填序号)。
①甲同学的操作:取一小烧杯,加入25mL蒸馏水加热至沸腾,向沸水中逐滴加入1~2mL氯化铁饱和溶液,继续煮沸至混合液呈红褐色,停止加热
②乙直接加热饱和氯化铁溶液
③丙向沸水中滴加饱和氯化铁溶液,为了使反应进行充分,煮沸10分钟
(3)制备氢氧化铁胶体的化学方程式是_______________________________证明有氢氧化铁胶体生成的实验操作是_____________________________
________________________________________________
B
①
FeCl3 + 3H2O Fe(OH)3(胶体)+3HCl
△
让一束可见光通过制得的分散系,
从侧面观察到一条光亮的“通路”说明制得的是胶体
胶体的应用
(1)静电除尘
(2)土壤的保肥
(3)石膏或卤水点豆腐、制造果冻和皮冻
(4)明矾净水原理
(5)江河入海处形成沙洲
(6)使用蓝色墨水的钢笔抽黑色墨水容易堵塞
(7)喝豆浆放糖不放盐
……
常见胶体及其应用
1.下列分散系最稳定的是 ( )
A.悬浊液 B.乳浊液 C.胶体 D.溶液
2.下列关于胶体和溶液的说法不正确的是( )
A.胶体和溶液都是分散系,静置不易产生沉淀
B.蔗糖、淀粉、蛋白质的水溶液均能产生丁达尔效应
C.光线通过时,胶体产生丁达尔效应,溶液则无丁达尔效应
D.向Fe(OH)3胶体中逐滴加入稀硫酸先产生沉淀而后沉淀逐渐溶解
D
B
3.下列应用或事实与胶体的性质没有关系的是 ( )
A.用明矾净化饮用水
B.用石膏或盐卤点制豆腐
C.在FeCl3溶液中滴加NaOH溶液出现红褐色沉淀
D.清晨阳光穿过茂密的林木枝叶所产生的美丽景象(美丽的光线)
C
单质、氧化物、酸(或碱)和盐的转化关系
物质的转化
①金属单质及其化合物的转化:如:
Na Na2O NaOH Na2SO4
Ca
请写出Ca的相关反应方程式并注明反应类型:
O2
H2O
H2SO4
O2
H2O
H2SO4
2Ca+O2===2CaO; 化合反应
CaO+H2O===Ca(OH)2; 化合反应
Ca(OH)2+Na2CO3===CaCO3↓+2NaOH; 复分解反应
总结:
金属单质
O2
碱性氧化物
H2O
碱
酸或酸性氧化物
盐
CaO
Ca(OH)2
CaSO4
单质及其化合物的转化
②非金属单质及其化合物的转化:如:
C CO2 H2CO3 Na2CO3
S
O2
H2O
NaOH
O2
SO2
H2O
H2SO3
NaOH
Na2SO3
请写出C的相关反应方程式并注明反应类型:
C+O2===CO2; 化合反应
CO2+H2O===H2CO3; 化合反应
H2CO3+Ca(OH)2===CaCO3↓+2H2O; 复分解反应
总结:非金属单质
O2
酸性氧化物
H2O
酸
碱或碱性氧化物
盐
单质及其化合物的转化
单质、氧化物、酸、碱和盐的相互关系,可以用图简单表示。限选择铁、碳、氧气、盐酸、氧化钙、二氧化碳、水、氢氧化钙8种物质作为反应物,将图中指定序号的转变用化学方程式表示(所写化学方程式不得重复)。
①_______________________________ ;
②___________________________________;
③___________________________________;
④___________________________________;
⑤___________________________________;
⑥___________________________________;
⑦___________________________________。
CO2+H2O=H2CO3 CO2+Ca(OH)2=CaCO3↓+H2O Fe+2HCl=FeCl2+H2↑ CaO+2HCl=CaCl2+H2O Ca(OH)2+2HCl=CaCl2+2H2O CaO+H2O=Ca(OH)2
写、拆、删、查
在水溶液或熔融状态系能够导电的化合物
电离方程式
电解质
离子方程式
六强酸、四强碱。可溶盐
生成沉淀/水/放出气体
三者缺一不可
弱酸、弱碱、难溶盐、
单质、氧化物
性质
在水溶液或熔融状态电离
性质
常见物质
反应类型
概念
酸、碱、盐和活泼金属氧化物
离子反应
表示
性质
写法
质量守恒和离子守恒
拆
复分解型的离子反应
发生条件
不拆
离子反应
(1)电解质、非电解质都是化合物。
单质、混合物既不是电解质也不是非电解质。
比如盐酸,它能导电,但它是氯化氢气体的水溶液,
是混合物,所以不属于电解质。HCl是电解质。
(2)电解质导电须有外界条件:水溶液或熔融状态。
只要满足在其中一种情况下能够导电的化合物就是电解质。
(3)电解质应是在一定条件下本身电离出自由移动离子而导电的化合物。
比如像SO3、SO2、CO2、NH3,它们的水溶液虽能导电,却是生成物电离而导电,并非它们本身电离导电,所以它们是非电解质。
(4)某些难溶于水的化合物。如BaSO4、AgCl等,由于它们溶解度太小,难测其水溶液的导电性,它们溶解的部分是完全电离的,另外,它们在熔融状态能够导电,所以是电解质。
(5)共价化合物水溶液中,在水分子作用下,共价化合物可电离并且导电。
而共价化合物在熔融状态下不能导电;离子化合物在两种状态下都可以导电,这点可以用来区别共价化合物和离子化合物。
电解质与非电解质的异同
有自由移动的电子或离子
现有以下物质:①NaCl晶体; ②液态CO2;③醋酸;④汞;⑤Na2SO4固体;⑥蔗糖;⑦酒精;⑧熔化的KNO3 请回答下列问题(用序号):
④
⑧
酸、碱、盐、氧化物、水
①
③
⑤
⑧
(1)以上物质能导电的是________
(2)以上物质属于电解质的是__________
运用知识能力
1.电离:电解质在水溶液中或熔融状态下,离解成自由移动离子的过程。
2.电离方程式
(1)强电解质:完全电离,用“=”连接。
(2)弱电解质:部分电离,用“ ”连接。
①多元弱酸(如H2CO3、H2SO3、H2S等均为二元弱酸)分步电离,且电离程度逐步减弱,酸性由第一步电离决定,
如H2CO3电离方程式:H2CO3 H++HCO3- 、HCO3- H++CO32-
②多元弱碱[如Cu(OH)2、Mg(OH)2、Fe(OH)3等]分步电离,但一步写出,
如Fe(OH)3电离方程式:Fe(OH)3 Fe3++3OH-
③酸式盐的电离:多元强酸酸式盐与多元弱酸酸式盐的阴离子电离方式不同,
如NaHSO4溶于水中: NaHSO4===Na++H++SO42-
在熔融状态下: NaHSO4===Na++HSO4-
NaHCO3溶于水中: NaHCO3===Na++HCO3-,HCO3- H++CO32-
电解质的电离
写出下列物质的电离方程式。
(1)CH3COOH:______________________
(2)Ba(OH)2:______________________
(3)NH3·H2O:______________________
(4)BaSO4:______________________
(5)KAl(SO4)2:______________________
可分成“写、拆、删、查”四步
①写:写出反应的化学方程式。
②拆:把易溶于水,易电离的物质写成离子形式。
③删:把不参加反应的离子从方程式两边删去。
④查:检查方程式两边是否符合原子守恒和电荷守恒。
【例题】请写出硝酸银和氯化钾反应的离子方程式
写:AgNO3 + KCl == AgCl↓ + KNO3
改:Ag++NO3-+K++Cl-= AgCl↓+K++NO3-
删:Ag++NO3-+K++Cl-= AgCl↓+K++NO3-
查: Ag+ + Cl- == AgCl↓
离子方程式的书写
化学方程式只表示某一具体的反应,而离子方程式不仅可以表示某一个具体的反应,而且还可以表示同一类型的离子反应。
例如,完成下列反应的离子方程式。
① HCl+NaOH
② HCl+KOH
③ NaOH + H2SO4
④ H2SO4+KOH
离子方程式都是
H++OH-==H2O
【思考】是否所有的酸碱中和反应的离子方程式都可表示为:
H++OH-==H2O
不是,强酸、强碱中和生成可溶性盐的反应通常可用H++OH-==H2O表示。
离子方程式的意义
下列反应的离子方程式书写正确的是( )
A.H2SO4溶液与氨水反应:H++OH-=H2O
B.CuO与稀盐酸反应:CuO+2H+=Cu2++H2O
C.AlCl3溶液与氢氧化钠溶液反应:
AlCl3+3OH-=Al(OH)3↓+3Cl-
D.大理石与盐酸反应:CO32-+H+=CO2↑+H2O
C
1.无限定条件下的离子共存
(1)离子间发生复分解反应
①生成难电离物质(水、弱酸、一水合氨等)的离子不能大量共存。
如:H+与CH3COO-、CO32-、HCO3-、S2-等生成弱酸不能大量共存;OH-与NH4+(稀溶液)生成弱碱不能大量共存;H+与OH-生成水不能大量共存。
②生成难溶物或微溶物的离子不能大量共存。
如:Ba2+、Ca2+ 与 CO32-、SO42- 、SO32- 生成难(微)溶物不能大量共存。
③生成气体及挥发性物质的离子不能大量共存。
如:H+ 与 CO32-、HCO3-、SO32-、HSO3-生成气体不能大量共存。
离子共存
(2)氧化还原反应类型
离子之间发生氧化还原反应而不能大量共存。
离子共存
2.有限定条件(隐含条件)下的离子共存
(1)无色溶液:有色离子不能大量存在。
Cu2+(蓝色)、Fe2+(浅绿色)、Fe3+(棕黄色)、MnO4-(紫红色)、Cr2O42-(橙红色)等
(2)溶液显酸性:
无大量的OH-及弱酸的酸根离子或酸式酸根离子。
(3)溶液显碱性:
无大量的H+及弱碱的阳离子、弱酸的酸式酸根离子。
(4)“一定”“可能”还是“不能”大量共存:
确定是“可能”还是“肯定”
水溶液中能大量共存的一组离子是( )
A.NH4+、Ba2+、Br-、CO32-
B.Cl-、SO32-、Fe2+、H+
C.K+、Na+、SO42-、MnO4-
D.Na+、H+、NO3-、HCO3-
C
A
室温下,下列各组离子在指定溶液中能大量共存的是( )A.0.1 mol·L-1 NaOH溶液:Na+、K+、CO32-、AlO2-B.0.1 mol·L-1 FeCl2溶液:K+、Mg2+、SO42-、MnO4-C.0.1 mol·L-1 K2CO3溶液:Na+、Ba2+、Cl-、OH-D.0.1 mol·L-1 H2SO4溶液:K+、NH4+、NO3-、HSO3-
Na+、K+、CO32-、AlO2-之间都不反应,且都不与OH-反应,可以大量共存,A正确;FeCl2溶液由于Fe2+的水解而呈酸性,酸性条件下,Fe2+可被MnO4-氧化为Fe3+,Cl-也能被MnO4-氧化,不能大量共存,B错误;Ba2+与CO32-反应生成BaCO3沉淀而不能大量共存,C错误;HSO3-能与H+反应而不能大量存在,且酸性条件下,NO3-有强氧化性,能够氧化HSO3-,D错误。
解析
得电子、化合价降低、被还原、发生还原反应
失电子、化合价升高、被氧化、发生氧化反应
本质
标志
结果
反应类型
微观视角
宏观视角
口诀:升失氧化还原剂 降得还原氧化剂
双线桥法
单线桥法
还原剂 + 氧化剂 = 氧化产物+还原产物
氧化还原反应反应
四大规律
配平原则
氧化还原反应应用
先后规律
强弱规律
价态规律
守恒规律
得失升降
前强后弱
强完弱继
就近变价
三守恒
四种比较强弱的方法
根据方程式比较
根据金属(非金属)活动比较
根据反应进行的程度比较
根据反应难易比较
氧化还原反应反应
A.有氧元素参加的反应一定是氧化还原反应 ( )
B.分解反应一定是氧化还原反应 ( )
C.有单质生成的反应一定是氧化还原反应 ( )
D.在反应中不一定所有元素的化合价都发生了变化 ( )
E.肯定有一种元素被氧化,就有另一种元素被还原 ( )
F.某元素从化合态变成游离态时,该元素一定被还原 ( )
G.非金属单质在反应中只作氧化剂 ( )
H.金属阳离子被还原不一定得到金属单质 ( )
【答案】× × × √ × × × √
下列化学反应中溴元素仅被氧化的是( )A.2NaBr+Cl2== 2NaCl+Br2B.Br2+2NaI== 2NaBr+I2C.3Br2+6NaOH 5NaBr+NaBrO3+3H2OD.HBr+NaOH==NaBr+H2O
A
2NaBr+Cl2==2NaCl+Br2中Br元素化合价升高,被氧化,A正确;Br2+2NaI==2NaBr+I2中Br元素化合价降低,被还原,B错误;3Br2+6NaOH 5NaBr+NaBrO3+3H2O中Br元素化合价既有升高又有降低,溴元素既被氧化又被还原,C错误;HBr+NaOH==NaBr+H2O中Br元素化合价不变,D错误。
解析
为消除碘缺乏病在食盐中可加入适量的碘酸钾,检验食盐中是否加碘,可利用如下反应:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
(1)用双线桥法表示该方程式电子转移的方向与数目。
KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
(2)该反应中氧化剂和还原剂的物质的量之比为________。
(3)如果反应中转移1 mol电子,则生成碘的物质的量为________。
5∶1
5 ×
5 ×
0.6 mol
