人教版高中化学必修第一册第一章物质及其变化1.3.2氧化剂与还原剂课件(26页ppt)
文档属性
| 名称 | 人教版高中化学必修第一册第一章物质及其变化1.3.2氧化剂与还原剂课件(26页ppt) |

|
|
| 格式 | ppt | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-12 00:00:00 | ||
图片预览







文档简介
(共26张PPT)
第2课时
氧化剂与还原剂
第一章 第3节 氧化还原反应
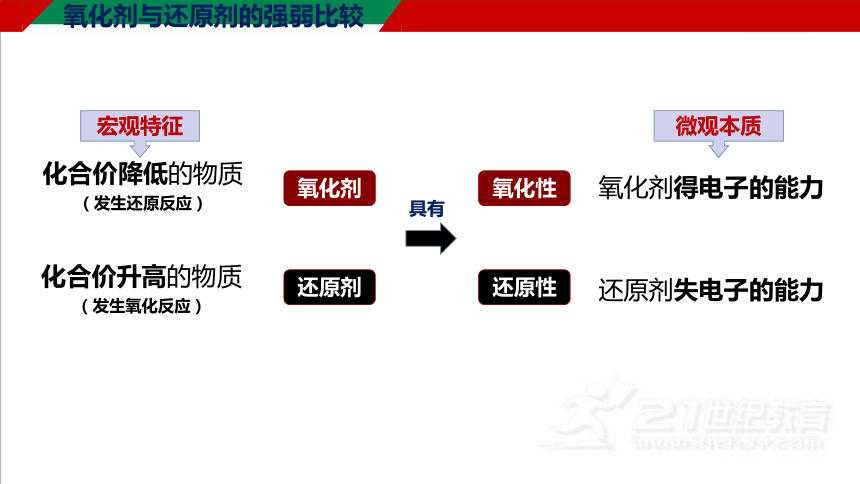
认识氧化剂、还原剂
氧化剂与还原剂的强弱比较
氧化性
还原性
氧化剂得电子的能力
还原剂失电子的能力
氧化剂
还原剂
化合价降低的物质
(发生还原反应)
化合价升高的物质
(发生氧化反应)
具有
宏观特征
微观本质
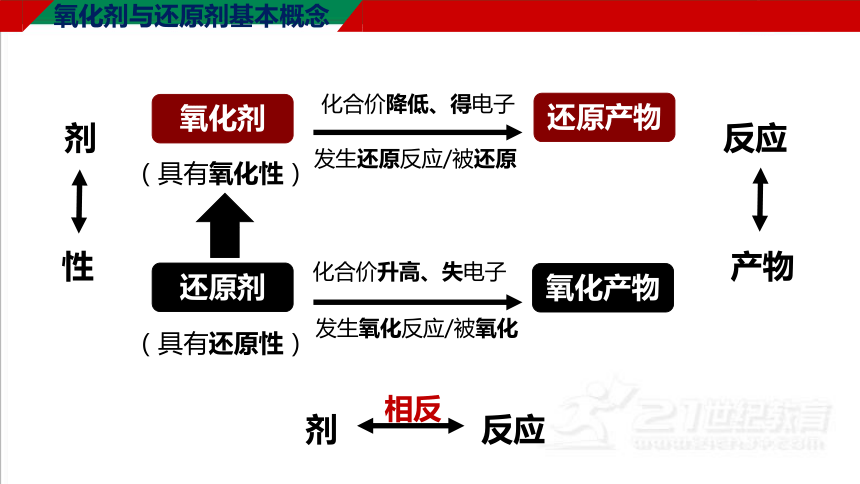
氧化剂与还原剂基本概念
Fe2O3 + 3CO 2Fe + 3CO2
+3
+2
发生氧化反应 /被氧化
失去3×2e-
氧化剂
还原剂
+4
0
还原产物
氧化产物
化合价升高
发生还原反应
/被还原
得到2×3e-
化合价降低
思考
①、分别画出双线桥、单线桥
②、找到反应中的氧化剂、还原剂
氧化剂
(具有氧化性)
发生还原反应/被还原
化合价降低、得电子
还原产物
还原剂
(具有还原性)
发生氧化反应/被氧化
化合价升高、失电子
氧化产物
剂
性
反应
产物
氧化剂与还原剂基本概念
e-
剂
反应
相反
【例1】分析下列反应并按要求填空。
(1)2Fe+3Cl2 2FeCl3
化合价升高的元素是______,失电子的物质是______________,发生了_________反应,生成了________产物,Fe是________剂;
化合价降低的元素是______,得电子的物质是______________,发生了_________反应,生成了________产物,Cl2是________剂;
Cl
Fe
还原
氧化剂与还原剂基本概念
Cl2
Fe
还原
氧化
氧化
氧化
还原
规律:“升失氧,还原剂;降得还,氧化剂”
【例1】分析下列反应并按要求填空。
(3)2H2S+SO2===3S↓+2H2O
氧化剂是_____,还原剂是_____;氧化产物是____,还原产物是_____。
(4)H2O2+2H++2Fe2+===2Fe3++2H2O
氧化剂是________,还原剂是_____;氧化产物是_____,还原产物是____。
(5)2H2O2 === O2↑+2H2O
氧化剂是_______,还原剂是______;氧化产物是____,还原产物是_______。
SO2
H2S
S
S
H2O2
Fe2+
Fe3+
H2O
H2O2
H2O
氧化剂与还原剂基本概念
H2O2
O2
氧化剂与还原剂基本概念
下列变化需要加入氧化剂才能完成的是( )
A、CuO → Cu
B、Fe → FeCl2
C、H2SO4 → SO2
D、HNO3 → N2O
下列变化需要加入还原剂才能完成的是( )
A、Fe2+ → Fe3+
B、CO32- → CO2
C、H2SO4 → H2
D、CaO → Ca(OH)2
如何预测
氧化剂、还原剂
氧化剂与还原剂预测依据——化合价
核心元素化合价 实例 性质
最高价 只有____________
中间价 既有____________
又有____________
最低价 只有____________
氧化性
氧化性
还原性
还原性
“最高价只有氧化性、最低价只有还原性”
氧化剂与还原剂的强弱比较
NH3、NH4+
-3
-3
H2S
-2
不正确。如SO2中的硫元素处于中间价态,化合价既可升高又可降低,SO2既有还原性又有氧化性。
一种物质若具有还原性,则不具有氧化性,这种说法正确吗?说明理由。
氧化剂与还原剂的强弱比较
常见氧化剂、还原剂
常见氧化剂、还原剂
①活泼性较强的非金属单质:如_____、_________等。
②变价元素的高价态化合物:如______________、________、________、__________
__________。
③过氧化物:如________、_______等。
④其他:如HClO、MnO2等。
常见的氧化剂(易降价)
①活泼性较强的金属单质:如Al、Fe、Zn等。
②某些非金属单质:如________、_______、_______等。
③含有较低价态元素的化合物:如________、________、_________、___________等。
常见的还原剂(易升价)
Cl2
酸性KMnO4
FeCl3
HNO3
Na2O2
H2O2
H2
S
C
CO
H2S
浓硫酸
O2
K2Cr2O7
KI
NH3
氧化性与还原性
强弱的比较
氧化性与还原性
强弱的比较方法
1、氧化还原方程
2、元素的活动性顺序
3、反应条件
氧化剂与还原剂的强弱比较
【方法①】通过方程判断
>
>
氧化性:
氧化剂___氧化产物
还原性:
还原剂___还原产物
Fe2O3 + 3CO 2Fe + 3CO2
化合价升高
失去电子
Fe2O3 + 3CO 2Fe + 3CO2
氧化剂
还原剂
还原产物
氧化产物
被氧化
化合价降低
得到电子
被还原
氧化剂与还原剂的强弱比较
再来一刀
【例1】根据反应:
①、2Fe3+ + 2I- === 2Fe2+ + I2
②、Br2 + 2Fe2+ ===2Br- + 2Fe3+
判断离子的还原性由强到弱的顺序
【例2】常温下,发生下列反应:
①16H++10Cl-+ == 2Mn2++5Cl2↑+8H2O
②2Fe2++Br2 == 2Fe3++2Br-
③2Br-+Cl2 == Br2+2Cl-
根据上述反应,可得知MnO4-、Br2、Fe3+、Cl2氧化性由强到弱的顺序是_______________________。
MnO4->Cl2>Br2>Fe3+
小试牛刀
再来一刀
【例3】常温下,在溶液中可发生如下反应:
①、2KBr + Cl2 === 2KCl + Br2
②、2KI + Cl2 === 2KCl + I2
③、2KI + Br2 === 2KBr + I2
【问题1】比较氧化性顺序、还原性顺序
【问题2】下面这个反应可以发生吗?
2KCl + Br2 === 2KBr + Cl2
反应中Fe是 _____剂,Cu是 _____产物。
例如:Fe+CuSO4 == FeSO4+Cu
还原
还原
金属的还原性:Fe>Cu
反应中CuSO4是 _____剂, FeSO4是_ ____产物。
氧化
氧化
离子的氧化性: Cu2+ > Fe2+
金属的活泼性越强 ,单质的还原性越强,对应金属离子的氧化性越弱。
【方法②】通过活动性顺序判断
氧化剂与还原剂的强弱比较
【方法②】通过活动性顺序判断
非金属单质的氧化性越弱,对应离子的还原性越强
氧化剂与还原剂的强弱比较
F2
Cl2
Br2
I2
F-
Cl-
Br-
I-
单质的氧化性逐渐减弱
离子的还原性逐渐增强
【方法③】通过反应条件判断
根据反应条件的难易来判断
反应的条件越简单,反应就越容易发生,说明物质氧化性(或还原性)越强。
例:2KMnO4 + 16HCl(浓) === 2KCl + 2MnCl2 + 8H2O + 5Cl2↑
MnO2 + 4HCl(浓) MnCl2 + 2H2O + Cl2↑
氧化性:_____________________________
△
KMnO4>MnO2
氧化剂与还原剂的强弱比较
【方法③】通过反应条件判断
根据反应条件的难易来判断
相同条件下,反应越剧烈,说明物质的氧化性(或还原性)越强。
例:2Na + 2H2O == 2NaOH + H2
Na + 2HCl == NaCl + H2
氧化性:____________________
HCl>H2O
氧化剂与还原剂的强弱比较
钠块熔融
爆炸
【例2】已知H2能与Cl2、Br2发生反应,前者反应的条件是点燃或光照,后者反应的条件是高温,Cl2和Br2的氧化性强弱关系是________。
H2 + Cl2 2HCl
点燃/光照
H2 + Br2 2HBr
高温
Cl2>Br2。与同一还原剂反应时,反应越容易进行,则氧化剂的氧化性越强,故氧化性强弱关系为Cl2>Br2。
氧化剂与还原剂的强弱比较
燃料的燃烧
光合作用
氧化还原反应的应用
钢铁的锈蚀
食物的腐败
有的反应是有益于人类活动的
有的反应对人类活动是有害的
SO2 是唯一在葡萄酒生产中普遍应用的添加剂。SO2 可以抑制氧化酶的作用,防止原料氧化,避免葡萄酒的氧化变色,以及其他一些葡萄酒病害发生。合理适量使用二氧化硫,可以对葡萄酒的成分和质量产生相当程度的积极影响。
红酒中的二氧化硫
小试牛刀
(1)氧化剂得电子被氧化为还原产物( )
(2)非金属单质在反应中只作氧化剂( )
(3)在氧化还原反应中,金属单质作反应物时一定是还原剂( )
(4)还原剂失去电子具有氧化性( )
(5)元素处于最高化合价时一定具有强氧化性( )
(6)碘化氢中碘为最低价,碘化氢只具有还原性( )
(7)阳离子只能得电子被还原,阴离子只能失电子被氧化( )
(8)在同一反应中,氧化剂和还原剂不可能是同一物质( )
(9)某物质在氧化还原反应中是氧化产物,则必然有另一物质是还原产物( )
1.判断正误
×
√
×
×
×
×
×
×
×
第2课时
氧化剂与还原剂
第一章 第3节 氧化还原反应
认识氧化剂、还原剂
氧化剂与还原剂的强弱比较
氧化性
还原性
氧化剂得电子的能力
还原剂失电子的能力
氧化剂
还原剂
化合价降低的物质
(发生还原反应)
化合价升高的物质
(发生氧化反应)
具有
宏观特征
微观本质
氧化剂与还原剂基本概念
Fe2O3 + 3CO 2Fe + 3CO2
+3
+2
发生氧化反应 /被氧化
失去3×2e-
氧化剂
还原剂
+4
0
还原产物
氧化产物
化合价升高
发生还原反应
/被还原
得到2×3e-
化合价降低
思考
①、分别画出双线桥、单线桥
②、找到反应中的氧化剂、还原剂
氧化剂
(具有氧化性)
发生还原反应/被还原
化合价降低、得电子
还原产物
还原剂
(具有还原性)
发生氧化反应/被氧化
化合价升高、失电子
氧化产物
剂
性
反应
产物
氧化剂与还原剂基本概念
e-
剂
反应
相反
【例1】分析下列反应并按要求填空。
(1)2Fe+3Cl2 2FeCl3
化合价升高的元素是______,失电子的物质是______________,发生了_________反应,生成了________产物,Fe是________剂;
化合价降低的元素是______,得电子的物质是______________,发生了_________反应,生成了________产物,Cl2是________剂;
Cl
Fe
还原
氧化剂与还原剂基本概念
Cl2
Fe
还原
氧化
氧化
氧化
还原
规律:“升失氧,还原剂;降得还,氧化剂”
【例1】分析下列反应并按要求填空。
(3)2H2S+SO2===3S↓+2H2O
氧化剂是_____,还原剂是_____;氧化产物是____,还原产物是_____。
(4)H2O2+2H++2Fe2+===2Fe3++2H2O
氧化剂是________,还原剂是_____;氧化产物是_____,还原产物是____。
(5)2H2O2 === O2↑+2H2O
氧化剂是_______,还原剂是______;氧化产物是____,还原产物是_______。
SO2
H2S
S
S
H2O2
Fe2+
Fe3+
H2O
H2O2
H2O
氧化剂与还原剂基本概念
H2O2
O2
氧化剂与还原剂基本概念
下列变化需要加入氧化剂才能完成的是( )
A、CuO → Cu
B、Fe → FeCl2
C、H2SO4 → SO2
D、HNO3 → N2O
下列变化需要加入还原剂才能完成的是( )
A、Fe2+ → Fe3+
B、CO32- → CO2
C、H2SO4 → H2
D、CaO → Ca(OH)2
如何预测
氧化剂、还原剂
氧化剂与还原剂预测依据——化合价
核心元素化合价 实例 性质
最高价 只有____________
中间价 既有____________
又有____________
最低价 只有____________
氧化性
氧化性
还原性
还原性
“最高价只有氧化性、最低价只有还原性”
氧化剂与还原剂的强弱比较
NH3、NH4+
-3
-3
H2S
-2
不正确。如SO2中的硫元素处于中间价态,化合价既可升高又可降低,SO2既有还原性又有氧化性。
一种物质若具有还原性,则不具有氧化性,这种说法正确吗?说明理由。
氧化剂与还原剂的强弱比较
常见氧化剂、还原剂
常见氧化剂、还原剂
①活泼性较强的非金属单质:如_____、_________等。
②变价元素的高价态化合物:如______________、________、________、__________
__________。
③过氧化物:如________、_______等。
④其他:如HClO、MnO2等。
常见的氧化剂(易降价)
①活泼性较强的金属单质:如Al、Fe、Zn等。
②某些非金属单质:如________、_______、_______等。
③含有较低价态元素的化合物:如________、________、_________、___________等。
常见的还原剂(易升价)
Cl2
酸性KMnO4
FeCl3
HNO3
Na2O2
H2O2
H2
S
C
CO
H2S
浓硫酸
O2
K2Cr2O7
KI
NH3
氧化性与还原性
强弱的比较
氧化性与还原性
强弱的比较方法
1、氧化还原方程
2、元素的活动性顺序
3、反应条件
氧化剂与还原剂的强弱比较
【方法①】通过方程判断
>
>
氧化性:
氧化剂___氧化产物
还原性:
还原剂___还原产物
Fe2O3 + 3CO 2Fe + 3CO2
化合价升高
失去电子
Fe2O3 + 3CO 2Fe + 3CO2
氧化剂
还原剂
还原产物
氧化产物
被氧化
化合价降低
得到电子
被还原
氧化剂与还原剂的强弱比较
再来一刀
【例1】根据反应:
①、2Fe3+ + 2I- === 2Fe2+ + I2
②、Br2 + 2Fe2+ ===2Br- + 2Fe3+
判断离子的还原性由强到弱的顺序
【例2】常温下,发生下列反应:
①16H++10Cl-+ == 2Mn2++5Cl2↑+8H2O
②2Fe2++Br2 == 2Fe3++2Br-
③2Br-+Cl2 == Br2+2Cl-
根据上述反应,可得知MnO4-、Br2、Fe3+、Cl2氧化性由强到弱的顺序是_______________________。
MnO4->Cl2>Br2>Fe3+
小试牛刀
再来一刀
【例3】常温下,在溶液中可发生如下反应:
①、2KBr + Cl2 === 2KCl + Br2
②、2KI + Cl2 === 2KCl + I2
③、2KI + Br2 === 2KBr + I2
【问题1】比较氧化性顺序、还原性顺序
【问题2】下面这个反应可以发生吗?
2KCl + Br2 === 2KBr + Cl2
反应中Fe是 _____剂,Cu是 _____产物。
例如:Fe+CuSO4 == FeSO4+Cu
还原
还原
金属的还原性:Fe>Cu
反应中CuSO4是 _____剂, FeSO4是_ ____产物。
氧化
氧化
离子的氧化性: Cu2+ > Fe2+
金属的活泼性越强 ,单质的还原性越强,对应金属离子的氧化性越弱。
【方法②】通过活动性顺序判断
氧化剂与还原剂的强弱比较
【方法②】通过活动性顺序判断
非金属单质的氧化性越弱,对应离子的还原性越强
氧化剂与还原剂的强弱比较
F2
Cl2
Br2
I2
F-
Cl-
Br-
I-
单质的氧化性逐渐减弱
离子的还原性逐渐增强
【方法③】通过反应条件判断
根据反应条件的难易来判断
反应的条件越简单,反应就越容易发生,说明物质氧化性(或还原性)越强。
例:2KMnO4 + 16HCl(浓) === 2KCl + 2MnCl2 + 8H2O + 5Cl2↑
MnO2 + 4HCl(浓) MnCl2 + 2H2O + Cl2↑
氧化性:_____________________________
△
KMnO4>MnO2
氧化剂与还原剂的强弱比较
【方法③】通过反应条件判断
根据反应条件的难易来判断
相同条件下,反应越剧烈,说明物质的氧化性(或还原性)越强。
例:2Na + 2H2O == 2NaOH + H2
Na + 2HCl == NaCl + H2
氧化性:____________________
HCl>H2O
氧化剂与还原剂的强弱比较
钠块熔融
爆炸
【例2】已知H2能与Cl2、Br2发生反应,前者反应的条件是点燃或光照,后者反应的条件是高温,Cl2和Br2的氧化性强弱关系是________。
H2 + Cl2 2HCl
点燃/光照
H2 + Br2 2HBr
高温
Cl2>Br2。与同一还原剂反应时,反应越容易进行,则氧化剂的氧化性越强,故氧化性强弱关系为Cl2>Br2。
氧化剂与还原剂的强弱比较
燃料的燃烧
光合作用
氧化还原反应的应用
钢铁的锈蚀
食物的腐败
有的反应是有益于人类活动的
有的反应对人类活动是有害的
SO2 是唯一在葡萄酒生产中普遍应用的添加剂。SO2 可以抑制氧化酶的作用,防止原料氧化,避免葡萄酒的氧化变色,以及其他一些葡萄酒病害发生。合理适量使用二氧化硫,可以对葡萄酒的成分和质量产生相当程度的积极影响。
红酒中的二氧化硫
小试牛刀
(1)氧化剂得电子被氧化为还原产物( )
(2)非金属单质在反应中只作氧化剂( )
(3)在氧化还原反应中,金属单质作反应物时一定是还原剂( )
(4)还原剂失去电子具有氧化性( )
(5)元素处于最高化合价时一定具有强氧化性( )
(6)碘化氢中碘为最低价,碘化氢只具有还原性( )
(7)阳离子只能得电子被还原,阴离子只能失电子被氧化( )
(8)在同一反应中,氧化剂和还原剂不可能是同一物质( )
(9)某物质在氧化还原反应中是氧化产物,则必然有另一物质是还原产物( )
1.判断正误
×
√
×
×
×
×
×
×
×
