广东省惠州市2025-2026学年高三上学期第一次调研考试化学试卷(含答案)
文档属性
| 名称 | 广东省惠州市2025-2026学年高三上学期第一次调研考试化学试卷(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-12 00:00:00 | ||
图片预览

文档简介
广东省惠州市2026届高三上学期第一次调研考试化学试题
一、单选题
1.文物记载着中华文明的灿烂成就,下列文物的主要材质属于无机非金属材料的是
A.近代铜香炉 B.“虎”字中堂书画 C.“十二生肖”玉镯 D.清刘永福官服
A.A B.B C.C D.D
2.科技的快速发展彰显国力的强大,下列说法正确的是
A.“中国天眼”传输信息用到了光纤材料,其主要成分是Si
B.“梦天实验舱”原子钟利用电子跃迁计时,工作时发生化学变化
C.“天宫二号”空间站使用了石墨烯存储器,石墨烯属于有机物
D.“天和核心舱”电推进系统采用氮化硼(BN)陶瓷,氮化硼含共价键
3.电影《哪吒2》中有许多情境与化学知识密切相关,下列说法不正确的是
A.石矶娘娘的主要成分为碳酸钙,碳酸钙属于强电解质
B.海底炼狱中使用铁链困住妖兽,Fe在元素周期表中位于p区
C.天元鼎的设计灵感源于商龙纹青铜鼎,青铜的熔点低于铜
D.敖丙制造的冰晶具有规则的几何外形,体现了晶体的自范性
4.惠州美食享有盛誉,下列有关说法正确的是
A.酿豆腐——制作豆腐时加入石膏,该过程涉及胶体的聚沉
B.客家娘酒——糯米先水解生成葡萄糖,葡萄糖再水解生成乙醇
C.盐焗鸡——所用的粗盐由海水晒制而成,晒盐过程主要涉及降温结晶
D.梅菜扣肉——猪肉含有饱和高级脂肪酸甘油酯,油脂属于高分子化合物
5.分离苯和苯酚的过程如下,其中操作a为
A.蒸馏 B.萃取 C.分液 D.过滤
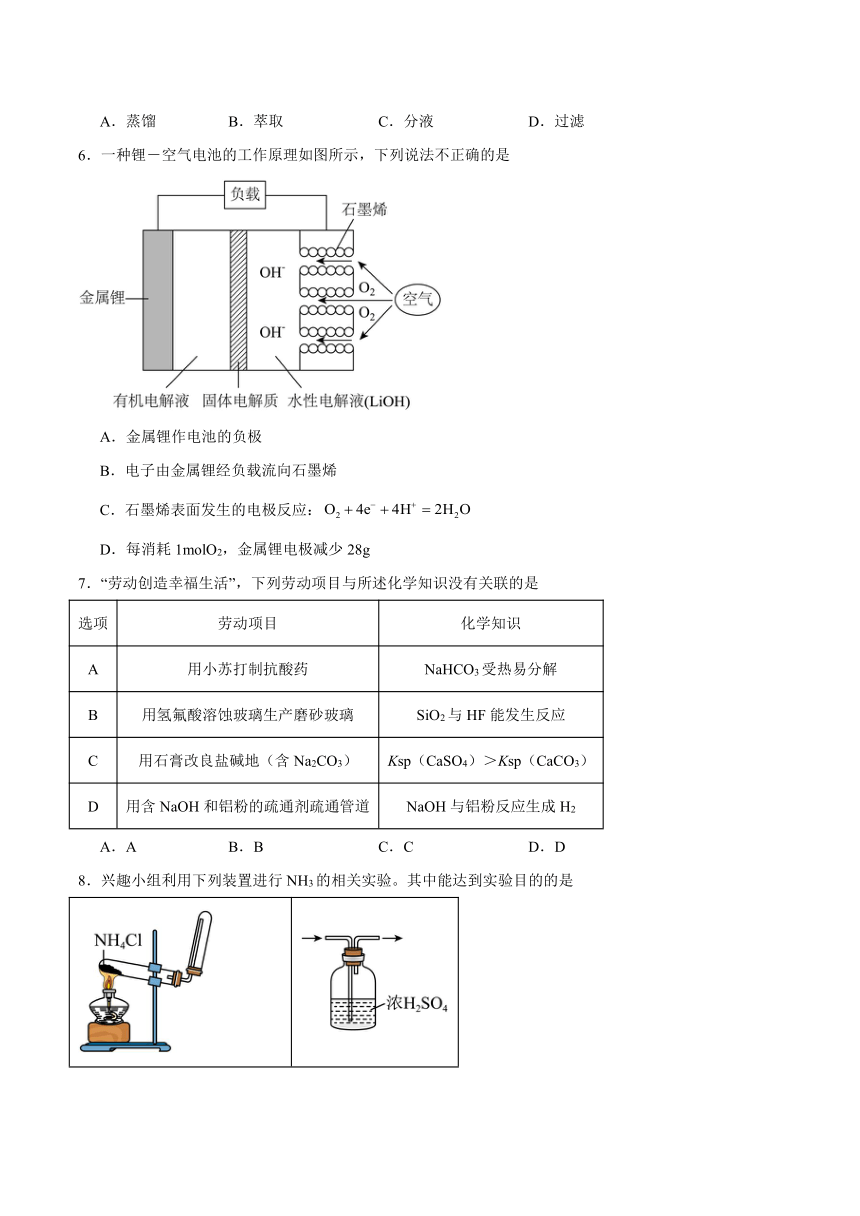
6.一种锂-空气电池的工作原理如图所示,下列说法不正确的是
A.金属锂作电池的负极
B.电子由金属锂经负载流向石墨烯
C.石墨烯表面发生的电极反应:
D.每消耗1molO2,金属锂电极减少28g
7.“劳动创造幸福生活”,下列劳动项目与所述化学知识没有关联的是
选项 劳动项目 化学知识
A 用小苏打制抗酸药 NaHCO3受热易分解
B 用氢氟酸溶蚀玻璃生产磨砂玻璃 SiO2与HF能发生反应
C 用石膏改良盐碱地(含Na2CO3) Ksp(CaSO4)>Ksp(CaCO3)
D 用含NaOH和铝粉的疏通剂疏通管道 NaOH与铝粉反应生成H2
A.A B.B C.C D.D
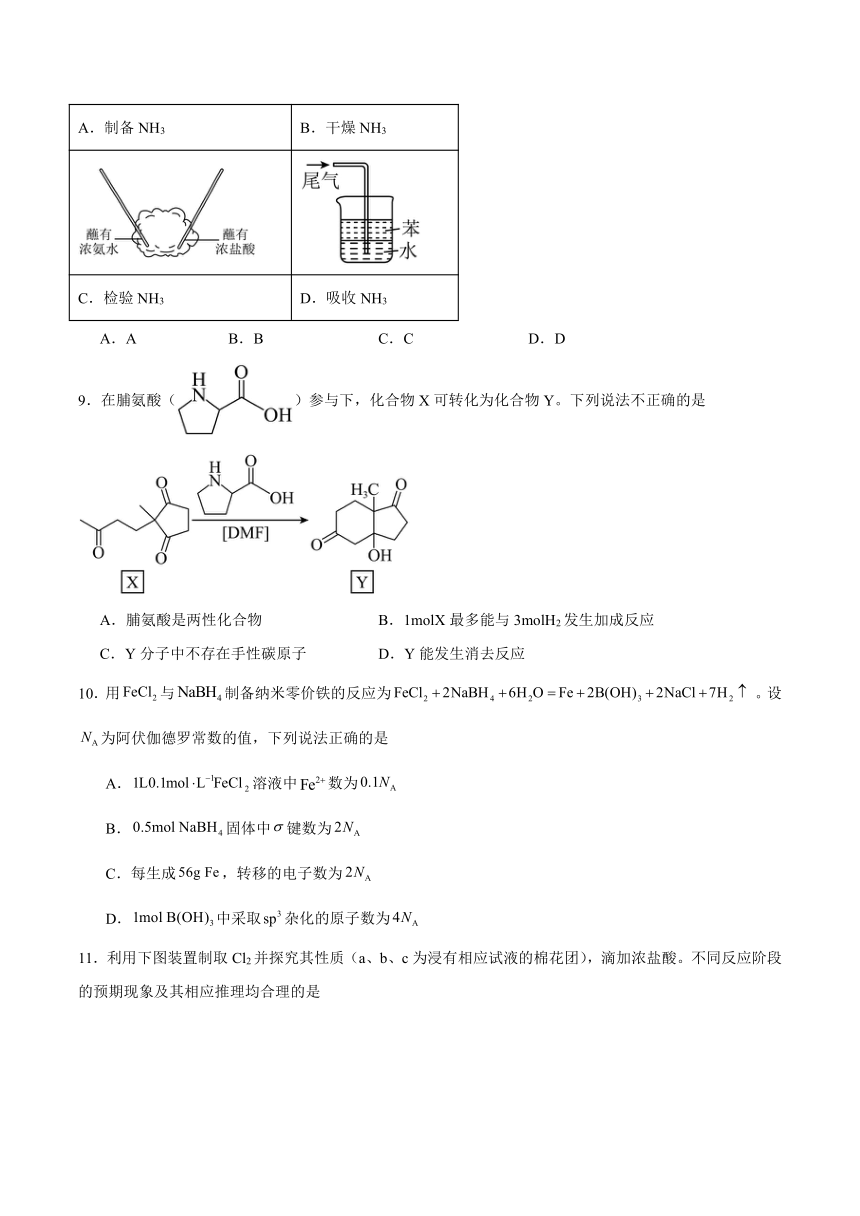
8.兴趣小组利用下列装置进行NH3的相关实验。其中能达到实验目的的是
A.制备NH3 B.干燥NH3
C.检验NH3 D.吸收NH3
A.A B.B C.C D.D
9.在脯氨酸()参与下,化合物X可转化为化合物Y。下列说法不正确的是
A.脯氨酸是两性化合物 B.1molX最多能与3molH2发生加成反应
C.Y分子中不存在手性碳原子 D.Y能发生消去反应
10.用与制备纳米零价铁的反应为。设为阿伏伽德罗常数的值,下列说法正确的是
A.溶液中数为
B.固体中键数为
C.每生成,转移的电子数为
D.中采取杂化的原子数为
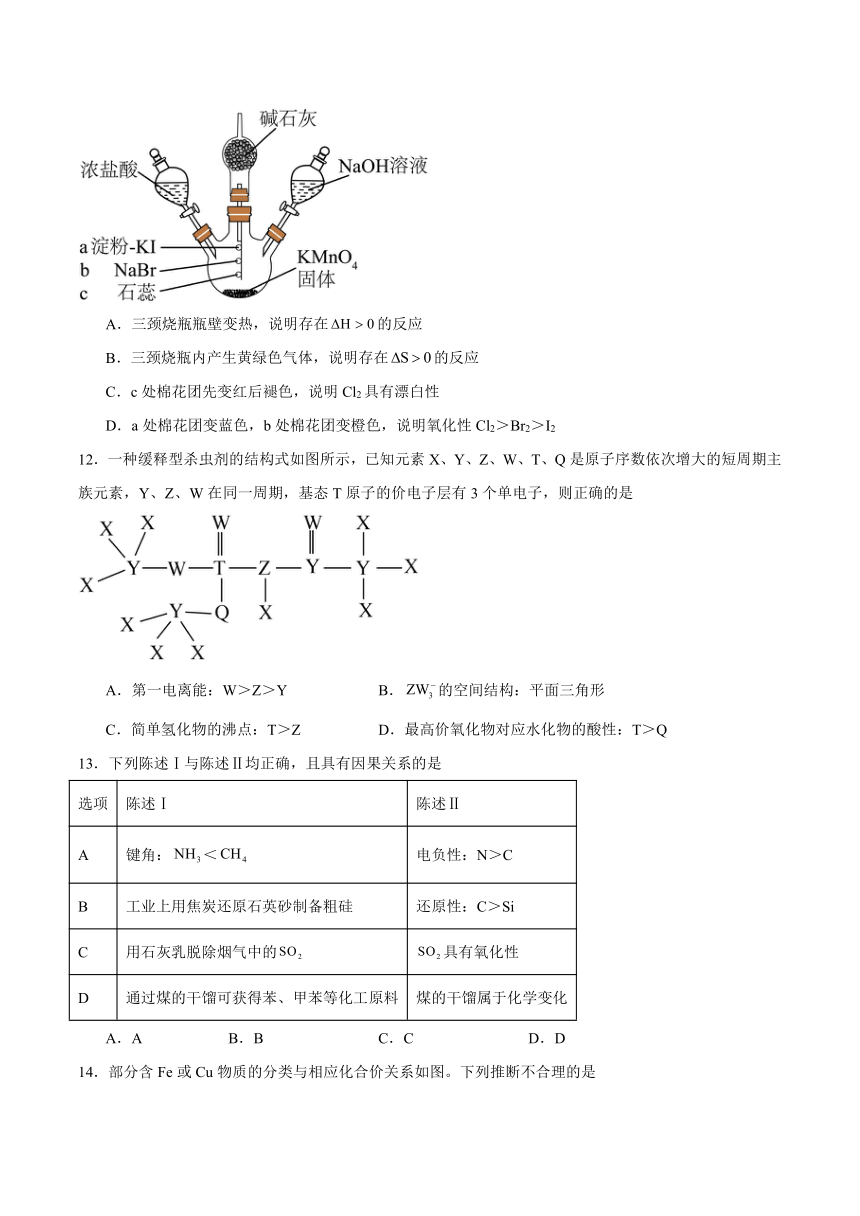
11.利用下图装置制取Cl2并探究其性质(a、b、c为浸有相应试液的棉花团),滴加浓盐酸。不同反应阶段的预期现象及其相应推理均合理的是
A.三颈烧瓶瓶壁变热,说明存在的反应
B.三颈烧瓶内产生黄绿色气体,说明存在的反应
C.c处棉花团先变红后褪色,说明Cl2具有漂白性
D.a处棉花团变蓝色,b处棉花团变橙色,说明氧化性Cl2>Br2>I2
12.一种缓释型杀虫剂的结构式如图所示,已知元素X、Y、Z、W、T、Q是原子序数依次增大的短周期主族元素,Y、Z、W在同一周期,基态T原子的价电子层有3个单电子,则正确的是
A.第一电离能:W>Z>Y B.的空间结构:平面三角形
C.简单氢化物的沸点:T>Z D.最高价氧化物对应水化物的酸性:T>Q
13.下列陈述Ⅰ与陈述Ⅱ均正确,且具有因果关系的是
选项 陈述Ⅰ 陈述Ⅱ
A 键角:< 电负性:N>C
B 工业上用焦炭还原石英砂制备粗硅 还原性:C>Si
C 用石灰乳脱除烟气中的 具有氧化性
D 通过煤的干馏可获得苯、甲苯等化工原料 煤的干馏属于化学变化
A.A B.B C.C D.D
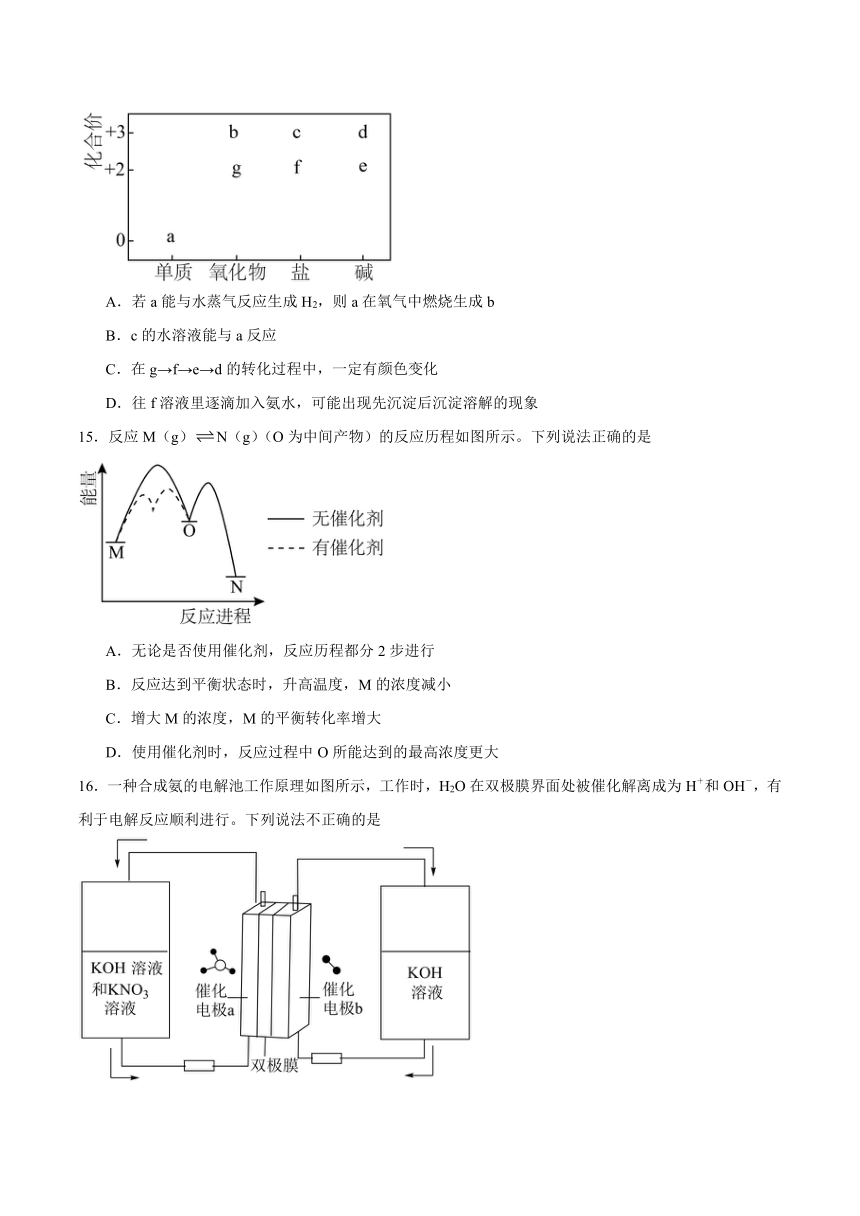
14.部分含Fe或Cu物质的分类与相应化合价关系如图。下列推断不合理的是
A.若a能与水蒸气反应生成H2,则a在氧气中燃烧生成b
B.c的水溶液能与a反应
C.在g→f→e→d的转化过程中,一定有颜色变化
D.往f溶液里逐滴加入氨水,可能出现先沉淀后沉淀溶解的现象
15.反应M(g)N(g)(O为中间产物)的反应历程如图所示。下列说法正确的是
A.无论是否使用催化剂,反应历程都分2步进行
B.反应达到平衡状态时,升高温度,M的浓度减小
C.增大M的浓度,M的平衡转化率增大
D.使用催化剂时,反应过程中O所能达到的最高浓度更大
16.一种合成氨的电解池工作原理如图所示,工作时,H2O在双极膜界面处被催化解离成为H+和OH-,有利于电解反应顺利进行。下列说法不正确的是
A.阴极反应:
B.电解过程中,阳极室pH减小
C.理论上每生成1molNH3,双极膜处有8molH2O解离
D.理论上每生成1molNH3,阳极室溶液质量减少64g
二、解答题
17.乙醛在化工生产、食用香料及药物合成等多个领域都有广泛的应用。
Ⅰ.实验室制备乙醛
(1)仪器a的名称为 。
(2)装置B装有浓硫酸,其作用是 。
(3)装置D中发生反应的化学方程式为 。
Ⅱ.探究乙醛与新制氢氧化铜悬浊液的反应
(4)小组同学完成实验i,记录实验现象。
序号 实验操作 实验现象
i 向试管中加入2mL10%NaOH溶液,5滴5%CuSO4溶液,加入0.5mL40%乙醛溶液,振荡,加热至沸腾 有砖红色沉淀,液面有红褐色粘稠物
①甲同学分析实验现象,对砖红色沉淀的成分提出如下猜想:
猜想a:砖红色沉淀为Cu。
猜想b:砖红色沉淀为Cu2O。
猜想c:砖红色沉淀为Cu和Cu2O的混合物。
[资料]Cu不能溶于浓氨水,Cu2O可溶于浓氨水形成配离子[Cu(NH3)2]+(无色),并在空气中立即被氧化为[Cu(NH3)4]2+(蓝色)。
为验证猜想a、b、c是否成立,设计实验ii进行探究。
序号 实验操作 实验现象
ii 将实验i的浊液过滤、用酒精洗涤,除去粘稠物,往所得固体中加入足量浓氨水,振荡,在空气中放置一段时间
实验结论:猜想b成立。
实验中[Cu(NH3)2]+转化为[Cu(NH3)4]2+的离子方程式为 。
②乙同学认为红褐色粘稠物可能是乙醛在强碱性条件下反应生成的产物。设计实验iii进行验证。
序号 实验操作 实验现象
iii 向试管中加入 溶液,5滴蒸馏水,加入0.5mL40%乙醛溶液,振荡,加热至沸腾 无沉淀生成,液面有红褐色粘稠物
实验结论:乙醛在强碱性条件下生成红褐色粘稠物。
③丙同学通过查阅资料进一步研究乙醛在强碱性条件下生成红褐色粘稠物的反应机理。
[资料]a.与官能团相连的碳原子称为α碳原子,α碳原子上的H称为α-H,α-H活性强。
b.乙醛在强碱性条件下能发生反应:
[拓展]甲醛与新制氢氧化铜悬浊液反应 (填“能”或“不能”)生成多烯醛聚合物,其理由是: 。
18.以大洋锰结核(主要由MnO2和铁的氧化物组成,还含有Al2O3、MgO、ZnO、CaO、SiO2等)为原料,制备MnxOy及Mn(H2PO4)2·2H2O的工艺流程如下:
已知:①25℃时,;。
②金属离子浓度时,认为该离子沉淀完全。相关离子形成氢氧化物沉淀的pH范围如下:
金属离子 Mn2+ Fe2+ Fe3+ Al3+ Mg2+ Zn2+
开始沉淀的pH 8.1 6.3 1.5 3.4 8.9 6.2
沉淀完全的pH 10.1 8.3 2.8 4.7 10.9 8.2
(1)要提高“浸取”的速率,可以采取的方法有 (写一种)。
(2)“浸取”时,MnO2发生反应的离子方程式为 。
(3)“氧化”时,加入H2O2的作用是 。
(4)“调pH”时,pH=6.0的溶液中,c() c()(填“>”“<”或“=”)。
(5)“净化”时,存在。25℃,计算该反应的平衡常数K= (结果保留2位有效数字)。
(6)“沉锰”时,生成MnCO3的离子方程式为 。
(7)“操作X”的过程为 、 、过滤、洗涤、干燥。
(8)“煅烧”时,不同条件下可制得不同锰的氧化物晶体。某种锰的氧化物的四方晶胞如图所示。
①该锰的氧化物化学式为 。
②晶体中一个Mn周围与其最近的O的个数为 ,这些O构成的空间几何体为 。
19.在碳中和背景下,甲酸(HCOOH)作为氢能载体和储氢材料备受关注。
(1)甲酸分子中基态O原子价层电子的轨道表示式为 。
(2)反应a:
已知:
CO2在Bi上电催化的反应历程图
则反应a的= 。
(3)一定条件下,CO2电催化加氢合成甲酸的过程涉及以下反应,反应历程如上图所示。
a.
b.
①由图可知,反应的“最大能垒”:a b(填“>”、“<”或“=”),短时间内产物HCOOH的选择性 (填“高于”或“低于”)CO的选择性(产物A的选择性=×100%)。
②在绝热密闭容器中充入一定量的CO2和H2,发生反应a和b,下列有关说法正确的有 。
A.加压可提高甲酸的选择性 B.加入催化剂可使反应的焓变减小
C.扩大容器体积,CO的平衡产率不变 D.容器内温度不变时,反应体系达到平衡状态
(4)某研究小组发现HCOOH水溶液在密封石英管中发生的反应有:
c.
d.
T℃下,在密封石英管中完全充满1.0的HCOOH水溶液,分解产物均完全溶于水中。反应c的速率远大于反应d.CO2、CO的浓度与反应时间的变化关系如图所示(忽略碳元素的其他存在形式)。
①反应过程中CO的浓度先增大后减小的原因是 。
②反应经过50min达到平衡状态,0~50min中HCOOH的分解速率为 ,反应d的平衡常数为 。
20.一种治疗高尿酸血症和痛风的药物托吡司他(viii)的合成工艺如下:
(1)化合物i的分子式为 ,含氧官能团的名称是 。
(2)化合物A(C7H6O2NCl)是i的同系物,A的某芳香族同分异构体含有硝基,核磁共振氢谱图有3组峰,且峰面积比为1:1:1,其结构简式为 (写一种)。
(3)关于上述合成路线中的相关物质及转化,下列说法正确的有______。
A.化合物ii到iii的转化中,有C-Cl键断裂与C-O键形成
B.化合物iv分子中,有大π键,分子间存在氢键
C.化合物v中,存在p轨道“头碰头”形成的π键
D.化合物vii和viii中,C原子均采取杂化
(4)对于化合物iii,分析预测其可能的化学性质,完成下表。
序号 反应试剂、条件 反应形成的新结构 反应类型
① 还原反应
②
(5)一定条件下,反应物x和y以原子利用率100%的反应制备甲醇,且x为非极性分子。该反应中,
①若y为平面结构的有机分子,则y的结构简式为 。
②若2x+y→CH3OH,则y的化学式为 。
(6)以1,3-丁二烯和甲醇为有机原料,利用合成路线中iii→iv的原理,合成。基于你设计的合成路线,回答下列问题。
①最后一步反应的有机反应物为,其化学方程式为 。
②相关步骤涉及卤代烃制醇的反应,其化学方程式为 。(注明反应条件)
参考答案
1.C
2.D
3.B
4.A
5.C
6.C
7.A
8.C
9.C
10.B
11.B
12.B
13.D
14.A
15.D
16.D
17.(1)分液漏斗
(2)干燥氧气
(3)
(4) 固体完全溶于浓氨水形成无色溶液,振荡,在空气中放置一段时间,溶液立即变为蓝色。 2mL10%NaOH 不能 甲醛没有α碳原子
18.(1)升高浸取温度、将矿石粉碎或适当增大浓度
(2)
(3)将Fe2+氧化为Fe3+,便于后续调pH时生成Fe(OH)3沉淀除去杂质
(4)<
(5)
(6)
(7) 蒸发浓缩 冷却结晶
(8) 6 正八面体
19.(1)
(2)
(3) < 高于 AD
(4) 前,反应c正向进行,逐渐增大,时刻达到平衡,后,随着反应d正向进行,降低,反应c逆向进行,逐渐降低
20.(1) 羧基
(2)或
(3)AB
(4) 稀硫酸、加热 取代反应或水解反应
(5) HCHO CO
(6) +2NaOH+2NaCl
一、单选题
1.文物记载着中华文明的灿烂成就,下列文物的主要材质属于无机非金属材料的是
A.近代铜香炉 B.“虎”字中堂书画 C.“十二生肖”玉镯 D.清刘永福官服
A.A B.B C.C D.D
2.科技的快速发展彰显国力的强大,下列说法正确的是
A.“中国天眼”传输信息用到了光纤材料,其主要成分是Si
B.“梦天实验舱”原子钟利用电子跃迁计时,工作时发生化学变化
C.“天宫二号”空间站使用了石墨烯存储器,石墨烯属于有机物
D.“天和核心舱”电推进系统采用氮化硼(BN)陶瓷,氮化硼含共价键
3.电影《哪吒2》中有许多情境与化学知识密切相关,下列说法不正确的是
A.石矶娘娘的主要成分为碳酸钙,碳酸钙属于强电解质
B.海底炼狱中使用铁链困住妖兽,Fe在元素周期表中位于p区
C.天元鼎的设计灵感源于商龙纹青铜鼎,青铜的熔点低于铜
D.敖丙制造的冰晶具有规则的几何外形,体现了晶体的自范性
4.惠州美食享有盛誉,下列有关说法正确的是
A.酿豆腐——制作豆腐时加入石膏,该过程涉及胶体的聚沉
B.客家娘酒——糯米先水解生成葡萄糖,葡萄糖再水解生成乙醇
C.盐焗鸡——所用的粗盐由海水晒制而成,晒盐过程主要涉及降温结晶
D.梅菜扣肉——猪肉含有饱和高级脂肪酸甘油酯,油脂属于高分子化合物
5.分离苯和苯酚的过程如下,其中操作a为
A.蒸馏 B.萃取 C.分液 D.过滤
6.一种锂-空气电池的工作原理如图所示,下列说法不正确的是
A.金属锂作电池的负极
B.电子由金属锂经负载流向石墨烯
C.石墨烯表面发生的电极反应:
D.每消耗1molO2,金属锂电极减少28g
7.“劳动创造幸福生活”,下列劳动项目与所述化学知识没有关联的是
选项 劳动项目 化学知识
A 用小苏打制抗酸药 NaHCO3受热易分解
B 用氢氟酸溶蚀玻璃生产磨砂玻璃 SiO2与HF能发生反应
C 用石膏改良盐碱地(含Na2CO3) Ksp(CaSO4)>Ksp(CaCO3)
D 用含NaOH和铝粉的疏通剂疏通管道 NaOH与铝粉反应生成H2
A.A B.B C.C D.D
8.兴趣小组利用下列装置进行NH3的相关实验。其中能达到实验目的的是
A.制备NH3 B.干燥NH3
C.检验NH3 D.吸收NH3
A.A B.B C.C D.D
9.在脯氨酸()参与下,化合物X可转化为化合物Y。下列说法不正确的是
A.脯氨酸是两性化合物 B.1molX最多能与3molH2发生加成反应
C.Y分子中不存在手性碳原子 D.Y能发生消去反应
10.用与制备纳米零价铁的反应为。设为阿伏伽德罗常数的值,下列说法正确的是
A.溶液中数为
B.固体中键数为
C.每生成,转移的电子数为
D.中采取杂化的原子数为
11.利用下图装置制取Cl2并探究其性质(a、b、c为浸有相应试液的棉花团),滴加浓盐酸。不同反应阶段的预期现象及其相应推理均合理的是
A.三颈烧瓶瓶壁变热,说明存在的反应
B.三颈烧瓶内产生黄绿色气体,说明存在的反应
C.c处棉花团先变红后褪色,说明Cl2具有漂白性
D.a处棉花团变蓝色,b处棉花团变橙色,说明氧化性Cl2>Br2>I2
12.一种缓释型杀虫剂的结构式如图所示,已知元素X、Y、Z、W、T、Q是原子序数依次增大的短周期主族元素,Y、Z、W在同一周期,基态T原子的价电子层有3个单电子,则正确的是
A.第一电离能:W>Z>Y B.的空间结构:平面三角形
C.简单氢化物的沸点:T>Z D.最高价氧化物对应水化物的酸性:T>Q
13.下列陈述Ⅰ与陈述Ⅱ均正确,且具有因果关系的是
选项 陈述Ⅰ 陈述Ⅱ
A 键角:< 电负性:N>C
B 工业上用焦炭还原石英砂制备粗硅 还原性:C>Si
C 用石灰乳脱除烟气中的 具有氧化性
D 通过煤的干馏可获得苯、甲苯等化工原料 煤的干馏属于化学变化
A.A B.B C.C D.D
14.部分含Fe或Cu物质的分类与相应化合价关系如图。下列推断不合理的是
A.若a能与水蒸气反应生成H2,则a在氧气中燃烧生成b
B.c的水溶液能与a反应
C.在g→f→e→d的转化过程中,一定有颜色变化
D.往f溶液里逐滴加入氨水,可能出现先沉淀后沉淀溶解的现象
15.反应M(g)N(g)(O为中间产物)的反应历程如图所示。下列说法正确的是
A.无论是否使用催化剂,反应历程都分2步进行
B.反应达到平衡状态时,升高温度,M的浓度减小
C.增大M的浓度,M的平衡转化率增大
D.使用催化剂时,反应过程中O所能达到的最高浓度更大
16.一种合成氨的电解池工作原理如图所示,工作时,H2O在双极膜界面处被催化解离成为H+和OH-,有利于电解反应顺利进行。下列说法不正确的是
A.阴极反应:
B.电解过程中,阳极室pH减小
C.理论上每生成1molNH3,双极膜处有8molH2O解离
D.理论上每生成1molNH3,阳极室溶液质量减少64g
二、解答题
17.乙醛在化工生产、食用香料及药物合成等多个领域都有广泛的应用。
Ⅰ.实验室制备乙醛
(1)仪器a的名称为 。
(2)装置B装有浓硫酸,其作用是 。
(3)装置D中发生反应的化学方程式为 。
Ⅱ.探究乙醛与新制氢氧化铜悬浊液的反应
(4)小组同学完成实验i,记录实验现象。
序号 实验操作 实验现象
i 向试管中加入2mL10%NaOH溶液,5滴5%CuSO4溶液,加入0.5mL40%乙醛溶液,振荡,加热至沸腾 有砖红色沉淀,液面有红褐色粘稠物
①甲同学分析实验现象,对砖红色沉淀的成分提出如下猜想:
猜想a:砖红色沉淀为Cu。
猜想b:砖红色沉淀为Cu2O。
猜想c:砖红色沉淀为Cu和Cu2O的混合物。
[资料]Cu不能溶于浓氨水,Cu2O可溶于浓氨水形成配离子[Cu(NH3)2]+(无色),并在空气中立即被氧化为[Cu(NH3)4]2+(蓝色)。
为验证猜想a、b、c是否成立,设计实验ii进行探究。
序号 实验操作 实验现象
ii 将实验i的浊液过滤、用酒精洗涤,除去粘稠物,往所得固体中加入足量浓氨水,振荡,在空气中放置一段时间
实验结论:猜想b成立。
实验中[Cu(NH3)2]+转化为[Cu(NH3)4]2+的离子方程式为 。
②乙同学认为红褐色粘稠物可能是乙醛在强碱性条件下反应生成的产物。设计实验iii进行验证。
序号 实验操作 实验现象
iii 向试管中加入 溶液,5滴蒸馏水,加入0.5mL40%乙醛溶液,振荡,加热至沸腾 无沉淀生成,液面有红褐色粘稠物
实验结论:乙醛在强碱性条件下生成红褐色粘稠物。
③丙同学通过查阅资料进一步研究乙醛在强碱性条件下生成红褐色粘稠物的反应机理。
[资料]a.与官能团相连的碳原子称为α碳原子,α碳原子上的H称为α-H,α-H活性强。
b.乙醛在强碱性条件下能发生反应:
[拓展]甲醛与新制氢氧化铜悬浊液反应 (填“能”或“不能”)生成多烯醛聚合物,其理由是: 。
18.以大洋锰结核(主要由MnO2和铁的氧化物组成,还含有Al2O3、MgO、ZnO、CaO、SiO2等)为原料,制备MnxOy及Mn(H2PO4)2·2H2O的工艺流程如下:
已知:①25℃时,;。
②金属离子浓度时,认为该离子沉淀完全。相关离子形成氢氧化物沉淀的pH范围如下:
金属离子 Mn2+ Fe2+ Fe3+ Al3+ Mg2+ Zn2+
开始沉淀的pH 8.1 6.3 1.5 3.4 8.9 6.2
沉淀完全的pH 10.1 8.3 2.8 4.7 10.9 8.2
(1)要提高“浸取”的速率,可以采取的方法有 (写一种)。
(2)“浸取”时,MnO2发生反应的离子方程式为 。
(3)“氧化”时,加入H2O2的作用是 。
(4)“调pH”时,pH=6.0的溶液中,c() c()(填“>”“<”或“=”)。
(5)“净化”时,存在。25℃,计算该反应的平衡常数K= (结果保留2位有效数字)。
(6)“沉锰”时,生成MnCO3的离子方程式为 。
(7)“操作X”的过程为 、 、过滤、洗涤、干燥。
(8)“煅烧”时,不同条件下可制得不同锰的氧化物晶体。某种锰的氧化物的四方晶胞如图所示。
①该锰的氧化物化学式为 。
②晶体中一个Mn周围与其最近的O的个数为 ,这些O构成的空间几何体为 。
19.在碳中和背景下,甲酸(HCOOH)作为氢能载体和储氢材料备受关注。
(1)甲酸分子中基态O原子价层电子的轨道表示式为 。
(2)反应a:
已知:
CO2在Bi上电催化的反应历程图
则反应a的= 。
(3)一定条件下,CO2电催化加氢合成甲酸的过程涉及以下反应,反应历程如上图所示。
a.
b.
①由图可知,反应的“最大能垒”:a b(填“>”、“<”或“=”),短时间内产物HCOOH的选择性 (填“高于”或“低于”)CO的选择性(产物A的选择性=×100%)。
②在绝热密闭容器中充入一定量的CO2和H2,发生反应a和b,下列有关说法正确的有 。
A.加压可提高甲酸的选择性 B.加入催化剂可使反应的焓变减小
C.扩大容器体积,CO的平衡产率不变 D.容器内温度不变时,反应体系达到平衡状态
(4)某研究小组发现HCOOH水溶液在密封石英管中发生的反应有:
c.
d.
T℃下,在密封石英管中完全充满1.0的HCOOH水溶液,分解产物均完全溶于水中。反应c的速率远大于反应d.CO2、CO的浓度与反应时间的变化关系如图所示(忽略碳元素的其他存在形式)。
①反应过程中CO的浓度先增大后减小的原因是 。
②反应经过50min达到平衡状态,0~50min中HCOOH的分解速率为 ,反应d的平衡常数为 。
20.一种治疗高尿酸血症和痛风的药物托吡司他(viii)的合成工艺如下:
(1)化合物i的分子式为 ,含氧官能团的名称是 。
(2)化合物A(C7H6O2NCl)是i的同系物,A的某芳香族同分异构体含有硝基,核磁共振氢谱图有3组峰,且峰面积比为1:1:1,其结构简式为 (写一种)。
(3)关于上述合成路线中的相关物质及转化,下列说法正确的有______。
A.化合物ii到iii的转化中,有C-Cl键断裂与C-O键形成
B.化合物iv分子中,有大π键,分子间存在氢键
C.化合物v中,存在p轨道“头碰头”形成的π键
D.化合物vii和viii中,C原子均采取杂化
(4)对于化合物iii,分析预测其可能的化学性质,完成下表。
序号 反应试剂、条件 反应形成的新结构 反应类型
① 还原反应
②
(5)一定条件下,反应物x和y以原子利用率100%的反应制备甲醇,且x为非极性分子。该反应中,
①若y为平面结构的有机分子,则y的结构简式为 。
②若2x+y→CH3OH,则y的化学式为 。
(6)以1,3-丁二烯和甲醇为有机原料,利用合成路线中iii→iv的原理,合成。基于你设计的合成路线,回答下列问题。
①最后一步反应的有机反应物为,其化学方程式为 。
②相关步骤涉及卤代烃制醇的反应,其化学方程式为 。(注明反应条件)
参考答案
1.C
2.D
3.B
4.A
5.C
6.C
7.A
8.C
9.C
10.B
11.B
12.B
13.D
14.A
15.D
16.D
17.(1)分液漏斗
(2)干燥氧气
(3)
(4) 固体完全溶于浓氨水形成无色溶液,振荡,在空气中放置一段时间,溶液立即变为蓝色。 2mL10%NaOH 不能 甲醛没有α碳原子
18.(1)升高浸取温度、将矿石粉碎或适当增大浓度
(2)
(3)将Fe2+氧化为Fe3+,便于后续调pH时生成Fe(OH)3沉淀除去杂质
(4)<
(5)
(6)
(7) 蒸发浓缩 冷却结晶
(8) 6 正八面体
19.(1)
(2)
(3) < 高于 AD
(4) 前,反应c正向进行,逐渐增大,时刻达到平衡,后,随着反应d正向进行,降低,反应c逆向进行,逐渐降低
20.(1) 羧基
(2)或
(3)AB
(4) 稀硫酸、加热 取代反应或水解反应
(5) HCHO CO
(6) +2NaOH+2NaCl
同课章节目录
