3.3.4《物质的性质与转化-硝酸》教学课件-(共27张PPT)2025-2026学年鲁科版高中化学(2019)必修一
文档属性
| 名称 | 3.3.4《物质的性质与转化-硝酸》教学课件-(共27张PPT)2025-2026学年鲁科版高中化学(2019)必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 63.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-12 22:41:47 | ||
图片预览








文档简介
(共27张PPT)
第3章 物质的性质与转化
第3节 氮的循环
第三课时 硝酸
【学习目标】
1、证据推理与模型认知:通过对实验现象的观察、分析和推理,培养学生的实验能力、观察能力、思维能力,提高学生的化学素养。
2、宏观辨析与微观探析:掌握硝酸的物理性质和化学性质(不稳定性、酸性、强氧化性)。
3、科学态度与社会责任:了解硝酸尾气能形成酸雨、形成光化学烟雾等知识,可以培养学生的环保意识。
新闻事件
事件中体现了浓硝酸具有哪些性质?
近日,一辆装载了12吨质量分数为63%的浓硝酸的铁槽车发生严重液体泄漏事故,一瞬间看到车辆周围升起一团白雾,刺鼻的气味扑面而来……还不停地冒出浓浓的红棕色的“雾”……
一、硝酸的物理性质
【活动·探究1】取一瓶浓硝酸,打开瓶盖, 观察现象并扇闻其气味。
纯净的硝酸是无色、易挥发、有刺激性气味的液体,与水任意比例互溶。
市售的硝酸中HNO3的质量分数为68%~70%, HNO3质量分数为95%以上的浓硝酸,在空气中挥发出的硝酸蒸气会产生“发烟”现象,通常又叫作发烟硝酸。
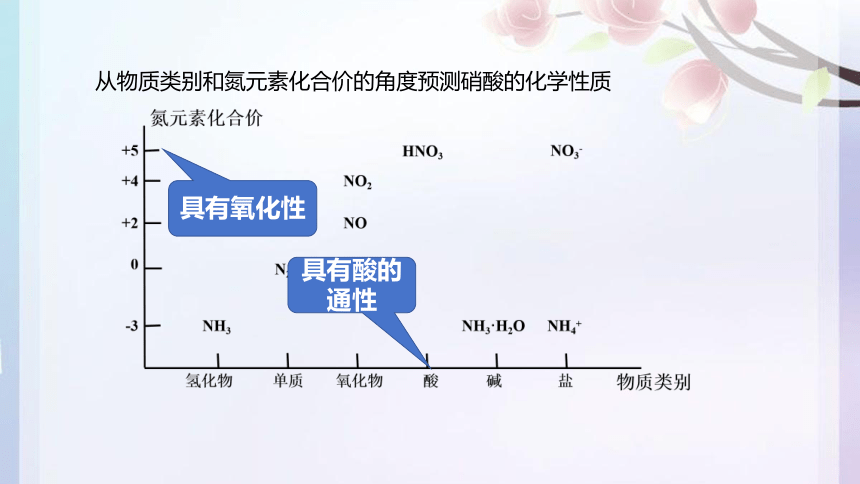
从物质类别和氮元素化合价的角度预测硝酸的化学性质
具有氧化性
具有酸的通性
(1).与指示剂作用:
(2).与碱发生中和反应:
(3).与碱性氧化物反应:
(4).与盐反应:
1、硝酸的强酸性
—— 具有酸的某些通性
二、硝酸的化学性质
2、硝酸的强氧化性
二、硝酸的化学性质
【活动·探究2】铜、铝与浓硝酸反应
实验步骤:
1、将浓硝酸压入盛有铜片或铝片的注射器中,注意控制注射器活塞,观察。
2、实验结束后,将剩余浓硝酸推回原来的注射器,做到固液分离。
温馨提示:氮的氧化物有毒,此类实验都在注射器中完成
【问题组1】
①观察并描述现象。根据现象可以得到什么结论?试写出反应方程式
②在反应中浓硝酸起什么作用?
铜片
浓硝酸
2、硝酸的强氧化性
1)浓硝酸与金属反应:
①现象:
化学方程式:
Cu + HNO3(浓) ------
离子方程式:
以上反应体现了稀硝酸的 性和 性。
铜片溶解,有红棕色气体生成,溶液变绿
NO2
Cu2+
酸性 强氧化
铝和浓硝酸反应的现象?
②钝化:浓硝酸可以使 、 表面形成致密的 而钝化。钝化属于 变化。钝化体现了浓硝酸的 。
铝 铁
氧化膜
化学
强氧化性
2、硝酸的强氧化性
二、硝酸的化学性质
【活动·探究3】铜与稀硝酸反应
实验步骤:
1、将稀硝酸压入盛有铜片的注射器中,注意控制注射器活塞,观察。
2、一段时间后,将剩余稀硝酸推回原来的注射器,做到固液分离。
3、调节三通阀,关闭盛稀硝酸一测,将鼓入空气入,观察。
铜片
空气
稀硝酸
[问题组2]
① 观察并描述现象。根据现象可以得到什么结论?试写出反应方程式
② 在反应中稀硝酸起什么作用?
③ 预测铁与足量稀硝酸反应的产物,并完成化学方程式。
①现象:铜片溶解,有无色气泡生成,溶液变蓝
NO
Cu2+
2、硝酸的强氧化性
2)稀硝酸与金属反应:
化学方程式:Cu + HNO3(稀) ------
离子方程式:
[问题组2]
① 观察并描述现象。根据现象可以得到什么结论?试写出反应方程式
② 在反应中稀硝酸起什么作用?
③ 预测铁与足量稀硝酸反应的产物,并完成化学方程式。
2、硝酸的强氧化性
2)稀硝酸与金属反应:
②化学方程式:Fe + HNO3(稀,足) ------
离子方程式:
硝酸能与除 、 以外的大多数金属反应,还原产物与硝酸的 相关。
金 铂
浓度
D
3)与非金属反应(C、S、P等)
2、硝酸的强氧化性
【问题组3】
①描述碳与浓硝酸反应的实验现象。
②根据现象从氧化还原角度推测另一种产物是什么?试写出浓硝酸与炭粉反应方程式
③在反应中浓硝酸起什么作用?
C + HNO3(浓)---
该反应体现了浓硝酸的 性。
强氧化性
3)与非金属反应(C、S、P等)
C+4HNO3(浓) = 4NO2↑+CO2↑+2H2O
△
S+6HNO3(浓) = 6NO2↑+H2SO4 +2H2O
△
P+5HNO3(浓) = 5NO2↑+H3PO4+H2O
△
2、硝酸的强氧化性
2、硝酸的强氧化性
4)氧化某些还原性微粒:
【活动·探究4】根据所给试剂,你能设计几组实验证明稀硝酸氧化性
试剂:FeSO4溶液、KSCN溶液、稀硝酸、淀粉KI溶液
方案 现象 结论(离子方程式)
应体现了稀硝酸的 性和 性。
Fe2+、S2-,I-、SO32-等
酸性 强氧化性
D
3、硝酸的不稳定性
HNO3 ===== NO2↑
二、硝酸的化学性质
△或见光
硝酸分解产生的二氧化氮气体溶于硝酸中而使硝酸呈黄色。
【思考】为什么久置的浓硝酸会呈现黄色呢?
+ O2↑
+ H2O
4HNO3 ===== 4NO2↑ + O2↑ + 2H2O
△或见光
[问题组4]:
① 久置的浓硝酸为什么呈黄色?
②从氧化还原反应中化合价升降的角度预测另一种产物是什么?
③如何保存浓硝酸?
3、硝酸的不稳定性
二、硝酸的化学性质
如何保存硝酸?
棕色细口玻璃瓶、玻璃塞、阴凉、避光
4.用途
硝酸是一种重要的化工原料,可用于制造炸药、染料、塑料和硝酸盐等。
在实验室里,硝酸是一种重要的化学试剂。
三、人类活动对氮循环和环境的影响
【阅读】课本115-116页,人类活动对自然界氮循环和环境的影响
【问题组5】
1.活化氮的量大大增加原因?
2.含氮物质主要来源?
3.含氮物质对环境影响?
4.减少人类活动对氮循环和环境影响的措施有哪些?
三、人类活动对氮循环和环境的影响
1.含氮物质来源及对环境的影响
利
弊
②增强生态系统对含有氮元素的物质的吸收能力
①控制进入大气、土壤和水体中含有氮元素的物质的量
绿水青山就是金山银山
二、人类活动对氮循环和环境的影响
2.减少人类活动对氮循环和环境的影响措施
与还原性离子
硝酸
物理性质
化学性质
酸性
不稳定性
强氧化性
与金属铜
与单质碳
钝化
课堂小结:
作业:完成学案课后巩固部分
谢 谢
第3章 物质的性质与转化
第3节 氮的循环
第三课时 硝酸
【学习目标】
1、证据推理与模型认知:通过对实验现象的观察、分析和推理,培养学生的实验能力、观察能力、思维能力,提高学生的化学素养。
2、宏观辨析与微观探析:掌握硝酸的物理性质和化学性质(不稳定性、酸性、强氧化性)。
3、科学态度与社会责任:了解硝酸尾气能形成酸雨、形成光化学烟雾等知识,可以培养学生的环保意识。
新闻事件
事件中体现了浓硝酸具有哪些性质?
近日,一辆装载了12吨质量分数为63%的浓硝酸的铁槽车发生严重液体泄漏事故,一瞬间看到车辆周围升起一团白雾,刺鼻的气味扑面而来……还不停地冒出浓浓的红棕色的“雾”……
一、硝酸的物理性质
【活动·探究1】取一瓶浓硝酸,打开瓶盖, 观察现象并扇闻其气味。
纯净的硝酸是无色、易挥发、有刺激性气味的液体,与水任意比例互溶。
市售的硝酸中HNO3的质量分数为68%~70%, HNO3质量分数为95%以上的浓硝酸,在空气中挥发出的硝酸蒸气会产生“发烟”现象,通常又叫作发烟硝酸。
从物质类别和氮元素化合价的角度预测硝酸的化学性质
具有氧化性
具有酸的通性
(1).与指示剂作用:
(2).与碱发生中和反应:
(3).与碱性氧化物反应:
(4).与盐反应:
1、硝酸的强酸性
—— 具有酸的某些通性
二、硝酸的化学性质
2、硝酸的强氧化性
二、硝酸的化学性质
【活动·探究2】铜、铝与浓硝酸反应
实验步骤:
1、将浓硝酸压入盛有铜片或铝片的注射器中,注意控制注射器活塞,观察。
2、实验结束后,将剩余浓硝酸推回原来的注射器,做到固液分离。
温馨提示:氮的氧化物有毒,此类实验都在注射器中完成
【问题组1】
①观察并描述现象。根据现象可以得到什么结论?试写出反应方程式
②在反应中浓硝酸起什么作用?
铜片
浓硝酸
2、硝酸的强氧化性
1)浓硝酸与金属反应:
①现象:
化学方程式:
Cu + HNO3(浓) ------
离子方程式:
以上反应体现了稀硝酸的 性和 性。
铜片溶解,有红棕色气体生成,溶液变绿
NO2
Cu2+
酸性 强氧化
铝和浓硝酸反应的现象?
②钝化:浓硝酸可以使 、 表面形成致密的 而钝化。钝化属于 变化。钝化体现了浓硝酸的 。
铝 铁
氧化膜
化学
强氧化性
2、硝酸的强氧化性
二、硝酸的化学性质
【活动·探究3】铜与稀硝酸反应
实验步骤:
1、将稀硝酸压入盛有铜片的注射器中,注意控制注射器活塞,观察。
2、一段时间后,将剩余稀硝酸推回原来的注射器,做到固液分离。
3、调节三通阀,关闭盛稀硝酸一测,将鼓入空气入,观察。
铜片
空气
稀硝酸
[问题组2]
① 观察并描述现象。根据现象可以得到什么结论?试写出反应方程式
② 在反应中稀硝酸起什么作用?
③ 预测铁与足量稀硝酸反应的产物,并完成化学方程式。
①现象:铜片溶解,有无色气泡生成,溶液变蓝
NO
Cu2+
2、硝酸的强氧化性
2)稀硝酸与金属反应:
化学方程式:Cu + HNO3(稀) ------
离子方程式:
[问题组2]
① 观察并描述现象。根据现象可以得到什么结论?试写出反应方程式
② 在反应中稀硝酸起什么作用?
③ 预测铁与足量稀硝酸反应的产物,并完成化学方程式。
2、硝酸的强氧化性
2)稀硝酸与金属反应:
②化学方程式:Fe + HNO3(稀,足) ------
离子方程式:
硝酸能与除 、 以外的大多数金属反应,还原产物与硝酸的 相关。
金 铂
浓度
D
3)与非金属反应(C、S、P等)
2、硝酸的强氧化性
【问题组3】
①描述碳与浓硝酸反应的实验现象。
②根据现象从氧化还原角度推测另一种产物是什么?试写出浓硝酸与炭粉反应方程式
③在反应中浓硝酸起什么作用?
C + HNO3(浓)---
该反应体现了浓硝酸的 性。
强氧化性
3)与非金属反应(C、S、P等)
C+4HNO3(浓) = 4NO2↑+CO2↑+2H2O
△
S+6HNO3(浓) = 6NO2↑+H2SO4 +2H2O
△
P+5HNO3(浓) = 5NO2↑+H3PO4+H2O
△
2、硝酸的强氧化性
2、硝酸的强氧化性
4)氧化某些还原性微粒:
【活动·探究4】根据所给试剂,你能设计几组实验证明稀硝酸氧化性
试剂:FeSO4溶液、KSCN溶液、稀硝酸、淀粉KI溶液
方案 现象 结论(离子方程式)
应体现了稀硝酸的 性和 性。
Fe2+、S2-,I-、SO32-等
酸性 强氧化性
D
3、硝酸的不稳定性
HNO3 ===== NO2↑
二、硝酸的化学性质
△或见光
硝酸分解产生的二氧化氮气体溶于硝酸中而使硝酸呈黄色。
【思考】为什么久置的浓硝酸会呈现黄色呢?
+ O2↑
+ H2O
4HNO3 ===== 4NO2↑ + O2↑ + 2H2O
△或见光
[问题组4]:
① 久置的浓硝酸为什么呈黄色?
②从氧化还原反应中化合价升降的角度预测另一种产物是什么?
③如何保存浓硝酸?
3、硝酸的不稳定性
二、硝酸的化学性质
如何保存硝酸?
棕色细口玻璃瓶、玻璃塞、阴凉、避光
4.用途
硝酸是一种重要的化工原料,可用于制造炸药、染料、塑料和硝酸盐等。
在实验室里,硝酸是一种重要的化学试剂。
三、人类活动对氮循环和环境的影响
【阅读】课本115-116页,人类活动对自然界氮循环和环境的影响
【问题组5】
1.活化氮的量大大增加原因?
2.含氮物质主要来源?
3.含氮物质对环境影响?
4.减少人类活动对氮循环和环境影响的措施有哪些?
三、人类活动对氮循环和环境的影响
1.含氮物质来源及对环境的影响
利
弊
②增强生态系统对含有氮元素的物质的吸收能力
①控制进入大气、土壤和水体中含有氮元素的物质的量
绿水青山就是金山银山
二、人类活动对氮循环和环境的影响
2.减少人类活动对氮循环和环境的影响措施
与还原性离子
硝酸
物理性质
化学性质
酸性
不稳定性
强氧化性
与金属铜
与单质碳
钝化
课堂小结:
作业:完成学案课后巩固部分
谢 谢
