3.3.1《氮的固定》教学课件(共24张PPT)-2025-2026学年鲁科版高中化学(2019)必修一
文档属性
| 名称 | 3.3.1《氮的固定》教学课件(共24张PPT)-2025-2026学年鲁科版高中化学(2019)必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 35.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-12 22:44:34 | ||
图片预览








文档简介
(共24张PPT)
第3章 物质的性质与转化
第3节 氮的循环
第一课时 氮的固定
氮是一种地球上含量丰富的元素,除了以游离态的形式存在与大气中外,还以化合态的形式存在于动植物、土壤和水体中。自然界中的氮元素在不停地循环着。正是由于存在着氮的循环、其他生命必需元素的循环以及水的循环,地球上的生命才能生机勃勃、生生不息。
学习目标
1.通过了解自然界中氮循环的基本过程,认识氮循环过程中的重要物质。
2. 知道氮气在一定条件下能够与氧气、氢气发生反应,了解氮的固定的相关知识。
3.通过实验探究和真实情境,了解氮气、一氧化氮和二氧化氮的性质,培养科学探究意识。
4.了解含氮物质的相互转化在生产、生活中的应用及对生态环境的影响,增强科学态度与社会责任。
课前调查
身边的含氮物质
雷雨发庄稼的反应原理
雷电看似可怕,容易引起火灾,但它却能够帮助庄家生长。我们知道植物生长旺盛需要氮肥,而当出现雷电时,空气中的N2就会与O2反应生成NO,之后NO又迅速变成NO2,当NO2溶入水时会生成HNO3,这样后HNO3会在土壤中的物质的作用下形成硝酸盐,NO3-被植物吸收,这样庄家就变得更茂盛了。
课前调查
合成氨工业
弗里茨·哈珀
1918年
博施
1931年
埃特尔
2007年
发明了N2和H2
直接合成氨的方法
改进了反应条件,实现
氨的规模化工业生产
发现了合成氨
的反应机理
课前调查
一个反应,三个诺奖
含氮物质对大气和环境的污染
课前调查
氨基酸
蛋白质
HNO3
NH3
NO
NO2
蛋白质
尿素
N2
NO3
-
NH3 NH4
+
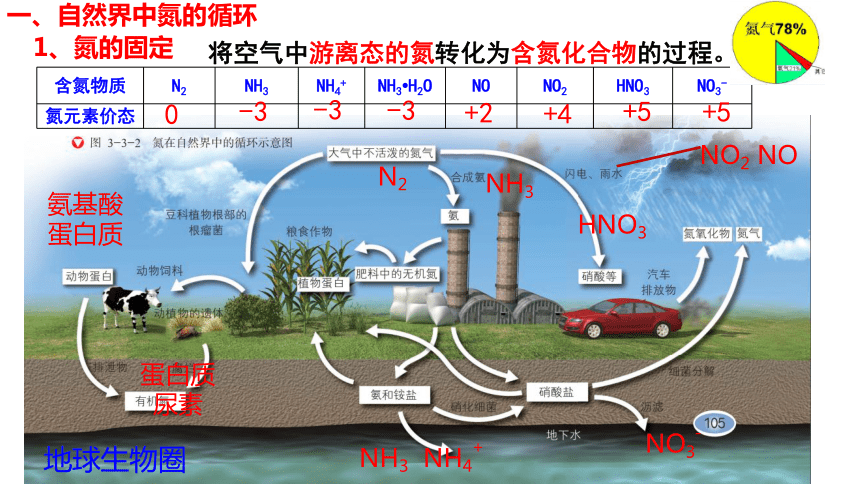
一、自然界中氮的循环
含氮物质 N2 NH3 NH4+ NH3 H2O NO NO2 HNO3 NO3-
氮元素价态
0
-3
-3
+2
-3
+5
+4
+5
地球生物圈
1、氮的固定
将空气中游离态的氮转化为含氮化合物的过程。
1、氮的固定
【问题组】
1、从N元素的循环图着手借助氮的价类二维图,寻找氮的固定的具体反应路径?
3、试从物质类别角度分析,N2可以与金属单质反应吗?体现了N2的什么性质?
2、请用化学方程式表示其中的关键步骤,并分析氮气在反应中体现的性质?
氨基酸
蛋白质
HNO3
NH3
NO
NO2
蛋白质
尿素
N2
NO3
-
NH3 NH4
+
一、自然界中氮的循环
生物固氮
人工固氮
闪电固氮
地球生物圈
模拟闪电固氮
放电
二、氮循环中物质的性质及物质之间的转化
NO的转化
① N2 + O2 === 2NO
②2NO + O2 ===2NO2
③3NO2 + H2O === 2HNO3+NO
NO2的转化
相关反应:
“雷雨发庄稼”
放电
1、高能固氮
NO NO2
物理性质 色味态
毒性
溶解性
密度
化学性质
无色、无味、气体 红棕色、刺激性气味、气体
难溶于水 易溶于水,与水反应
有毒 有毒
3NO2 + H2O = 2HNO3 + NO
2NO + O2 = 2NO2
略大于空气 大于空气
排水法
气体由无色变为红棕色
工业制硝酸
检验NO
2、NO和NO2的比较
排空气法
【提供资料】每年全球固氮生物可以固定大约2亿吨氮。闪电固定大约900万吨氮。直到20世纪初,细菌与闪电仍是仅有的两种生物体可以利用氮气的方法。富氮的肥料以及炸药的制作基本来源于鸟类粪便形成的矿物(鸟粪石),但供应相当紧张。科学家们开始担心农业生产无法满足迅速增长的世界人口对食物的需求,便采取了模仿自然固氮的方式:
制造或吸引闪电,如在农田上方立三根长杆,顶端装金属接闪器吸引闪电,改善收成。
此方法不提供图片
培养更多的固氮菌
氨基酸
蛋白质
HNO3
NH3
NO
NO2
蛋白质
尿素
N2
NO3
-
NH3 NH4
+
一、自然界中氮的循环
生物固氮
人工固氮
闪电固氮
工业合成氨
3、人工固氮
N2+3H2 2NH3
高温、高压
催化剂
氮气的性质
放电
N2+O2 2NO
氮气是无色、无味、难溶于水
(2)化学性质
1、氮气
(1)物理性质:
N2+3H2 2NH3
高温、高压
催化剂
N2 + 3Mg ===== Mg3N2
点燃
还原性
氧化性
氧化性
氨基酸
蛋白质
HNO3
NH3
NO
NO2
蛋白质
尿素
N2
NO3
-
NH3 NH4
+
一、自然界中氮的循环
生物固氮
人工固氮
闪电固氮
1、写出汽车尾气中产生NO的化学方程式:_______________________。
2、治理汽车尾气的一种方法是用催化剂使NO与CO发生反应产生两种无污染的气体,方程式为: 。
活动与探究
【问题组】
NO、NO2应用与危害
氧化物 应用 危害
NO 可作为传递神经的“信使分子”,具有扩展血管、提高免疫力、增强记忆力等作用 有毒,与血红蛋白结合能力强,容易造成人体缺氧
NO2 雷雨天气NO2与雨水形成的硝酸降落到地面,与土壤中矿物作用形成硝酸盐,促进植物生长 有毒,能使织物褪色,破坏多种织物和尼龙制品,对金属和非金属材料有腐蚀作用,还能够形成酸雨
NO + NO2 + 2NaOH ===== 2NaNO2 + H2O
通入NaOH溶液中?
2NO2 + 2NaOH ===== NaNO2 + NaNO3 + H2O
NO + NO2
NO2(歧化反应)
NO
与O2混合后再通入NaOH溶液
2NO2 + 2NaOH ===== NaNO2 + NaNO3 + H2O
3、实际工业生产中,如何对NO和NO2进行尾气处理?
常见的N的含氧酸有HNO3、HNO2,试分析以下表格中哪些是酸性氧化物?
氮的氧化物 N2O(笑气) NO N2O3 NO2 N2O4 N2O5
氮元素化合价
混合气体(1:1的比例)
4、NO2与NO的尾气回收
氨基酸
蛋白质
HNO3
NH3
NO
NO2
蛋白质
尿素
N2
NO3
-
NH3 NH4
+
一、自然界中氮的循环
地球生物圈
3.(2023·济宁高一期中)一定条件下,含氮元素的物质可发生如图所示的循环转化。下列说法正确的是 ( )
A.循环转化中属于“固氮”过程的是“反应c”和“反应b”
B.转化过程中发生非氧化还原反应的过程只有“反应l”
C.若“反应h”是在NO2与H2O的作用下实现的,则该反应中氧化产物与还原产物的物质的量之比为2∶1
D.工业上可以用氢氧化钠溶液吸收NO2
作业:
1、课后巩固区完成。
2、同步122页学习理解,123页应用实践。
3、查阅有关资料,进一步了解氮氧化合物的功与过、如何减少氮氧化合物的排放和治理措施。
第3章 物质的性质与转化
第3节 氮的循环
第一课时 氮的固定
氮是一种地球上含量丰富的元素,除了以游离态的形式存在与大气中外,还以化合态的形式存在于动植物、土壤和水体中。自然界中的氮元素在不停地循环着。正是由于存在着氮的循环、其他生命必需元素的循环以及水的循环,地球上的生命才能生机勃勃、生生不息。
学习目标
1.通过了解自然界中氮循环的基本过程,认识氮循环过程中的重要物质。
2. 知道氮气在一定条件下能够与氧气、氢气发生反应,了解氮的固定的相关知识。
3.通过实验探究和真实情境,了解氮气、一氧化氮和二氧化氮的性质,培养科学探究意识。
4.了解含氮物质的相互转化在生产、生活中的应用及对生态环境的影响,增强科学态度与社会责任。
课前调查
身边的含氮物质
雷雨发庄稼的反应原理
雷电看似可怕,容易引起火灾,但它却能够帮助庄家生长。我们知道植物生长旺盛需要氮肥,而当出现雷电时,空气中的N2就会与O2反应生成NO,之后NO又迅速变成NO2,当NO2溶入水时会生成HNO3,这样后HNO3会在土壤中的物质的作用下形成硝酸盐,NO3-被植物吸收,这样庄家就变得更茂盛了。
课前调查
合成氨工业
弗里茨·哈珀
1918年
博施
1931年
埃特尔
2007年
发明了N2和H2
直接合成氨的方法
改进了反应条件,实现
氨的规模化工业生产
发现了合成氨
的反应机理
课前调查
一个反应,三个诺奖
含氮物质对大气和环境的污染
课前调查
氨基酸
蛋白质
HNO3
NH3
NO
NO2
蛋白质
尿素
N2
NO3
-
NH3 NH4
+
一、自然界中氮的循环
含氮物质 N2 NH3 NH4+ NH3 H2O NO NO2 HNO3 NO3-
氮元素价态
0
-3
-3
+2
-3
+5
+4
+5
地球生物圈
1、氮的固定
将空气中游离态的氮转化为含氮化合物的过程。
1、氮的固定
【问题组】
1、从N元素的循环图着手借助氮的价类二维图,寻找氮的固定的具体反应路径?
3、试从物质类别角度分析,N2可以与金属单质反应吗?体现了N2的什么性质?
2、请用化学方程式表示其中的关键步骤,并分析氮气在反应中体现的性质?
氨基酸
蛋白质
HNO3
NH3
NO
NO2
蛋白质
尿素
N2
NO3
-
NH3 NH4
+
一、自然界中氮的循环
生物固氮
人工固氮
闪电固氮
地球生物圈
模拟闪电固氮
放电
二、氮循环中物质的性质及物质之间的转化
NO的转化
① N2 + O2 === 2NO
②2NO + O2 ===2NO2
③3NO2 + H2O === 2HNO3+NO
NO2的转化
相关反应:
“雷雨发庄稼”
放电
1、高能固氮
NO NO2
物理性质 色味态
毒性
溶解性
密度
化学性质
无色、无味、气体 红棕色、刺激性气味、气体
难溶于水 易溶于水,与水反应
有毒 有毒
3NO2 + H2O = 2HNO3 + NO
2NO + O2 = 2NO2
略大于空气 大于空气
排水法
气体由无色变为红棕色
工业制硝酸
检验NO
2、NO和NO2的比较
排空气法
【提供资料】每年全球固氮生物可以固定大约2亿吨氮。闪电固定大约900万吨氮。直到20世纪初,细菌与闪电仍是仅有的两种生物体可以利用氮气的方法。富氮的肥料以及炸药的制作基本来源于鸟类粪便形成的矿物(鸟粪石),但供应相当紧张。科学家们开始担心农业生产无法满足迅速增长的世界人口对食物的需求,便采取了模仿自然固氮的方式:
制造或吸引闪电,如在农田上方立三根长杆,顶端装金属接闪器吸引闪电,改善收成。
此方法不提供图片
培养更多的固氮菌
氨基酸
蛋白质
HNO3
NH3
NO
NO2
蛋白质
尿素
N2
NO3
-
NH3 NH4
+
一、自然界中氮的循环
生物固氮
人工固氮
闪电固氮
工业合成氨
3、人工固氮
N2+3H2 2NH3
高温、高压
催化剂
氮气的性质
放电
N2+O2 2NO
氮气是无色、无味、难溶于水
(2)化学性质
1、氮气
(1)物理性质:
N2+3H2 2NH3
高温、高压
催化剂
N2 + 3Mg ===== Mg3N2
点燃
还原性
氧化性
氧化性
氨基酸
蛋白质
HNO3
NH3
NO
NO2
蛋白质
尿素
N2
NO3
-
NH3 NH4
+
一、自然界中氮的循环
生物固氮
人工固氮
闪电固氮
1、写出汽车尾气中产生NO的化学方程式:_______________________。
2、治理汽车尾气的一种方法是用催化剂使NO与CO发生反应产生两种无污染的气体,方程式为: 。
活动与探究
【问题组】
NO、NO2应用与危害
氧化物 应用 危害
NO 可作为传递神经的“信使分子”,具有扩展血管、提高免疫力、增强记忆力等作用 有毒,与血红蛋白结合能力强,容易造成人体缺氧
NO2 雷雨天气NO2与雨水形成的硝酸降落到地面,与土壤中矿物作用形成硝酸盐,促进植物生长 有毒,能使织物褪色,破坏多种织物和尼龙制品,对金属和非金属材料有腐蚀作用,还能够形成酸雨
NO + NO2 + 2NaOH ===== 2NaNO2 + H2O
通入NaOH溶液中?
2NO2 + 2NaOH ===== NaNO2 + NaNO3 + H2O
NO + NO2
NO2(歧化反应)
NO
与O2混合后再通入NaOH溶液
2NO2 + 2NaOH ===== NaNO2 + NaNO3 + H2O
3、实际工业生产中,如何对NO和NO2进行尾气处理?
常见的N的含氧酸有HNO3、HNO2,试分析以下表格中哪些是酸性氧化物?
氮的氧化物 N2O(笑气) NO N2O3 NO2 N2O4 N2O5
氮元素化合价
混合气体(1:1的比例)
4、NO2与NO的尾气回收
氨基酸
蛋白质
HNO3
NH3
NO
NO2
蛋白质
尿素
N2
NO3
-
NH3 NH4
+
一、自然界中氮的循环
地球生物圈
3.(2023·济宁高一期中)一定条件下,含氮元素的物质可发生如图所示的循环转化。下列说法正确的是 ( )
A.循环转化中属于“固氮”过程的是“反应c”和“反应b”
B.转化过程中发生非氧化还原反应的过程只有“反应l”
C.若“反应h”是在NO2与H2O的作用下实现的,则该反应中氧化产物与还原产物的物质的量之比为2∶1
D.工业上可以用氢氧化钠溶液吸收NO2
作业:
1、课后巩固区完成。
2、同步122页学习理解,123页应用实践。
3、查阅有关资料,进一步了解氮氧化合物的功与过、如何减少氮氧化合物的排放和治理措施。
