3.1《铁的多样性(1)铁盐和亚铁盐-“铁剑”文物的腐蚀与防护》教学课件(共17张PPT)-2025-2026学年鲁科版高中化学(2019)必修一
文档属性
| 名称 | 3.1《铁的多样性(1)铁盐和亚铁盐-“铁剑”文物的腐蚀与防护》教学课件(共17张PPT)-2025-2026学年鲁科版高中化学(2019)必修一 |

|
|
| 格式 | pptx | ||
| 文件大小 | 40.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-12 22:50:39 | ||
图片预览






文档简介
(共17张PPT)
“铁剑”的腐蚀产物是什么?
“铁剑”的腐蚀机理是什么?为什么“铁剑”一旦腐蚀,腐蚀层会越变越厚?
“铁剑”可采用哪些方法进行修复和防护?
第二课时:铁剑的“今生”
铁剑文物的腐蚀与防护
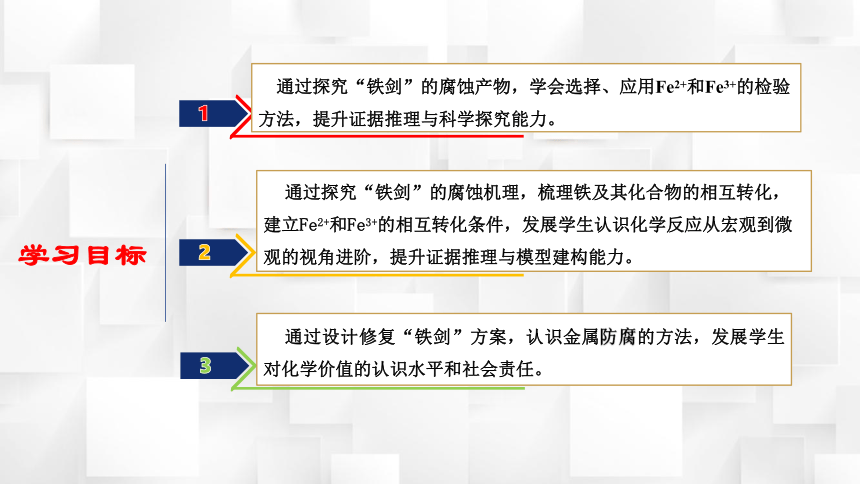
学习目标
文本
1
文本
2
文本
3
通过探究“铁剑”的腐蚀产物,学会选择、应用Fe2+和Fe3+的检验方法,提升证据推理与科学探究能力。
通过探究“铁剑”的腐蚀机理,梳理铁及其化合物的相互转化,建立Fe2+和Fe3+的相互转化条件,发展学生认识化学反应从宏观到微观的视角进阶,提升证据推理与模型建构能力。
通过设计修复“铁剑”方案,认识金属防腐的方法,发展学生对化学价值的认识水平和社会责任。
知 识 回 顾
画出铁及其氧化物、氢氧化物的转化关系,并标明转化所需试剂
单质
氧化物
盐
碱
0
+2
+3
物质类别
化合价
Fe
FeO
Fe2O3
Fe3O4
FeCl2
FeCl3
Fe(OH)2
Fe(OH)3
1
上承氧化还原反应、下启元素周期律
巩固认识物质性质的基本思路
任务一:探究“铁剑”腐蚀产物,从类别角度认识铁盐
铁锈的主要成分是Fe2O3
【提出问题】 铁剑的腐蚀产物是什么?
【设计方案】
设计尽可能多的方案证明你的预测,从物质类别和性质角度出发。
知识支持:
1. Fe3+的盐溶液遇到KSCN(硫氰酸钾)溶液时变红色,Fe2+的盐溶液遇KSCN溶液时不变色。
2. Fe3+的盐溶液遇到K3[Fe(CN)3](铁氰化钾) 溶液时无变化,Fe2+的盐溶液遇K3[Fe(CN)3]溶液时产生蓝色沉淀。
1
上承氧化还原反应、下启元素周期律
巩固认识物质性质的基本思路
【实验验证】
1. 用镊子取几块铁锈于试管中,加入2滴管稀硫酸后,观察溶液颜色。
2. 用胶头滴管取少量上层清液,分别滴入井穴板1、2、3号井中。
3. 向1号井中加入NaOH溶液,观察现象;
向2号井中加入2滴KSCN溶液,观察现象;
向3号井中加入2滴K3[Fe(CN)3] 溶液,观察现象
得出结论
井穴板
任务一:探究“铁剑”腐蚀产物,从类别角度认识铁盐
1
上承氧化还原反应、下启元素周期律
巩固认识物质性质的基本思路
Fe2+、Fe3+的检验方法
Fe2+ Fe3+
特效检测剂
直接观察法
NaOH沉淀法
KSCN溶液
K3[Fe(CN)3] 溶液
白色沉淀迅速变为灰绿色,最后变为红褐色
红褐色沉淀
浅绿色
黄色
红色
蓝色沉淀
任务一:探究“铁剑”腐蚀产物,从类别角度认识铁盐
上承氧化还原反应、下启元素周期律
巩固认识物质性质的基本思路
【提出问题】 从价类二维角度思考,微观上Fe→ Fe2O3的过程经历了怎样的转化路径?
【阅读资料】“铁剑”生锈的化学反应主要可以分为两个步骤:
(1)铁和水(湿气)的反应:当空气中的O2溶解在水里时,铁与O2在有水的环境生成Fe(OH)2。
(2)生成的Fe(OH)2和空气中的氧气继续化合,一段时间生成铁锈。
Fe
Fe2+
H2O
O2
OH-
H2O
Fe(OH)2
Fe(OH)3
Fe2O3
任务二:探究“铁剑”腐蚀原理,从价态角度认识铁盐
2
上承氧化还原反应、下启元素周期律
巩固认识物质性质的基本思路
【设计方案】 请结合物质性质设计实验进行验证
【实验验证】向铁板上滴加2滴酚酞、K3[Fe(CN)6]和NaCl的混合溶液,观察实验现象(注意中心和边缘的变化)。
任务二:探究“铁剑”腐蚀原理,从价态角度认识铁盐
2
上承氧化还原反应、下启元素周期律
巩固认识物质性质的基本思路
【得出结论】铁剑腐蚀原理
Fe
Fe2+
H2O
O2
OH-
H2O
Fe(OH)2
Fe(OH)3
Fe2O3
OH-
Fe3+
O2
【问题】
从价态、类别角度思考,还有什么路径可以实现Fe2+→Fe(OH)3的转化?
任务二:探究“铁剑”腐蚀原理,从价态角度认识铁盐
2
2
【实验验证】
1. 向FeSO4溶液中滴加KMnO4溶液,观察现象
2. 向FeSO4溶液中滴加1滴KSCN溶液,再滴加H2O2溶液,观察现象
3. FeCl3溶液中加入铁粉,滴加1滴KSCN溶液
4. FeCl3溶液中加入铜粉,滴加1滴KSCN溶液
Fe2+
Fe3+
加氧化剂
加还原剂
【符号表征】写出反应对应的离子方程式
任务二:探究“铁剑”腐蚀原理,从价态角度认识铁盐
2
Fe2+
Fe3+
加氧化剂(如O2、氯水、KMnO4、H2O2等)
加还原剂(如铁粉、铜粉等)
Fe
氧化剂(如H+、Cu2+等)
氧化剂(如氯气等)
?
?
还原剂(如锌粉、镁粉等)
任务二:探究“铁剑”腐蚀原理,从价态角度认识铁盐
3
【交流讨论】
铁生锈后体积会膨胀到原来的8倍左右,且锈层疏松多孔,就像海绵一样,因此铁一旦被腐蚀,腐蚀面会越变越大,腐蚀层会越变越厚,感觉像被传染了一样。为什么?
【思考】腐蚀后的“铁剑”文物,我们如何修复并进行防护,才能使其重
新焕发光彩,恢复其历史价值和文化价值?
打蜡、
研磨 抛光除锈、
密封……
任务三:探究 “铁剑” 修复防护,价类二维保护“铁剑”
3
任务三:探究 “铁剑” 修复防护,价类二维保护“铁剑”
“铁剑”文物的腐蚀与防护
“铁剑”腐蚀产物是什么?
探究“铁剑”腐蚀产物
类别视角认识铁盐,学会Fe2+ 、Fe3+检验
“铁剑”为什么被腐蚀的?
探究“铁剑”腐蚀原理
价类二维视角认识铁盐,学会应用Fe2+、 Fe3+的相互转化
“铁剑”腐蚀如何修复?
探究“铁剑”文物修复及防护
学会应用价类模型,进行金属防护
问 题
活 动
知 识 能 力
素 养
实验探究
证据推理
模型建构
宏微结合社会责任
课 堂 总 结
查阅资料,了解铁器腐蚀的影响因素及如何影响,书写小论文。
作 业 布 置
文物承载灿烂文明,传承历史文化,维系民族精神,是老祖宗留给我们的宝贵遗产。
化学给了我们知识,文物给了我们智慧。我们要学会用化学知识守护中华文脉,让文物活起来,把文化传下去。
“铁剑”的腐蚀产物是什么?
“铁剑”的腐蚀机理是什么?为什么“铁剑”一旦腐蚀,腐蚀层会越变越厚?
“铁剑”可采用哪些方法进行修复和防护?
第二课时:铁剑的“今生”
铁剑文物的腐蚀与防护
学习目标
文本
1
文本
2
文本
3
通过探究“铁剑”的腐蚀产物,学会选择、应用Fe2+和Fe3+的检验方法,提升证据推理与科学探究能力。
通过探究“铁剑”的腐蚀机理,梳理铁及其化合物的相互转化,建立Fe2+和Fe3+的相互转化条件,发展学生认识化学反应从宏观到微观的视角进阶,提升证据推理与模型建构能力。
通过设计修复“铁剑”方案,认识金属防腐的方法,发展学生对化学价值的认识水平和社会责任。
知 识 回 顾
画出铁及其氧化物、氢氧化物的转化关系,并标明转化所需试剂
单质
氧化物
盐
碱
0
+2
+3
物质类别
化合价
Fe
FeO
Fe2O3
Fe3O4
FeCl2
FeCl3
Fe(OH)2
Fe(OH)3
1
上承氧化还原反应、下启元素周期律
巩固认识物质性质的基本思路
任务一:探究“铁剑”腐蚀产物,从类别角度认识铁盐
铁锈的主要成分是Fe2O3
【提出问题】 铁剑的腐蚀产物是什么?
【设计方案】
设计尽可能多的方案证明你的预测,从物质类别和性质角度出发。
知识支持:
1. Fe3+的盐溶液遇到KSCN(硫氰酸钾)溶液时变红色,Fe2+的盐溶液遇KSCN溶液时不变色。
2. Fe3+的盐溶液遇到K3[Fe(CN)3](铁氰化钾) 溶液时无变化,Fe2+的盐溶液遇K3[Fe(CN)3]溶液时产生蓝色沉淀。
1
上承氧化还原反应、下启元素周期律
巩固认识物质性质的基本思路
【实验验证】
1. 用镊子取几块铁锈于试管中,加入2滴管稀硫酸后,观察溶液颜色。
2. 用胶头滴管取少量上层清液,分别滴入井穴板1、2、3号井中。
3. 向1号井中加入NaOH溶液,观察现象;
向2号井中加入2滴KSCN溶液,观察现象;
向3号井中加入2滴K3[Fe(CN)3] 溶液,观察现象
得出结论
井穴板
任务一:探究“铁剑”腐蚀产物,从类别角度认识铁盐
1
上承氧化还原反应、下启元素周期律
巩固认识物质性质的基本思路
Fe2+、Fe3+的检验方法
Fe2+ Fe3+
特效检测剂
直接观察法
NaOH沉淀法
KSCN溶液
K3[Fe(CN)3] 溶液
白色沉淀迅速变为灰绿色,最后变为红褐色
红褐色沉淀
浅绿色
黄色
红色
蓝色沉淀
任务一:探究“铁剑”腐蚀产物,从类别角度认识铁盐
上承氧化还原反应、下启元素周期律
巩固认识物质性质的基本思路
【提出问题】 从价类二维角度思考,微观上Fe→ Fe2O3的过程经历了怎样的转化路径?
【阅读资料】“铁剑”生锈的化学反应主要可以分为两个步骤:
(1)铁和水(湿气)的反应:当空气中的O2溶解在水里时,铁与O2在有水的环境生成Fe(OH)2。
(2)生成的Fe(OH)2和空气中的氧气继续化合,一段时间生成铁锈。
Fe
Fe2+
H2O
O2
OH-
H2O
Fe(OH)2
Fe(OH)3
Fe2O3
任务二:探究“铁剑”腐蚀原理,从价态角度认识铁盐
2
上承氧化还原反应、下启元素周期律
巩固认识物质性质的基本思路
【设计方案】 请结合物质性质设计实验进行验证
【实验验证】向铁板上滴加2滴酚酞、K3[Fe(CN)6]和NaCl的混合溶液,观察实验现象(注意中心和边缘的变化)。
任务二:探究“铁剑”腐蚀原理,从价态角度认识铁盐
2
上承氧化还原反应、下启元素周期律
巩固认识物质性质的基本思路
【得出结论】铁剑腐蚀原理
Fe
Fe2+
H2O
O2
OH-
H2O
Fe(OH)2
Fe(OH)3
Fe2O3
OH-
Fe3+
O2
【问题】
从价态、类别角度思考,还有什么路径可以实现Fe2+→Fe(OH)3的转化?
任务二:探究“铁剑”腐蚀原理,从价态角度认识铁盐
2
2
【实验验证】
1. 向FeSO4溶液中滴加KMnO4溶液,观察现象
2. 向FeSO4溶液中滴加1滴KSCN溶液,再滴加H2O2溶液,观察现象
3. FeCl3溶液中加入铁粉,滴加1滴KSCN溶液
4. FeCl3溶液中加入铜粉,滴加1滴KSCN溶液
Fe2+
Fe3+
加氧化剂
加还原剂
【符号表征】写出反应对应的离子方程式
任务二:探究“铁剑”腐蚀原理,从价态角度认识铁盐
2
Fe2+
Fe3+
加氧化剂(如O2、氯水、KMnO4、H2O2等)
加还原剂(如铁粉、铜粉等)
Fe
氧化剂(如H+、Cu2+等)
氧化剂(如氯气等)
?
?
还原剂(如锌粉、镁粉等)
任务二:探究“铁剑”腐蚀原理,从价态角度认识铁盐
3
【交流讨论】
铁生锈后体积会膨胀到原来的8倍左右,且锈层疏松多孔,就像海绵一样,因此铁一旦被腐蚀,腐蚀面会越变越大,腐蚀层会越变越厚,感觉像被传染了一样。为什么?
【思考】腐蚀后的“铁剑”文物,我们如何修复并进行防护,才能使其重
新焕发光彩,恢复其历史价值和文化价值?
打蜡、
研磨 抛光除锈、
密封……
任务三:探究 “铁剑” 修复防护,价类二维保护“铁剑”
3
任务三:探究 “铁剑” 修复防护,价类二维保护“铁剑”
“铁剑”文物的腐蚀与防护
“铁剑”腐蚀产物是什么?
探究“铁剑”腐蚀产物
类别视角认识铁盐,学会Fe2+ 、Fe3+检验
“铁剑”为什么被腐蚀的?
探究“铁剑”腐蚀原理
价类二维视角认识铁盐,学会应用Fe2+、 Fe3+的相互转化
“铁剑”腐蚀如何修复?
探究“铁剑”文物修复及防护
学会应用价类模型,进行金属防护
问 题
活 动
知 识 能 力
素 养
实验探究
证据推理
模型建构
宏微结合社会责任
课 堂 总 结
查阅资料,了解铁器腐蚀的影响因素及如何影响,书写小论文。
作 业 布 置
文物承载灿烂文明,传承历史文化,维系民族精神,是老祖宗留给我们的宝贵遗产。
化学给了我们知识,文物给了我们智慧。我们要学会用化学知识守护中华文脉,让文物活起来,把文化传下去。
