拉分题7 实验操作 实验证据与推理(含解析)高一化学苏教版(2019)必修1 复习教案
文档属性
| 名称 | 拉分题7 实验操作 实验证据与推理(含解析)高一化学苏教版(2019)必修1 复习教案 |  | |
| 格式 | doc | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-15 10:37:24 | ||
图片预览


文档简介
eq \o(\s\up7(拉分点1 实验操作与实验装置图),\s\do5())
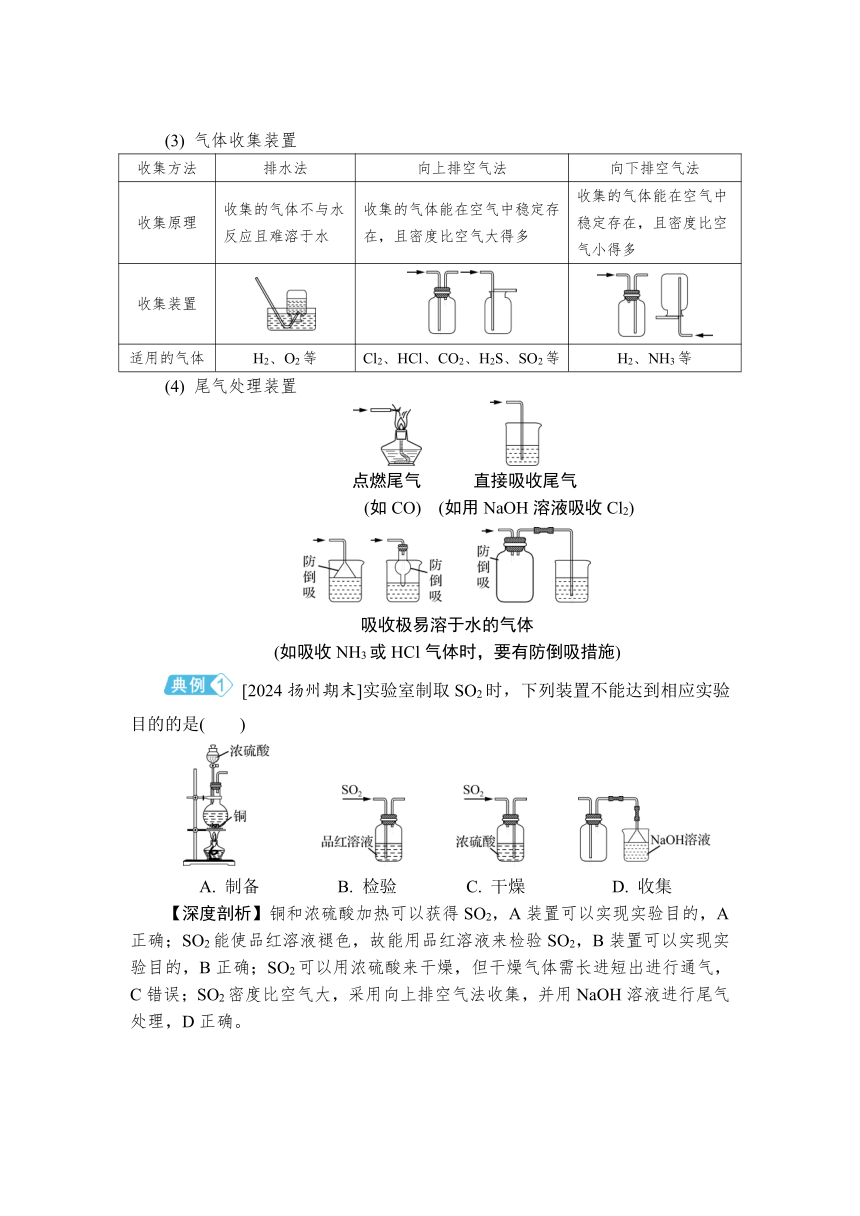
得分策略 熟悉SO2、CO2、Cl2、H2、O2等气体制备,包含发生、除杂、收集、尾气处理等环节。
(1) 气体发生装置
装置类型 装置图 适用气体 常见错误
固-固加热型 O2、NH3等 ①原料只用NH4Cl;②试管口应略向下倾斜
固-液加热型(或液-液加热型) Cl2等 ①加热烧瓶时要垫陶土网;②常会遗忘加热操作;③原料错用稀盐酸
固-液不加热型 O2、H2、CO2、SO2等 ①使用长颈漏斗时,要使漏斗下端伸入液面以下;②第一个装置只适用于块状固体和液体反应,常错用粉末状反应物,如MnO2等
(2) 气体净化装置
干燥装置 除杂装置
干燥剂:浓硫酸 干燥剂:P2O5(酸性)、无水氯化钙(中性) 干燥剂:碱石灰(碱性) 杂质 除杂试剂 杂质 除杂试剂
HCl 饱和食盐水 O2 灼热铜网
不可干燥:NH3、H2S、HBr、HI等 不可干燥:NH3 不可干燥:Cl2、H2S、HCl、SO2、CO2等 SO2 酸性KMnO4溶液等 H2或CO 灼热CuO
(3) 气体收集装置
收集方法 排水法 向上排空气法 向下排空气法
收集原理 收集的气体不与水反应且难溶于水 收集的气体能在空气中稳定存在,且密度比空气大得多 收集的气体能在空气中稳定存在,且密度比空气小得多
收集装置
适用的气体 H2、O2等 Cl2、HCl、CO2、H2S、SO2等 H2、NH3等
(4) 尾气处理装置
点燃尾气 直接吸收尾气
(如CO) (如用NaOH溶液吸收Cl2)
吸收极易溶于水的气体
(如吸收NH3或HCl气体时,要有防倒吸措施)
[2024扬州期末]实验室制取SO2时,下列装置不能达到相应实验目的的是( )
A. 制备 B. 检验 C. 干燥 D. 收集
【深度剖析】铜和浓硫酸加热可以获得SO2,A装置可以实现实验目的,A正确;SO2能使品红溶液褪色,故能用品红溶液来检验SO2,B装置可以实现实验目的,B正确;SO2可以用浓硫酸来干燥,但干燥气体需长进短出进行通气,C错误;SO2密度比空气大,采用向上排空气法收集,并用NaOH溶液进行尾气处理,D正确。
eq \o(\s\up7(拉分点2 物质检验类题型的推理),\s\do5())
得分策略 物质检验一般根据被检验物质的性质,采用能与其产生特殊现象的试剂,找出其他会产生类似现象的物质,设计实验排除其干扰。
实验操作及现象 实验结论 判断 解释
①用铂丝蘸取某溶液进行焰色反应,火焰呈黄色 一定是钠盐溶液,该溶液中一定不含K+ 错误 NaOH溶液干扰,检验K元素时,要透过蓝色钴玻璃观察
②将某气体通入品红溶液中,品红溶液褪色 该气体一定是SO2 错误 O3、Cl2等具有强氧化性的气体也能使品红溶液褪色
③向0.1 mol/L H2O2溶液中滴加0.01 mol/L KMnO4溶液,溶液褪色 H2O2具有氧化性 错误 高锰酸钾表现氧化性,H2O2表现还原性
①焰色反应显黄色,不一定是钠盐,还可能是碱(NaOH);②检验SO时,要先加盐酸酸化,再滴加BaCl2溶液。
eq \o(\s\up7(拉分点3 比较类题型的推理),\s\do5())
得分策略 比较类题型,确定比较点,同时要控制其他变量保持不变,如比较反应温度,就要控制反应物浓度、量等变量,这是变量控制。
探究方案 探究目的 判断 解释
向Na2CO3溶液中加入冰醋酸,将产生的气体直接通入苯酚钠溶液中,溶液变浑浊 酸性:醋酸>碳酸>苯酚 错误 挥发出来的CH3COOH也能使苯酚钠溶液变浑浊
向NaBr溶液中滴加过量氯水,再加入淀粉-KI溶液;溶液先变橙色后变蓝色 氧化性:Cl2>Br2>I2 错误 氯水过量,会继续氧化碘离子为碘单质
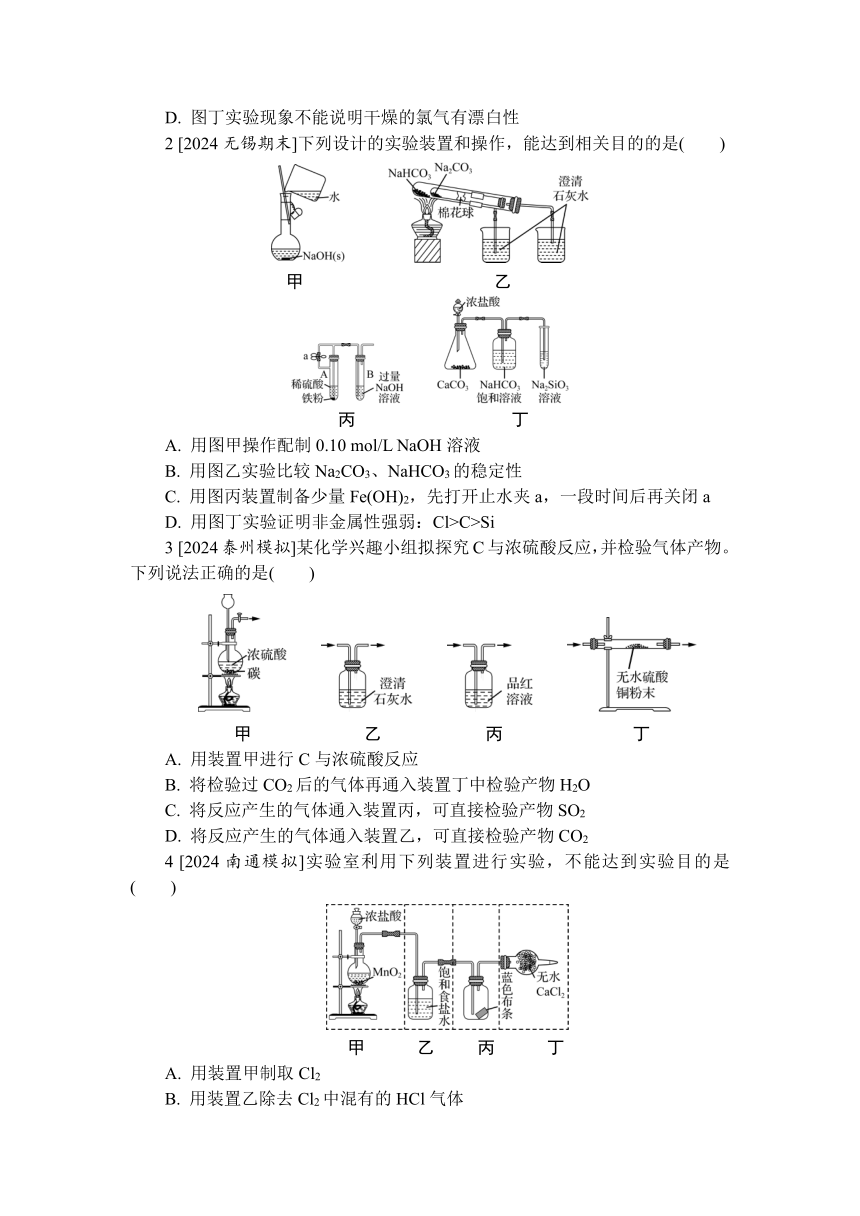
1 [2024无锡期末]下列实验可用来制备并检验Cl2的性质。下列说法正确的是( )
甲 乙 丙 丁
A. 图甲实验收集到的Cl2中只含有HCl一种杂质
B. 图乙实验可用于测定氯水的pH
C. 图丙实验中产生了棕黄色的雾
D. 图丁实验现象不能说明干燥的氯气有漂白性
2 [2024无锡期末]下列设计的实验装置和操作,能达到相关目的的是( )
甲 乙
甲 乙
INCLUDEPICTURE "24NTHBSL115.TIF"
丙 丁
A. 用图甲操作配制0.10 mol/L NaOH溶液
B. 用图乙实验比较Na2CO3、NaHCO3的稳定性
C. 用图丙装置制备少量Fe(OH)2,先打开止水夹a,一段时间后再关闭a
D. 用图丁实验证明非金属性强弱:Cl>C>Si
3 [2024泰州模拟]某化学兴趣小组拟探究C与浓硫酸反应,并检验气体产物。下列说法正确的是( )
甲 乙 丙 丁
A. 用装置甲进行C与浓硫酸反应
B. 将检验过CO2后的气体再通入装置丁中检验产物H2O
C. 将反应产生的气体通入装置丙,可直接检验产物SO2
D. 将反应产生的气体通入装置乙,可直接检验产物CO2
4 [2024南通模拟]实验室利用下列装置进行实验,不能达到实验目的是( )
甲 乙 丙 丁
A. 用装置甲制取Cl2
B. 用装置乙除去Cl2中混有的HCl气体
C. 用装置丙验证潮湿的Cl2具有漂白性
D. 用装置丁吸收尾气中的Cl2
5 下列制取SO2、验证其漂白性、收集并进行尾气处理的装置和原理能达到实验目的的是( )
A. 制取SO2 B. 验证漂白性 C. 收集SO2 D. 尾气处理
6 [2024淮安期中]室温下进行下列实验,根据实验操作和现象所得到的结论正确的是( )
选项 实验操作和现象 结论
A 向某溶液中滴加BaCl2溶液,有白色沉淀生成,再滴加稀盐酸,沉淀不溶解 则原溶液中一定含SO
B 用洁净的铂丝蘸取某溶液进行焰色反应,透过蓝色钴玻璃观察,火焰呈紫色 溶液中含K+
C 向新制氯水中滴加几滴紫色石蕊试液,溶液先变红后褪色 Cl2具有漂白性
D 向NaBr溶液中滴加过量氯水,再加入淀粉-KI溶液;溶液先变橙色后变蓝色 氧化性:Cl2>Br2>I2
7 [2024扬州期末]下列实验操作能达到实验目的的是( )
选项 实验目的 实验操作
A 检验溶液中的Cl- 向溶液中先加盐酸,再加AgNO3溶液
B 干燥Cl2 将气体通过盛有浓硫酸的洗气瓶
C 吸收尾气中的Cl2 将气体通入盛有饱和食盐水的烧杯
D 测定氯水的pH 将氯水滴在pH试纸上,与标准比色卡对照
8 室温下,下列实验探究方案能达到探究目的的是( )
选项 探究方案 探究目的
A 向0.1 mol/L H2O2溶液中滴加0.1 mol/L KMnO4溶液,观察溶液颜色变化 H2O2具有氧化性
B 向盛有SO2水溶液的试管中滴加几滴品红溶液,振荡,加热试管,观察溶液颜色变化 SO2具有还原性
C 向盛有淀粉KI溶液的试管中滴加几滴溴水,振荡,观察溶液颜色变化 Br2的氧化性比I2的强
D 向2 mL Na2SO3溶液中滴加几滴Na2S溶液,观察沉淀生成情况 SO具有氧化性
9 室温下,下列实验方案能达到探究目的的是( )
选项 实验方案 探究目的
A 向KBr、KI混合溶液中依次加入少量氯水和CCl4,振荡后静置,观察CCl4层颜色 氧化性:Cl2>Br2>I2
B 向溶液X中加入盐酸,将产生的气体通入品红溶液中,观察溶液颜色变化 溶液X中是否含有SO或HSO
C 测定浓度均为0.1 mol/L CH3COOH、NH3·H2O溶液的pH CH3COOH和NH3·H2O的电离能力
D 向过氧化氢和氯化钡混合液中滴加亚硫酸钠溶液,观察是否产生沉淀 探究过氧化氢能否将亚硫酸盐氧化
10 室温下,探究0.1 mol/L NaHCO3溶液的性质。下列实验方案能达到探究目的的是( )
选项 探究目的 实验方案
A HCO是否发生电离 向2 mL 0.1 mol/L NaHCO3溶液中加入一小块钠,观察溶液中是否有气泡产生
B 溶液是否存在大量OH- 用干燥洁净玻璃棒蘸取0.1 mol/L NaHCO3溶液,点在干燥的pH试纸上,测出溶液的pH
C 溶液中是否存在Na+ 取一支洁净的铂丝,蘸取0.1 mol/L NaHCO3溶液后在煤气灯上灼烧,透过蓝色钴玻璃观察火焰颜色
D 溶液中是否存在CO 向2 mL 0.1 mol/L NaHCO3溶液中滴入几滴澄清石灰水,观察溶液是否变浑浊
【巩固强化】
1 D 图甲实验收集到的Cl2中含有HCl、水蒸气,A错误;氯水中含有次氯酸,次氯酸具有漂白性,不能用pH试纸测氯水的pH,B错误;图丙实验中生成氯化铜,现象为产生了棕黄色的烟,C错误;鲜花中含有水,氯气和水反应生成具有漂白性的次氯酸,鲜花褪色,不能说明干燥的氯气有漂白性,D正确。
2 C 不能在容量瓶中溶解氢氧化钠固体,A错误;套管实验,加热时大试管温度高,小试管温度低,温度高分解不能说明稳定性差,应反过来放置,B错误;稀硫酸与铁粉反应生成硫酸亚铁与氢气,氢气能排除装置中的空气,一段时间后关闭a,利用气体压强变大将硫酸亚铁溶液排到氢氧化钠溶液中,反应得到Fe(OH)2沉淀,C正确;盐酸为无氧酸,无法比较元素的非金属性强弱,D错误。
3 C 产生的气体从长颈漏斗逸出,应该使用分液漏斗,A错误;由于气体要通入其他溶液,所以应最先检验水,B错误;SO2可以使品红褪色,可以用装置丙直接检验产物SO2,C正确;SO2和CO2均可使澄清石灰水变浑浊,应除去二氧化硫后再用装置乙检验二氧化碳,D错误。
4 D 实验室用浓盐酸和二氧化锰加热制取氯气,A正确;用饱和食盐水除去Cl2中混有的HCl气体,B正确;氯气和水反应生成的次氯酸有漂白性,用装置丙可以验证潮湿的Cl2具有漂白性,C正确;氯化钙作干燥剂,不与氯气反应,不可以处理尾气,D错误。
5 B 稀硫酸与铜共热不能生成SO2,要用浓硫酸和铜在加热条件下反应制取SO2,A错误;用品红溶液验证SO2的漂白性,B正确;SO2的密度大于空气的密度,用向上排空气法收集,应该是长管进气短管出气,C错误;饱和亚硫酸氢钠溶液无法吸收SO2,可改用氢氧化钠浓溶液,D错误。
6 B 某溶液中滴加BaCl2溶液,有白色沉淀生成,再滴加稀盐酸,沉淀不溶解,也可能是生成氯化银沉淀,即无法排除氯离子干扰,A错误;钾元素的焰色反应实验需要透过蓝色钴玻璃观察,焰色反应为紫色,B正确;氯气和水生成的次氯酸具有漂白性,而氯气无漂白性,C错误;由于氯水过量,可能是过量的氯水将I-氧化为碘单质,不能证明氧化性Br2>I2,D错误。
7 B 先加入盐酸,会引入Cl-,干扰溶液中Cl-的检验,A错误;浓硫酸可以干燥氯气,B正确;氯气不溶于饱和食盐水,应该用氢氧化钠溶液吸收尾气氯气,C错误;氯水中的次氯酸具有漂白性,会漂白pH试纸,D错误。
8 C 向H2O2溶液中加入高锰酸钾后,发生化学反应2KMnO4+3H2O2===2MnO2+2KOH+2H2O+3O2↑等(中性条件),该反应中H2O2被氧化,体现出还原性,A错误;向盛有SO2水溶液的试管中滴加几滴品红溶液,品红溶液褪色,振荡,加热试管,溶液又恢复红色,说明SO2具有漂白性, B错误;向盛有淀粉-KI溶液的试管中滴加几滴溴水,振荡,溶液变为蓝色,说明Br2的氧化性比I2的强,C正确;SO和Na2S溶液在碱性条件下不反应,应该调溶液为酸性,再滴加几滴Na2S溶液,观察沉淀生成情况,D错误。
9 C 向KBr、KI混合溶液中依次加入少量氯水和CCl4,少量氯水先将KI氧化为碘单质,仅能证明氧化性Cl2>I2,Br2>I2,无法证明氧化性Cl2>Br2>I2,A错误;若溶液X为次氯酸钠溶液,则向溶液X中加入盐酸会产生氯气,也可以使品红溶液褪色,不能判断溶液X中是否含有SO或HSO,B错误;室温下,测定浓度均为0.1 mol/L的CH3COOH溶液、NH3·H2O的pH,可对比H+浓度,进而判断CH3COOH和NH3·H2O的电离程度,C正确;亚硫酸钠与氯化钡溶液可以发生反应生成亚硫酸钡沉淀,无法证明过氧化氢能否将亚硫酸盐氧化,D错误。
10 B 钠很活泼,和水反应生成氢氧化钠和氢气,则无论NaHCO3是否发生电离都会产生气泡,A错误;NaHCO3溶液显碱性,可以用 pH试纸测定,B正确;钠离子的焰色反应,不需要透过蓝色钴玻璃观察,C错误;澄清石灰水的主要成分为Ca(OH)2,Ca(OH)2与NaHCO3反应也会产生白色沉淀使溶液变浑浊,不能证明含有CO,D错误。
得分策略 熟悉SO2、CO2、Cl2、H2、O2等气体制备,包含发生、除杂、收集、尾气处理等环节。
(1) 气体发生装置
装置类型 装置图 适用气体 常见错误
固-固加热型 O2、NH3等 ①原料只用NH4Cl;②试管口应略向下倾斜
固-液加热型(或液-液加热型) Cl2等 ①加热烧瓶时要垫陶土网;②常会遗忘加热操作;③原料错用稀盐酸
固-液不加热型 O2、H2、CO2、SO2等 ①使用长颈漏斗时,要使漏斗下端伸入液面以下;②第一个装置只适用于块状固体和液体反应,常错用粉末状反应物,如MnO2等
(2) 气体净化装置
干燥装置 除杂装置
干燥剂:浓硫酸 干燥剂:P2O5(酸性)、无水氯化钙(中性) 干燥剂:碱石灰(碱性) 杂质 除杂试剂 杂质 除杂试剂
HCl 饱和食盐水 O2 灼热铜网
不可干燥:NH3、H2S、HBr、HI等 不可干燥:NH3 不可干燥:Cl2、H2S、HCl、SO2、CO2等 SO2 酸性KMnO4溶液等 H2或CO 灼热CuO
(3) 气体收集装置
收集方法 排水法 向上排空气法 向下排空气法
收集原理 收集的气体不与水反应且难溶于水 收集的气体能在空气中稳定存在,且密度比空气大得多 收集的气体能在空气中稳定存在,且密度比空气小得多
收集装置
适用的气体 H2、O2等 Cl2、HCl、CO2、H2S、SO2等 H2、NH3等
(4) 尾气处理装置
点燃尾气 直接吸收尾气
(如CO) (如用NaOH溶液吸收Cl2)
吸收极易溶于水的气体
(如吸收NH3或HCl气体时,要有防倒吸措施)
[2024扬州期末]实验室制取SO2时,下列装置不能达到相应实验目的的是( )
A. 制备 B. 检验 C. 干燥 D. 收集
【深度剖析】铜和浓硫酸加热可以获得SO2,A装置可以实现实验目的,A正确;SO2能使品红溶液褪色,故能用品红溶液来检验SO2,B装置可以实现实验目的,B正确;SO2可以用浓硫酸来干燥,但干燥气体需长进短出进行通气,C错误;SO2密度比空气大,采用向上排空气法收集,并用NaOH溶液进行尾气处理,D正确。
eq \o(\s\up7(拉分点2 物质检验类题型的推理),\s\do5())
得分策略 物质检验一般根据被检验物质的性质,采用能与其产生特殊现象的试剂,找出其他会产生类似现象的物质,设计实验排除其干扰。
实验操作及现象 实验结论 判断 解释
①用铂丝蘸取某溶液进行焰色反应,火焰呈黄色 一定是钠盐溶液,该溶液中一定不含K+ 错误 NaOH溶液干扰,检验K元素时,要透过蓝色钴玻璃观察
②将某气体通入品红溶液中,品红溶液褪色 该气体一定是SO2 错误 O3、Cl2等具有强氧化性的气体也能使品红溶液褪色
③向0.1 mol/L H2O2溶液中滴加0.01 mol/L KMnO4溶液,溶液褪色 H2O2具有氧化性 错误 高锰酸钾表现氧化性,H2O2表现还原性
①焰色反应显黄色,不一定是钠盐,还可能是碱(NaOH);②检验SO时,要先加盐酸酸化,再滴加BaCl2溶液。
eq \o(\s\up7(拉分点3 比较类题型的推理),\s\do5())
得分策略 比较类题型,确定比较点,同时要控制其他变量保持不变,如比较反应温度,就要控制反应物浓度、量等变量,这是变量控制。
探究方案 探究目的 判断 解释
向Na2CO3溶液中加入冰醋酸,将产生的气体直接通入苯酚钠溶液中,溶液变浑浊 酸性:醋酸>碳酸>苯酚 错误 挥发出来的CH3COOH也能使苯酚钠溶液变浑浊
向NaBr溶液中滴加过量氯水,再加入淀粉-KI溶液;溶液先变橙色后变蓝色 氧化性:Cl2>Br2>I2 错误 氯水过量,会继续氧化碘离子为碘单质
1 [2024无锡期末]下列实验可用来制备并检验Cl2的性质。下列说法正确的是( )
甲 乙 丙 丁
A. 图甲实验收集到的Cl2中只含有HCl一种杂质
B. 图乙实验可用于测定氯水的pH
C. 图丙实验中产生了棕黄色的雾
D. 图丁实验现象不能说明干燥的氯气有漂白性
2 [2024无锡期末]下列设计的实验装置和操作,能达到相关目的的是( )
甲 乙
甲 乙
INCLUDEPICTURE "24NTHBSL115.TIF"
丙 丁
A. 用图甲操作配制0.10 mol/L NaOH溶液
B. 用图乙实验比较Na2CO3、NaHCO3的稳定性
C. 用图丙装置制备少量Fe(OH)2,先打开止水夹a,一段时间后再关闭a
D. 用图丁实验证明非金属性强弱:Cl>C>Si
3 [2024泰州模拟]某化学兴趣小组拟探究C与浓硫酸反应,并检验气体产物。下列说法正确的是( )
甲 乙 丙 丁
A. 用装置甲进行C与浓硫酸反应
B. 将检验过CO2后的气体再通入装置丁中检验产物H2O
C. 将反应产生的气体通入装置丙,可直接检验产物SO2
D. 将反应产生的气体通入装置乙,可直接检验产物CO2
4 [2024南通模拟]实验室利用下列装置进行实验,不能达到实验目的是( )
甲 乙 丙 丁
A. 用装置甲制取Cl2
B. 用装置乙除去Cl2中混有的HCl气体
C. 用装置丙验证潮湿的Cl2具有漂白性
D. 用装置丁吸收尾气中的Cl2
5 下列制取SO2、验证其漂白性、收集并进行尾气处理的装置和原理能达到实验目的的是( )
A. 制取SO2 B. 验证漂白性 C. 收集SO2 D. 尾气处理
6 [2024淮安期中]室温下进行下列实验,根据实验操作和现象所得到的结论正确的是( )
选项 实验操作和现象 结论
A 向某溶液中滴加BaCl2溶液,有白色沉淀生成,再滴加稀盐酸,沉淀不溶解 则原溶液中一定含SO
B 用洁净的铂丝蘸取某溶液进行焰色反应,透过蓝色钴玻璃观察,火焰呈紫色 溶液中含K+
C 向新制氯水中滴加几滴紫色石蕊试液,溶液先变红后褪色 Cl2具有漂白性
D 向NaBr溶液中滴加过量氯水,再加入淀粉-KI溶液;溶液先变橙色后变蓝色 氧化性:Cl2>Br2>I2
7 [2024扬州期末]下列实验操作能达到实验目的的是( )
选项 实验目的 实验操作
A 检验溶液中的Cl- 向溶液中先加盐酸,再加AgNO3溶液
B 干燥Cl2 将气体通过盛有浓硫酸的洗气瓶
C 吸收尾气中的Cl2 将气体通入盛有饱和食盐水的烧杯
D 测定氯水的pH 将氯水滴在pH试纸上,与标准比色卡对照
8 室温下,下列实验探究方案能达到探究目的的是( )
选项 探究方案 探究目的
A 向0.1 mol/L H2O2溶液中滴加0.1 mol/L KMnO4溶液,观察溶液颜色变化 H2O2具有氧化性
B 向盛有SO2水溶液的试管中滴加几滴品红溶液,振荡,加热试管,观察溶液颜色变化 SO2具有还原性
C 向盛有淀粉KI溶液的试管中滴加几滴溴水,振荡,观察溶液颜色变化 Br2的氧化性比I2的强
D 向2 mL Na2SO3溶液中滴加几滴Na2S溶液,观察沉淀生成情况 SO具有氧化性
9 室温下,下列实验方案能达到探究目的的是( )
选项 实验方案 探究目的
A 向KBr、KI混合溶液中依次加入少量氯水和CCl4,振荡后静置,观察CCl4层颜色 氧化性:Cl2>Br2>I2
B 向溶液X中加入盐酸,将产生的气体通入品红溶液中,观察溶液颜色变化 溶液X中是否含有SO或HSO
C 测定浓度均为0.1 mol/L CH3COOH、NH3·H2O溶液的pH CH3COOH和NH3·H2O的电离能力
D 向过氧化氢和氯化钡混合液中滴加亚硫酸钠溶液,观察是否产生沉淀 探究过氧化氢能否将亚硫酸盐氧化
10 室温下,探究0.1 mol/L NaHCO3溶液的性质。下列实验方案能达到探究目的的是( )
选项 探究目的 实验方案
A HCO是否发生电离 向2 mL 0.1 mol/L NaHCO3溶液中加入一小块钠,观察溶液中是否有气泡产生
B 溶液是否存在大量OH- 用干燥洁净玻璃棒蘸取0.1 mol/L NaHCO3溶液,点在干燥的pH试纸上,测出溶液的pH
C 溶液中是否存在Na+ 取一支洁净的铂丝,蘸取0.1 mol/L NaHCO3溶液后在煤气灯上灼烧,透过蓝色钴玻璃观察火焰颜色
D 溶液中是否存在CO 向2 mL 0.1 mol/L NaHCO3溶液中滴入几滴澄清石灰水,观察溶液是否变浑浊
【巩固强化】
1 D 图甲实验收集到的Cl2中含有HCl、水蒸气,A错误;氯水中含有次氯酸,次氯酸具有漂白性,不能用pH试纸测氯水的pH,B错误;图丙实验中生成氯化铜,现象为产生了棕黄色的烟,C错误;鲜花中含有水,氯气和水反应生成具有漂白性的次氯酸,鲜花褪色,不能说明干燥的氯气有漂白性,D正确。
2 C 不能在容量瓶中溶解氢氧化钠固体,A错误;套管实验,加热时大试管温度高,小试管温度低,温度高分解不能说明稳定性差,应反过来放置,B错误;稀硫酸与铁粉反应生成硫酸亚铁与氢气,氢气能排除装置中的空气,一段时间后关闭a,利用气体压强变大将硫酸亚铁溶液排到氢氧化钠溶液中,反应得到Fe(OH)2沉淀,C正确;盐酸为无氧酸,无法比较元素的非金属性强弱,D错误。
3 C 产生的气体从长颈漏斗逸出,应该使用分液漏斗,A错误;由于气体要通入其他溶液,所以应最先检验水,B错误;SO2可以使品红褪色,可以用装置丙直接检验产物SO2,C正确;SO2和CO2均可使澄清石灰水变浑浊,应除去二氧化硫后再用装置乙检验二氧化碳,D错误。
4 D 实验室用浓盐酸和二氧化锰加热制取氯气,A正确;用饱和食盐水除去Cl2中混有的HCl气体,B正确;氯气和水反应生成的次氯酸有漂白性,用装置丙可以验证潮湿的Cl2具有漂白性,C正确;氯化钙作干燥剂,不与氯气反应,不可以处理尾气,D错误。
5 B 稀硫酸与铜共热不能生成SO2,要用浓硫酸和铜在加热条件下反应制取SO2,A错误;用品红溶液验证SO2的漂白性,B正确;SO2的密度大于空气的密度,用向上排空气法收集,应该是长管进气短管出气,C错误;饱和亚硫酸氢钠溶液无法吸收SO2,可改用氢氧化钠浓溶液,D错误。
6 B 某溶液中滴加BaCl2溶液,有白色沉淀生成,再滴加稀盐酸,沉淀不溶解,也可能是生成氯化银沉淀,即无法排除氯离子干扰,A错误;钾元素的焰色反应实验需要透过蓝色钴玻璃观察,焰色反应为紫色,B正确;氯气和水生成的次氯酸具有漂白性,而氯气无漂白性,C错误;由于氯水过量,可能是过量的氯水将I-氧化为碘单质,不能证明氧化性Br2>I2,D错误。
7 B 先加入盐酸,会引入Cl-,干扰溶液中Cl-的检验,A错误;浓硫酸可以干燥氯气,B正确;氯气不溶于饱和食盐水,应该用氢氧化钠溶液吸收尾气氯气,C错误;氯水中的次氯酸具有漂白性,会漂白pH试纸,D错误。
8 C 向H2O2溶液中加入高锰酸钾后,发生化学反应2KMnO4+3H2O2===2MnO2+2KOH+2H2O+3O2↑等(中性条件),该反应中H2O2被氧化,体现出还原性,A错误;向盛有SO2水溶液的试管中滴加几滴品红溶液,品红溶液褪色,振荡,加热试管,溶液又恢复红色,说明SO2具有漂白性, B错误;向盛有淀粉-KI溶液的试管中滴加几滴溴水,振荡,溶液变为蓝色,说明Br2的氧化性比I2的强,C正确;SO和Na2S溶液在碱性条件下不反应,应该调溶液为酸性,再滴加几滴Na2S溶液,观察沉淀生成情况,D错误。
9 C 向KBr、KI混合溶液中依次加入少量氯水和CCl4,少量氯水先将KI氧化为碘单质,仅能证明氧化性Cl2>I2,Br2>I2,无法证明氧化性Cl2>Br2>I2,A错误;若溶液X为次氯酸钠溶液,则向溶液X中加入盐酸会产生氯气,也可以使品红溶液褪色,不能判断溶液X中是否含有SO或HSO,B错误;室温下,测定浓度均为0.1 mol/L的CH3COOH溶液、NH3·H2O的pH,可对比H+浓度,进而判断CH3COOH和NH3·H2O的电离程度,C正确;亚硫酸钠与氯化钡溶液可以发生反应生成亚硫酸钡沉淀,无法证明过氧化氢能否将亚硫酸盐氧化,D错误。
10 B 钠很活泼,和水反应生成氢氧化钠和氢气,则无论NaHCO3是否发生电离都会产生气泡,A错误;NaHCO3溶液显碱性,可以用 pH试纸测定,B正确;钠离子的焰色反应,不需要透过蓝色钴玻璃观察,C错误;澄清石灰水的主要成分为Ca(OH)2,Ca(OH)2与NaHCO3反应也会产生白色沉淀使溶液变浑浊,不能证明含有CO,D错误。
