2016年秋期 备课参考 高一化学 人教版必修1 3.2《几种重要的金属化合物》3课时教学课件 (共48张PPT)
文档属性
| 名称 | 2016年秋期 备课参考 高一化学 人教版必修1 3.2《几种重要的金属化合物》3课时教学课件 (共48张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 8.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-07-28 15:04:14 | ||
图片预览








文档简介
课件48张PPT。第三章金属及其化合物第二节
几种重要的金属化合物 第三节
几种重要的金属化合物第一课时
钠的重要化合物第二课时
铝的重要化合物第二章化学物质及其变化 第三课时
铁的重要化合物 第一课时
钠的重要化合物第三章金属及其化合物第二节 几种重要的金属化合物 写出Na与O2 , Fe与水蒸汽,Al与NaOH溶液反应的化学方程式. 思考 金属易失电子,绝大多数在自然界是以化合态存在. 几种重要的金属化合物 Na与O2 ,在常温下和在加热条件下反应的产物不同,氧化钠呈 色,过氧化钠呈 色。 [思考与交流]:
写出Na2O 、CaO分别与水反应的化学方程式。金属氧化物与水反应有什么规律?Na2O+H2O=2NaOH CaO+H2O=Ca(OH)21.氧化钠与过氧化钠一 、 氧化物氧化钠与过氧化钠
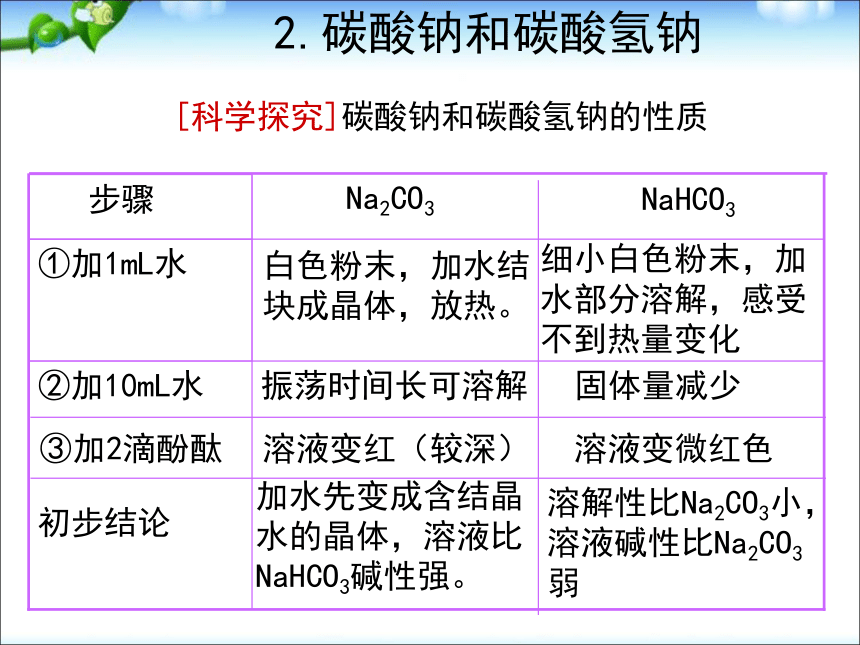
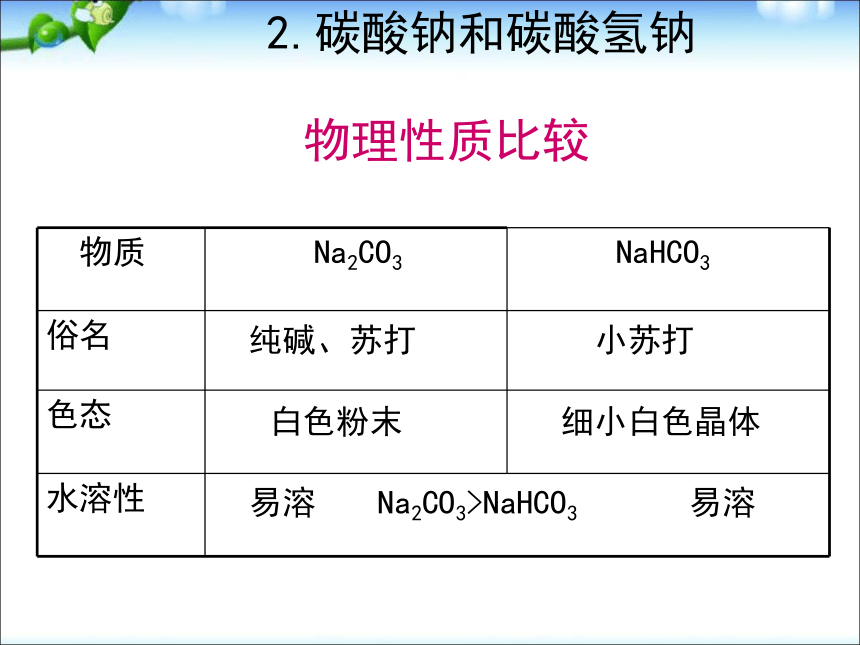
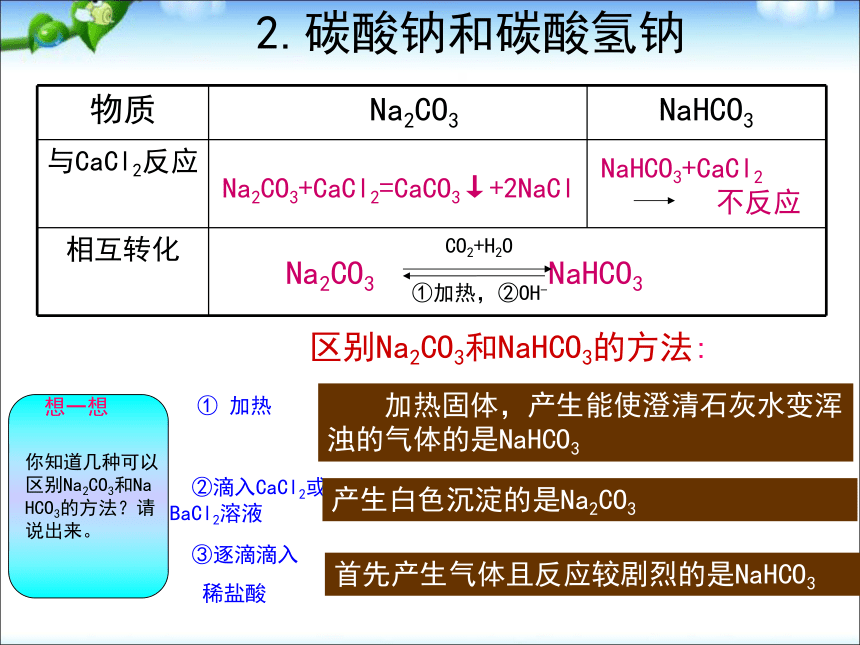
[观察与交流]:请描述你观察到的实验现象 [演示实验]:Na2O2与水反应产生大量气泡带火星木条复燃试管壁发热酚酞先变红,后褪色分析产生以上现象的原因:有气体产生此气体是氧气反应放热生成物溶液显碱性,且有漂白性有关化学方程式:2Na2O2+2H2O=4NaOH+O2↑探究反应后的溶液使指示剂褪色的原因:Na2O2+2H2O=2NaOH+H2O22H2O2=2H2O+ O2↑一 、 氧化物 [演示实验] Na2O2与CO2反应一 、 氧化物 [小结]:1.过氧化钠的性质淡黄色固体 能与水或二氧化碳反应产生氧气, 反应中,过氧化钠既表现氧化性,又表现还原性。2.过氧化钠的用途常用作供氧剂; 漂白剂;氧化剂2Na2O2+2H2O=4NaOH+O2↑-1-2 0溶解性比Na2CO3小,溶液碱性比Na2CO3弱加水先变成含结晶水的晶体,溶液比NaHCO3碱性强。初步结论溶液变微红色溶液变红(较深)③加2滴酚酞固体量减少振荡时间长可溶解②加10mL水细小白色粉末,加水部分溶解,感受不到热量变化白色粉末,加水结块成晶体,放热。①加1mL水 NaHCO3 Na2CO3 步骤 [科学探究]碳酸钠和碳酸氢钠的性质 2.碳酸钠和碳酸氢钠小苏打纯碱、苏打白色粉末细小白色晶体易溶易溶Na2CO3>NaHCO3物理性质比较 2.碳酸钠和碳酸氢钠 2.碳酸钠和碳酸氢钠溶液变红,显碱性稳定,加热不分解NaHCO3+NaOH=Na2CO3+H2ONa2CO3+Ca(OH)2=CaCO3↓+2NaOH溶液变浅红,显碱性2NaHCO3= Na2CO3+H2O+CO2↑CO32-+2H+=H2O+CO2↑HCO3-+H+=H2O+CO2↑反应速率:Na2CO3Ca(OH)2化学性质 区别Na2CO3和NaHCO3的方法:① 加热 加热固体,产生能使澄清石灰水变浑浊的气体的是NaHCO3 ②滴入CaCl2或BaCl2溶液产生白色沉淀的是Na2CO3 ③逐滴滴入
稀盐酸首先产生气体且反应较剧烈的是NaHCO3 Na2CO3+CaCl2=CaCO3↓+2NaCl2.碳酸钠和碳酸氢钠 思考与练习 1、如何除去下列物质中的少量杂质(括号中为杂质)
①Na2CO3(NaHCO3)固体
②NaHCO3(Na2CO3)加热向溶液中通入过量CO22.碳酸钠和碳酸氢钠 2、同物质的量浓度同体积的Na2CO3和NaHCO3溶液分别跟过量稀盐酸反应,下列说法中正确的是( )
①NaHCO3消耗盐酸多 ②Na2CO3消耗盐酸多
③Na2CO3放出CO2多 ④NaHCO3放出CO2多
⑤Na2CO3放出CO2较快 ⑥NaHCO3放出CO2较快②⑥ 思考与练习2.碳酸钠和碳酸氢钠焰色反应实验步骤 ①将铂丝放在酒精灯外焰上灼烧至火焰颜色与原来相同;
②用铂丝蘸取待测碳酸钠溶液放在外焰上灼烧,观察火焰颜色;
③用盐酸洗净铂丝,在外焰上灼烧至火焰无色后,再蘸取碳酸钾溶液在外焰上灼烧,透过蓝色的钴玻璃观察火焰的颜色。 ①每次实验必须用盐酸洗净铂丝,并灼烧至
火焰与原来相同;
②钾的焰色必须透过蓝色的钴玻璃观察。
(避免钠等杂质的焰色的干扰。)焰色反应实验注意 【实验问题讨论】 1.为什么铂丝用稀盐酸洗涤、灼烧后才能做下一个焰色反应实验?
2.观察钾的焰色反应,为什么要透过蓝色的钴玻璃观察?
3.一种溶液,若其焰色反应呈黄色,能证明它是钠盐溶液吗?
1.氯化物多数都是易溶的,只有氯化银不溶,用 稀盐酸洗涤、灼烧,可使铂丝上残留的阳离子除去。 2.一般的溶液中都有少量钠离子,由于金属钾焰色的颜色浅,容易被钠干扰(排除钠的干扰) 3. 不能,能推断出其中一定含有钠离子,但也可能是氢氧化钠溶液,而不一定是盐溶液 (1). 金属单质和化合态该金属的焰色反应是一样的?(因为这是元素的一种特性)。???
(2).熟记钠、钾的焰色反应的颜色:钠:黄色,钾:紫色(透过蓝色钴玻璃观察)
强调 几种金属的焰色 Li Na K KCa Sr Ba Cu 紫红 黄 浅紫 砖红 洋红 黄绿 绿3、焰色反应3、焰色反应的用途 ①?离子检验:如鉴别氯化钠、氯化钾、硝酸钾三种无色溶液
②?做焰火材料
[问题讨论] 制造玻璃的主要原料之一是纯碱。当在玻璃管口点燃某些可燃性气体时,火焰常呈现黄色。能否由此说明这些气体的火焰也为黄色?为什么? 作业:课本P62—1、4、6 第二课时
铝的重要化合物第三章金属及其化合物3.2 几种重要的金属化合物
第三章金属及其化合物1.铝的存在
2. Al2O3、Al(OH)3的两性
3.铝的化合物的用途
4. Al3+、 Al(OH)3、 AlO2-的相互转化本课学习内容一.铝的存在及性质 金属铝是当今世界产量最高、用途最广的有色金属,但为什么发现并制得铝却较晚?在你的生活中,有哪些跟铝有关的信息与大家分享想一想二.氧化铝氧化铝的性质(1).氧化铝的物理性质白色固体(2).氧化铝的化学性质能与酸反应生成Al3+能与强碱溶液反应生成AlO2-难溶于水、熔点高、坚硬、用途: 保护膜、耐火材料 请写出氧化铝与盐酸和氢氧化钠溶液反应的化学方程式观看实验氧化物学
与
问 钠表面的氧化物和铝的氧化膜都是金属氧化物,它们的外观形态和性质相同吗?对内层金属的保护作用一样吗?实验欣赏——铝箔燃烧请描述实验现象:发出耀眼白光,生成白色固体。试推测还应该伴有什么现象发生?有热量放出归纳 氧化钠与氧化铝比较 Na2O、Al2O3都是白色固体,但附在银白色的金属钠或铝上均显暗灰色。
它们的化学性质不同:
(1)Na2O能溶与水并与水反应,生成NaOH;
Al2O3不溶于水;
(2)Na2O能与酸反应,
Al2O3既能与酸反应,又能与强碱反应;
(3)Na2O疏松,对内层金属不起保护作用,而在空气中铝表面的Al2O3是致密的薄层,对内层铝有很好的保护作用。 氧化物 氧化物1.与水反应:可溶或微溶性氧化物与水反应生成相应的碱。 (如 Na2O、K2O、CaO、BaO) Na2O Al2O3 Fe2O3 CuO 水溶性氧化物色、态
白色固体 与水反应黑色固体 红棕色固 白色固体 不溶 CuO+2HCl=CuCl2+H2O 蓝绿色 Fe2O3+6HCl=2FeCl3+3H2O 棕黄色 Al2O3+6HCl=2AlCl3+3H2O 无色 Na2O +2HCl=2NaCl+H2O 无色 不溶 不溶 与盐酸反应的化学方程式及溶液颜色
小结:金属氧化物的性质2.与酸反应:生成盐和水。3.Al2O3的特性:与强碱反应生成偏铝酸盐和水 Al2O3+2NaOH=2NaAlO2+H2O与盐酸反应 三.氢氧化铝(1)制取课本演示实验3-7Al2(SO4)3+6NH3·H2O = 2Al(OH)3 ↓+3(NH4)2SO4离子方程式:Al3++3NH3·H2O=Al(OH)3 ↓+3NH4+【现象】有白色胶状沉淀生成操作注意: 继续加氨水至过量,沉淀不溶,说明Al(OH)3不溶于氨水。氢氧化物(2)氢氧化铝的化学性质①两性——既能跟酸反应,又能跟强碱反应。Al(OH)3+3HCl=AlCl3+3H2OAl(OH)3+NaOH=NaAlO2+2H2O想一想:
制取Al(OH)3时用NaOH溶液好还是用氨水好?为什么?②加热分解2Al(OH)3===Al2O3+3H2O 【练习1】
下列物质中,既能与盐酸反应又能与NaOH溶液反应的是
①NaHCO3 ②Al ③Al2O3 ④ Al(OH)3 ⑤AlCl3 ⑥CuO
A. ②③④⑤ B. ①③④⑥ C. ①②③④ D.全部C氢氧化物常见氢氧化物的性质氢氧化物阅读思考明矾为什么能够净水? 明矾溶于水并与水反应,生成的Al(OH)3胶体可以吸附悬浮在水中的泥沙等固体物质,并形成沉淀沉降下来,从而使水澄清,因此可用明矾净水。铝盐的净水作用(教材P59《资料卡片》)作业:课本P62——2、3、5、7、8、 第三课时
铁的重要化合物 第三章金属及其化合物第二节 几种重要的金属
铁的氧化物FeOFe3O4Fe2O3无铁红磁性氧化铁黑色黑色红棕色不溶不溶不溶+2+2、+3+3碱性氧化物碱性氧化物(FeO·Fe2O3) 铁的氧化物主要有三种 铁的重要化合物 1.铁的氧化物 铁的三种氧化物,均可被还原剂还原。 请写出工业上用铁矿石冶炼铁的化学方程式赤铁矿+CO:磁铁矿+CO: Fe3O4 中铁元素有2/3为+3价,1/3为+2价,试写出Fe3O4、Fe2O3 分别与盐酸反应的化学方程式。Fe3O4+8HCl=2FeCl3+FeCl2+4H2O
Fe2O3+6HCl=2FeCl3+3H2O
氧化物【练习】演示实验3-9Fe(OH)2:FeSO4+2NaOH=Fe(OH)2↓+Na2SO4Fe(OH)3:FeCl3+3NaOH=Fe(OH)3↓+3NaCl现象:生成红褐色沉淀现象:先生成白色沉淀,然后迅速变为灰绿色,最后变为红褐色.2.铁的氢氧化物(1)制取 难溶氢氧化物一般由盐与碱溶液反应制取 氢氧化亚铁的制备实验设计讨论(2)性质4Fe(OH)2+O2+2H2O=4Fe(OH)3① Fe(OH)2易被氧化你能不能设计一个实验,使我们能较长时间看到白色的Fe(OH)2沉淀?Fe(OH)3+3HCl=FeCl3+3H2O白色沉淀溶解得浅绿色溶液Fe(OH)2+2HCl=FeCl2+2H2O红褐色沉淀溶解得棕黄色溶液(可溶、不可溶氢氧化物都有的共性)氢氧化亚铁②与酸反应生成盐和水 2.铁的氢氧化物 难溶性碱受热分解生成氧化物和水,易溶性强碱受热不分解。红棕色粉末【规律】?铁的氢氧化物性质小结 △不反应(遇KSCN溶液颜色无变化)遇KSCN 溶液变红(用于检验Fe3+)Fe2++2OH-=Fe(OH)2↓Fe3++3OH-=Fe(OH)3↓还原性2FeCl2+Cl2=2FeCl3氧化性2FeCl3+Fe=3FeCl23、铁盐和亚铁盐的性质 Fe3+的性质 【方法】Fe2+、Fe3+与KSCN溶液的作用 ①在试管中加入5mLFeCl2溶液,滴入2滴KSCN溶液,观察颜色______________。向该溶液中滴加足量氯水(Cl2水)或H2O2溶液,溶液 __________。 ②在试管中加入5mLFeCl3溶液,滴入2滴KSCN溶液,观察溶液颜色______________。溶液颜色无变化变为血红色(1)Fe3+和Fe2+的鉴别和检验显血红色 【原理】氧化剂 Cl2、H2O2等 (2)Fe3+的氧化性和Fe2+的还原性Fe、Fe2+、Fe3+的转化关系(铁三角)氧化剂Cl2、H2O2等还原剂Fe、Cu等还原性氧化性还原性 ① 在盛有2mLFeCl3溶液的试管中加入少量铁粉,充分反应后,溶液由_____色变为_____色,反应方程式为_______ _.反应中氧化剂是_______,还原剂是_________.
② 再滴入2滴KSCN溶液,溶液颜色__________;
③ 再加入几滴氯水,观察溶液颜色变为_______.说明________________________,反应方程式
_____________________,还原剂是__________. (2)Fe3+的氧化性和Fe2+的还原性棕黄浅绿2FeCl3+Fe=3FeCl2FeCl3Fe 不显血红色血红色Fe2+被氯水氧化成Fe3+2FeCl2+Cl2=2FeCl3FeCl2FeFe3+Fe2+【思考题】用已学习的知识,再次考虑如何实现图中系列变化? 选择具体的物质,填入下图。(Cl2、Br2、稀HNO3
浓H2SO4 、 O2等)强氧化剂弱氧化剂(S、H+、Cu2+等)氧化剂 (KMnO4、K2Cr2O7、O2 、Cl2、Br2、H2O2、 HNO3等)还原剂(Zn、Fe、Cu、I-、S2- 、HI、H2S等)还原剂还原剂铁盐和亚铁盐【探究】亚铁离子与三价铁离子鉴别方法科学探究方法1物理方法——观色方法2方法3方法4方法5方法6加KSCN溶液加NaOH溶液加铁粉加Cu粉加稀硝酸方法7通新制H2S气体方法8方法小结通新制Cl2气体加碳酸钠溶液利用其特征反应利用其氧化还原性利用其水解反应 1.下列4种铁的化合物溶于稀盐酸后,滴加KSCN溶液没有颜色变化,再加氯水呈红色的是( )
A.FeO B.Fe2O3 C.FeCl3 D.FeSO4A、D 2.为了防止试剂变质,配制FeSO4溶液时除加入少量H2SO4外,还应加入( )
A.加入Cu B.通入Cl2
C.加入Fe D.加入KSCNC【思考与练习】 全世界每年因腐蚀而报废的钢铁估计约占全年总产量的三分之一锈迹斑斑的设备和材料金属的锈蚀本课小结 1.了解了几种铁的氧化物和氢氧化物的物理、化学性质。
2.学习了鉴别Fe2+和Fe3+的方法。
3.理解了铁三角中铁元素氧化还原性质的变化规律。
4.进一步学习运用比较的方法学习物质的性质。
拜拜
几种重要的金属化合物 第三节
几种重要的金属化合物第一课时
钠的重要化合物第二课时
铝的重要化合物第二章化学物质及其变化 第三课时
铁的重要化合物 第一课时
钠的重要化合物第三章金属及其化合物第二节 几种重要的金属化合物 写出Na与O2 , Fe与水蒸汽,Al与NaOH溶液反应的化学方程式. 思考 金属易失电子,绝大多数在自然界是以化合态存在. 几种重要的金属化合物 Na与O2 ,在常温下和在加热条件下反应的产物不同,氧化钠呈 色,过氧化钠呈 色。 [思考与交流]:
写出Na2O 、CaO分别与水反应的化学方程式。金属氧化物与水反应有什么规律?Na2O+H2O=2NaOH CaO+H2O=Ca(OH)21.氧化钠与过氧化钠一 、 氧化物氧化钠与过氧化钠
[观察与交流]:请描述你观察到的实验现象 [演示实验]:Na2O2与水反应产生大量气泡带火星木条复燃试管壁发热酚酞先变红,后褪色分析产生以上现象的原因:有气体产生此气体是氧气反应放热生成物溶液显碱性,且有漂白性有关化学方程式:2Na2O2+2H2O=4NaOH+O2↑探究反应后的溶液使指示剂褪色的原因:Na2O2+2H2O=2NaOH+H2O22H2O2=2H2O+ O2↑一 、 氧化物 [演示实验] Na2O2与CO2反应一 、 氧化物 [小结]:1.过氧化钠的性质淡黄色固体 能与水或二氧化碳反应产生氧气, 反应中,过氧化钠既表现氧化性,又表现还原性。2.过氧化钠的用途常用作供氧剂; 漂白剂;氧化剂2Na2O2+2H2O=4NaOH+O2↑-1-2 0溶解性比Na2CO3小,溶液碱性比Na2CO3弱加水先变成含结晶水的晶体,溶液比NaHCO3碱性强。初步结论溶液变微红色溶液变红(较深)③加2滴酚酞固体量减少振荡时间长可溶解②加10mL水细小白色粉末,加水部分溶解,感受不到热量变化白色粉末,加水结块成晶体,放热。①加1mL水 NaHCO3 Na2CO3 步骤 [科学探究]碳酸钠和碳酸氢钠的性质 2.碳酸钠和碳酸氢钠小苏打纯碱、苏打白色粉末细小白色晶体易溶易溶Na2CO3>NaHCO3物理性质比较 2.碳酸钠和碳酸氢钠 2.碳酸钠和碳酸氢钠溶液变红,显碱性稳定,加热不分解NaHCO3+NaOH=Na2CO3+H2ONa2CO3+Ca(OH)2=CaCO3↓+2NaOH溶液变浅红,显碱性2NaHCO3= Na2CO3+H2O+CO2↑CO32-+2H+=H2O+CO2↑HCO3-+H+=H2O+CO2↑反应速率:Na2CO3
稀盐酸首先产生气体且反应较剧烈的是NaHCO3 Na2CO3+CaCl2=CaCO3↓+2NaCl2.碳酸钠和碳酸氢钠 思考与练习 1、如何除去下列物质中的少量杂质(括号中为杂质)
①Na2CO3(NaHCO3)固体
②NaHCO3(Na2CO3)加热向溶液中通入过量CO22.碳酸钠和碳酸氢钠 2、同物质的量浓度同体积的Na2CO3和NaHCO3溶液分别跟过量稀盐酸反应,下列说法中正确的是( )
①NaHCO3消耗盐酸多 ②Na2CO3消耗盐酸多
③Na2CO3放出CO2多 ④NaHCO3放出CO2多
⑤Na2CO3放出CO2较快 ⑥NaHCO3放出CO2较快②⑥ 思考与练习2.碳酸钠和碳酸氢钠焰色反应实验步骤 ①将铂丝放在酒精灯外焰上灼烧至火焰颜色与原来相同;
②用铂丝蘸取待测碳酸钠溶液放在外焰上灼烧,观察火焰颜色;
③用盐酸洗净铂丝,在外焰上灼烧至火焰无色后,再蘸取碳酸钾溶液在外焰上灼烧,透过蓝色的钴玻璃观察火焰的颜色。 ①每次实验必须用盐酸洗净铂丝,并灼烧至
火焰与原来相同;
②钾的焰色必须透过蓝色的钴玻璃观察。
(避免钠等杂质的焰色的干扰。)焰色反应实验注意 【实验问题讨论】 1.为什么铂丝用稀盐酸洗涤、灼烧后才能做下一个焰色反应实验?
2.观察钾的焰色反应,为什么要透过蓝色的钴玻璃观察?
3.一种溶液,若其焰色反应呈黄色,能证明它是钠盐溶液吗?
1.氯化物多数都是易溶的,只有氯化银不溶,用 稀盐酸洗涤、灼烧,可使铂丝上残留的阳离子除去。 2.一般的溶液中都有少量钠离子,由于金属钾焰色的颜色浅,容易被钠干扰(排除钠的干扰) 3. 不能,能推断出其中一定含有钠离子,但也可能是氢氧化钠溶液,而不一定是盐溶液 (1). 金属单质和化合态该金属的焰色反应是一样的?(因为这是元素的一种特性)。???
(2).熟记钠、钾的焰色反应的颜色:钠:黄色,钾:紫色(透过蓝色钴玻璃观察)
强调 几种金属的焰色 Li Na K KCa Sr Ba Cu 紫红 黄 浅紫 砖红 洋红 黄绿 绿3、焰色反应3、焰色反应的用途 ①?离子检验:如鉴别氯化钠、氯化钾、硝酸钾三种无色溶液
②?做焰火材料
[问题讨论] 制造玻璃的主要原料之一是纯碱。当在玻璃管口点燃某些可燃性气体时,火焰常呈现黄色。能否由此说明这些气体的火焰也为黄色?为什么? 作业:课本P62—1、4、6 第二课时
铝的重要化合物第三章金属及其化合物3.2 几种重要的金属化合物
第三章金属及其化合物1.铝的存在
2. Al2O3、Al(OH)3的两性
3.铝的化合物的用途
4. Al3+、 Al(OH)3、 AlO2-的相互转化本课学习内容一.铝的存在及性质 金属铝是当今世界产量最高、用途最广的有色金属,但为什么发现并制得铝却较晚?在你的生活中,有哪些跟铝有关的信息与大家分享想一想二.氧化铝氧化铝的性质(1).氧化铝的物理性质白色固体(2).氧化铝的化学性质能与酸反应生成Al3+能与强碱溶液反应生成AlO2-难溶于水、熔点高、坚硬、用途: 保护膜、耐火材料 请写出氧化铝与盐酸和氢氧化钠溶液反应的化学方程式观看实验氧化物学
与
问 钠表面的氧化物和铝的氧化膜都是金属氧化物,它们的外观形态和性质相同吗?对内层金属的保护作用一样吗?实验欣赏——铝箔燃烧请描述实验现象:发出耀眼白光,生成白色固体。试推测还应该伴有什么现象发生?有热量放出归纳 氧化钠与氧化铝比较 Na2O、Al2O3都是白色固体,但附在银白色的金属钠或铝上均显暗灰色。
它们的化学性质不同:
(1)Na2O能溶与水并与水反应,生成NaOH;
Al2O3不溶于水;
(2)Na2O能与酸反应,
Al2O3既能与酸反应,又能与强碱反应;
(3)Na2O疏松,对内层金属不起保护作用,而在空气中铝表面的Al2O3是致密的薄层,对内层铝有很好的保护作用。 氧化物 氧化物1.与水反应:可溶或微溶性氧化物与水反应生成相应的碱。 (如 Na2O、K2O、CaO、BaO) Na2O Al2O3 Fe2O3 CuO 水溶性氧化物色、态
白色固体 与水反应黑色固体 红棕色固 白色固体 不溶 CuO+2HCl=CuCl2+H2O 蓝绿色 Fe2O3+6HCl=2FeCl3+3H2O 棕黄色 Al2O3+6HCl=2AlCl3+3H2O 无色 Na2O +2HCl=2NaCl+H2O 无色 不溶 不溶 与盐酸反应的化学方程式及溶液颜色
小结:金属氧化物的性质2.与酸反应:生成盐和水。3.Al2O3的特性:与强碱反应生成偏铝酸盐和水 Al2O3+2NaOH=2NaAlO2+H2O与盐酸反应 三.氢氧化铝(1)制取课本演示实验3-7Al2(SO4)3+6NH3·H2O = 2Al(OH)3 ↓+3(NH4)2SO4离子方程式:Al3++3NH3·H2O=Al(OH)3 ↓+3NH4+【现象】有白色胶状沉淀生成操作注意: 继续加氨水至过量,沉淀不溶,说明Al(OH)3不溶于氨水。氢氧化物(2)氢氧化铝的化学性质①两性——既能跟酸反应,又能跟强碱反应。Al(OH)3+3HCl=AlCl3+3H2OAl(OH)3+NaOH=NaAlO2+2H2O想一想:
制取Al(OH)3时用NaOH溶液好还是用氨水好?为什么?②加热分解2Al(OH)3===Al2O3+3H2O 【练习1】
下列物质中,既能与盐酸反应又能与NaOH溶液反应的是
①NaHCO3 ②Al ③Al2O3 ④ Al(OH)3 ⑤AlCl3 ⑥CuO
A. ②③④⑤ B. ①③④⑥ C. ①②③④ D.全部C氢氧化物常见氢氧化物的性质氢氧化物阅读思考明矾为什么能够净水? 明矾溶于水并与水反应,生成的Al(OH)3胶体可以吸附悬浮在水中的泥沙等固体物质,并形成沉淀沉降下来,从而使水澄清,因此可用明矾净水。铝盐的净水作用(教材P59《资料卡片》)作业:课本P62——2、3、5、7、8、 第三课时
铁的重要化合物 第三章金属及其化合物第二节 几种重要的金属
铁的氧化物FeOFe3O4Fe2O3无铁红磁性氧化铁黑色黑色红棕色不溶不溶不溶+2+2、+3+3碱性氧化物碱性氧化物(FeO·Fe2O3) 铁的氧化物主要有三种 铁的重要化合物 1.铁的氧化物 铁的三种氧化物,均可被还原剂还原。 请写出工业上用铁矿石冶炼铁的化学方程式赤铁矿+CO:磁铁矿+CO: Fe3O4 中铁元素有2/3为+3价,1/3为+2价,试写出Fe3O4、Fe2O3 分别与盐酸反应的化学方程式。Fe3O4+8HCl=2FeCl3+FeCl2+4H2O
Fe2O3+6HCl=2FeCl3+3H2O
氧化物【练习】演示实验3-9Fe(OH)2:FeSO4+2NaOH=Fe(OH)2↓+Na2SO4Fe(OH)3:FeCl3+3NaOH=Fe(OH)3↓+3NaCl现象:生成红褐色沉淀现象:先生成白色沉淀,然后迅速变为灰绿色,最后变为红褐色.2.铁的氢氧化物(1)制取 难溶氢氧化物一般由盐与碱溶液反应制取 氢氧化亚铁的制备实验设计讨论(2)性质4Fe(OH)2+O2+2H2O=4Fe(OH)3① Fe(OH)2易被氧化你能不能设计一个实验,使我们能较长时间看到白色的Fe(OH)2沉淀?Fe(OH)3+3HCl=FeCl3+3H2O白色沉淀溶解得浅绿色溶液Fe(OH)2+2HCl=FeCl2+2H2O红褐色沉淀溶解得棕黄色溶液(可溶、不可溶氢氧化物都有的共性)氢氧化亚铁②与酸反应生成盐和水 2.铁的氢氧化物 难溶性碱受热分解生成氧化物和水,易溶性强碱受热不分解。红棕色粉末【规律】?铁的氢氧化物性质小结 △不反应(遇KSCN溶液颜色无变化)遇KSCN 溶液变红(用于检验Fe3+)Fe2++2OH-=Fe(OH)2↓Fe3++3OH-=Fe(OH)3↓还原性2FeCl2+Cl2=2FeCl3氧化性2FeCl3+Fe=3FeCl23、铁盐和亚铁盐的性质 Fe3+的性质 【方法】Fe2+、Fe3+与KSCN溶液的作用 ①在试管中加入5mLFeCl2溶液,滴入2滴KSCN溶液,观察颜色______________。向该溶液中滴加足量氯水(Cl2水)或H2O2溶液,溶液 __________。 ②在试管中加入5mLFeCl3溶液,滴入2滴KSCN溶液,观察溶液颜色______________。溶液颜色无变化变为血红色(1)Fe3+和Fe2+的鉴别和检验显血红色 【原理】氧化剂 Cl2、H2O2等 (2)Fe3+的氧化性和Fe2+的还原性Fe、Fe2+、Fe3+的转化关系(铁三角)氧化剂Cl2、H2O2等还原剂Fe、Cu等还原性氧化性还原性 ① 在盛有2mLFeCl3溶液的试管中加入少量铁粉,充分反应后,溶液由_____色变为_____色,反应方程式为_______ _.反应中氧化剂是_______,还原剂是_________.
② 再滴入2滴KSCN溶液,溶液颜色__________;
③ 再加入几滴氯水,观察溶液颜色变为_______.说明________________________,反应方程式
_____________________,还原剂是__________. (2)Fe3+的氧化性和Fe2+的还原性棕黄浅绿2FeCl3+Fe=3FeCl2FeCl3Fe 不显血红色血红色Fe2+被氯水氧化成Fe3+2FeCl2+Cl2=2FeCl3FeCl2FeFe3+Fe2+【思考题】用已学习的知识,再次考虑如何实现图中系列变化? 选择具体的物质,填入下图。(Cl2、Br2、稀HNO3
浓H2SO4 、 O2等)强氧化剂弱氧化剂(S、H+、Cu2+等)氧化剂 (KMnO4、K2Cr2O7、O2 、Cl2、Br2、H2O2、 HNO3等)还原剂(Zn、Fe、Cu、I-、S2- 、HI、H2S等)还原剂还原剂铁盐和亚铁盐【探究】亚铁离子与三价铁离子鉴别方法科学探究方法1物理方法——观色方法2方法3方法4方法5方法6加KSCN溶液加NaOH溶液加铁粉加Cu粉加稀硝酸方法7通新制H2S气体方法8方法小结通新制Cl2气体加碳酸钠溶液利用其特征反应利用其氧化还原性利用其水解反应 1.下列4种铁的化合物溶于稀盐酸后,滴加KSCN溶液没有颜色变化,再加氯水呈红色的是( )
A.FeO B.Fe2O3 C.FeCl3 D.FeSO4A、D 2.为了防止试剂变质,配制FeSO4溶液时除加入少量H2SO4外,还应加入( )
A.加入Cu B.通入Cl2
C.加入Fe D.加入KSCNC【思考与练习】 全世界每年因腐蚀而报废的钢铁估计约占全年总产量的三分之一锈迹斑斑的设备和材料金属的锈蚀本课小结 1.了解了几种铁的氧化物和氢氧化物的物理、化学性质。
2.学习了鉴别Fe2+和Fe3+的方法。
3.理解了铁三角中铁元素氧化还原性质的变化规律。
4.进一步学习运用比较的方法学习物质的性质。
拜拜
