鲁科版高中化学必修一第一章第二节研究物质的方法和程序第一课时课件(共24张PPT)
文档属性
| 名称 | 鲁科版高中化学必修一第一章第二节研究物质的方法和程序第一课时课件(共24张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 6.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-18 00:00:00 | ||
图片预览







文档简介
(共24张PPT)
第1章 第2节
研究物质性质的方法和程序
第1课时 研究物质性质的基本方法---金属钠的性质
知识导航
1
2
3
研究物质性质的基本方法
金属钠与水的反应
金属钠与氧气的反应
4
金属钠与酸、碱、盐溶液的反应
重点
难点
新课导入
那么怎样才能更科学地研究物质的性质呢?
通过对溴化银(AgBr)性质的研究,制成了感光胶卷
通过对叠氮化钠(NaN3)性质的研究,制成了汽车安全气囊
通过对液态氢(H2)和液态氧(O2)性质的研究,制成了火箭推进剂
研究物质的性质是化学研究的一项重要内容
在初中化学的学习中,你主要认识了哪些物质?请以其中一种物质为例说明你是通过什么方法来研究它的性质。
非金属(O2、H2等)、金属(Zn、Fe等)、酸(盐酸、硫酸等)、
碱(NaOH、Ca(OH)2等)、盐(NaCl、AgNO3等)、氧化物(CO2、H2O等)
以Fe为例
金属,具有金属的通性
银白色固体
铁钉投入稀盐酸
产生气泡
溶液由无色变为浅绿色
铁钉投入CuSO4溶液
铁钉表面生成一层红色固体
分类法
观察法
实验法
一、研究物质的基本方法
观察、实验、分类、比较……
1、观察法:
直接观察法
眼看:
鼻闻:
耳听:
触摸:
间接观察法
借助仪器,进行更为细致的观察
物质的温度变化或硬度
物质的颜色、状态及其变化
物质的气味
物质变化过程中发出的声音
运用观察法来研究金属钠的性质
观察金属钠及金属钠与水反应的现象
【观察目的】
1、认识金属钠的颜色、状态、硬度和密度的相对大小以及熔点的相对高低。
2、认识金属钠与水的反应。
观察要有明确而具体的目的,并且要对观察到的信息进行分析和综合
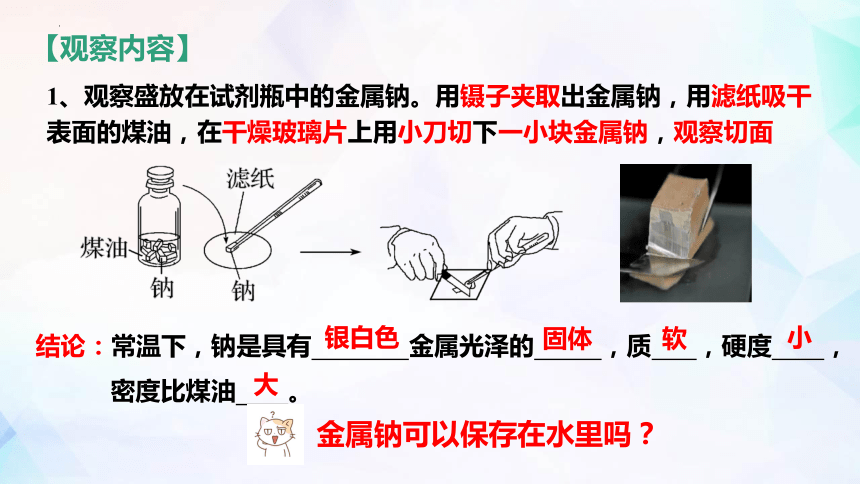
1、观察盛放在试剂瓶中的金属钠。用镊子夹取出金属钠,用滤纸吸干表面的煤油,在干燥玻璃片上用小刀切下一小块金属钠,观察切面
结论:常温下,钠是具有 金属光泽的 ,质 ,硬度 ,
密度比煤油 。
银白色
固体
软
小
大
【观察内容】
金属钠可以保存在水里吗?
2、向培养皿中加入适量的水,滴入1-2滴酚酞溶液,取一块绿豆粒大小的金属钠放入水中,观察现象。
讨论:由观察到的现象,你了解到金属钠的哪些物理和化学性质?
现象: 钠块浮在水面上,迅速熔化成闪亮的小球,在水面上四处游动,并发出“嘶嘶”的响声,最后消失,溶液变成红色。
浮、熔、游、响、红
【观察内容】
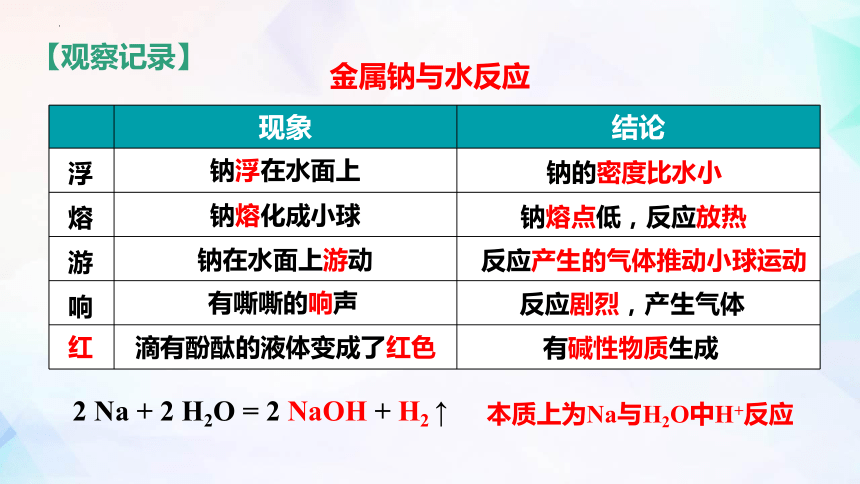
【观察记录】
现象 结论
钠浮在水面上
钠熔化成小球
钠在水面上游动
有嘶嘶的响声
滴有酚酞的液体变成了红色
钠的密度比水小
钠熔点低,反应放热
反应产生的气体推动小球运动
有碱性物质生成
反应剧烈,产生气体
浮
熔
游
响
红
金属钠与水反应
2 Na + 2 H2O = 2 NaOH + H2 ↑
本质上为Na与H2O中H+反应
【迁移与转化】
1、如果将H2O换成稀硫酸,现象有何不同?为什么?
2、如将H2O换成CuSO4溶液,现象有何不同?写出该反应的化学方程式。
规律总结:遇水记四点,浮熔游响全,遇酸酸优先,遇盐水在前
Na与稀硫酸反应更剧烈,因为稀硫酸中H+浓度比水中大得多。
CuSO4溶液中有气泡冒出,产生蓝色沉淀。
2Na+2H2O===2NaOH+H2↑ 2NaOH+CuSO4===Cu(OH)2↓+Na2SO4
2Na+2H2O+CuSO4===Na2SO4+Cu(OH)2+H2↑
总反应:
【思考与交流】
1、可以用手直接拿取或接触钠块吗?为什么?
不能。手上含有少量水,钠与水反应放出的热会灼烧皮肤,且反应生成的NaOH会腐蚀皮肤。
2、金属钠着火如何救火?可以用水吗?
金属钠等活泼金属失火必须用干燥的泥沙盖灭, 不能用水扑灭。
3、金属钠投入饱和食盐水中会有什么现象?放入饱和石灰水中呢?
有NaCl晶体析出并放出气体
溶液变浑浊并放出气体
金属钠的保存、制备和应用
一、金属钠的保存
二、金属钠的制备方法:电解熔融的氯化钠
2 NaCl(熔融) === 2 Na+Cl2 ↑
通电
少量钠应保存在煤油中,大量的钠用石蜡密封保存。
三、金属钠的应用
① 钠和钾的合金可用作原子反应堆的导热剂。
② 高压钠灯发出的黄光射程远、透雾能力强,常用作路灯。
③ 金属钠还可用于钛、锆、铌、钽等金属的冶炼(置换反应)。
牛刀小试
A.金属钠只在水层中游动,金属钠熔化,水层变红
B.金属钠只在煤油层中游动,并放出气体
C.金属钠在CCl4层和水层界面处游动并上下跳动,钠块熔化,水层变红
D.金属钠在水层和煤油层界面处游动并上下跳动,钠块熔化,水层变红
1、将绿豆粒大小的金属钠投入如图所示的烧杯中,可能出现的现象是
D
钠的密度是 0.97 g.cm-3
一、研究物质的基本方法
观察、实验、分类、比较……
2、实验法:验证预测或探究物质未知的性质。
实验前
实验中
实验后
明确实验目的、实验用品和实验方案等
仔细观察实验现象,并做好实验记录
对实验结果进行分析,并写好实验报告
要注意控制温度、压强、溶液的浓度等条件
条件不同
结论不同
注意:
如:碳与氧气的反应
运用实验法来研究金属钠的性质
金属钠与氧气的反应
【实验目的】
1、探究金属钠与氧气的反应。
2、认识条件控制对实验研究的意义。
【实验用品】
金属钠;
酒精灯,坩埚,三脚架,泥三角,坩埚钳,镊子,小刀,玻璃片,滤纸,火柴。
1、将切好的金属钠放置在空气中,观察现象。
2、将一小块金属放入坩埚中加热,观察现象。
金属钠的切面在空气中的变化
在空气中加热金属钠发生的变化
【实验方案】
实验内容 实验现象 实验结论
金属钠在空气中放置
金属钠在空气中加热
【实验方案实施】
钠表面银白色变为白色,失去金属光泽
常温下,金属钠与氧气发生反应生成氧化钠
加热条件下,金属钠与氧气发生反应生成过氧化钠
金属钠先熔化为光亮的小球,然后剧烈燃烧,火焰呈黄色,生成淡黄色固体
4 Na + O2 === 2 Na2O
2 Na + O2 === Na2O2
△
钠的氧化物---氧化钠和过氧化钠
氧化钠(Na2O)是白色的固体;过氧化钠(Na2O2)是淡黄色的固体
一、物理性质
二、化学性质
1、与H2O反应:
2、与CO2反应:
O2-
氧离子
O22-
过氧根离子
2 Na2O + 2 H2O = 4 NaOH
2 Na2O2 + 2 H2O = 4 NaOH + O2 ↑
Na2O2是过氧化物
2 Na2O + 2 CO2 = 2 Na2CO3
2 Na2O2 + 2 CO2 = 2 Na2CO3 + O2
氧元素呈-1价
碱性氧化物
3、与盐酸反应
2 Na2O2 + 4 HCl = 4 NaCl+ 2 H2O + O2 ↑
钠的氧化物---氧化钠和过氧化钠
三、用途(性质决定用途)
Na2O可用于实验室制少量的NaOH;Na2O2常用做供氧剂和漂白剂
Na2O2 + 2 H2O = 2 NaOH + H2O2
2 H2O2 = 2H2O + O2 ↑
总反应: 2 Na2O2 + 2 H2O = 4 NaOH + O2 ↑
CaO2 的化学名称是什么?
过氧化钙
Na2O和Na2O2的性质及其用途比较
名称 氧化钠 过氧化钠
化学式
组成结构
氧的化合价
生成条件
颜色、状态
与H2O的反应
Na2O
Na2O2
-2
-1
常温
加热或点燃
白色固体
淡黄色固体
2Na2O2+2H2O=4NaOH+O2↑
Na2O+H2O=2NaOH
N(Na+) : N(O2-)=2 : 1
N(Na+) : N(O22- ) = 2 : 1
与CO2的反应
与盐酸的反应
稳定性
用途
Na2O+CO2 =Na2CO3
2Na2O2+2CO2=2Na2CO3+O2
Na2O+2HCl=2NaCl+H2O
2Na2O2+4HCl=4NaCl+2H2O+O2↑
不稳定,易被氧化
2Na2O+O2 2Na2O2
较稳定
作漂白剂、供氧剂
制NaOH
Na2O和Na2O2的性质及其用途比较
四、拓展与交流
1、如将Na2O2放入滴有酚酞的水溶液中,有何现象?能用pH试纸检验该溶液是否呈碱性吗?
Na
Na2O
NaOH
Na2CO3 10H2O
Na2CO3
2、请思考如果将金属钠长期放置在空气中最终会转化为什么物质?
3、金属钠着火是否可以用二氧化碳灭火器或者干粉灭火器灭火?
不能,金属钠燃烧生成的Na2O2会与CO2反应生成O2,燃烧更加剧烈
溶液先变红后褪色;不能检测
钠
的
性
质
研究物质性质的方法
分类法
实验法
比较法
观察法
指导
应用
物理性质
化学性质
与水、氧气反应
决定
反映
取用
保存
用途
重点:化学方程式、实验现象及解释
课堂小结
银白色金属光泽、固体、密度小、熔点低、硬度小
钠的氧化物
1、在一定温度下,向饱和烧碱溶液中加入一定量的过氧化钠,充分反应后恢复到原温度,下列说法正确的是
课堂练习
A.溶液中有晶体析出,Na+数目不变
B. 溶液中有气体溢出,Na+数目增加
C. 溶质的质量分数增大
D. 溶液中Na+数目减少,溶质质量分数未变
2 Na2O2 + 2 H2O = 4 NaOH + O2 ↑
注意:Na+数目与Na+浓度的区别
D
溶剂减少
第1章 第2节
研究物质性质的方法和程序
第1课时 研究物质性质的基本方法---金属钠的性质
知识导航
1
2
3
研究物质性质的基本方法
金属钠与水的反应
金属钠与氧气的反应
4
金属钠与酸、碱、盐溶液的反应
重点
难点
新课导入
那么怎样才能更科学地研究物质的性质呢?
通过对溴化银(AgBr)性质的研究,制成了感光胶卷
通过对叠氮化钠(NaN3)性质的研究,制成了汽车安全气囊
通过对液态氢(H2)和液态氧(O2)性质的研究,制成了火箭推进剂
研究物质的性质是化学研究的一项重要内容
在初中化学的学习中,你主要认识了哪些物质?请以其中一种物质为例说明你是通过什么方法来研究它的性质。
非金属(O2、H2等)、金属(Zn、Fe等)、酸(盐酸、硫酸等)、
碱(NaOH、Ca(OH)2等)、盐(NaCl、AgNO3等)、氧化物(CO2、H2O等)
以Fe为例
金属,具有金属的通性
银白色固体
铁钉投入稀盐酸
产生气泡
溶液由无色变为浅绿色
铁钉投入CuSO4溶液
铁钉表面生成一层红色固体
分类法
观察法
实验法
一、研究物质的基本方法
观察、实验、分类、比较……
1、观察法:
直接观察法
眼看:
鼻闻:
耳听:
触摸:
间接观察法
借助仪器,进行更为细致的观察
物质的温度变化或硬度
物质的颜色、状态及其变化
物质的气味
物质变化过程中发出的声音
运用观察法来研究金属钠的性质
观察金属钠及金属钠与水反应的现象
【观察目的】
1、认识金属钠的颜色、状态、硬度和密度的相对大小以及熔点的相对高低。
2、认识金属钠与水的反应。
观察要有明确而具体的目的,并且要对观察到的信息进行分析和综合
1、观察盛放在试剂瓶中的金属钠。用镊子夹取出金属钠,用滤纸吸干表面的煤油,在干燥玻璃片上用小刀切下一小块金属钠,观察切面
结论:常温下,钠是具有 金属光泽的 ,质 ,硬度 ,
密度比煤油 。
银白色
固体
软
小
大
【观察内容】
金属钠可以保存在水里吗?
2、向培养皿中加入适量的水,滴入1-2滴酚酞溶液,取一块绿豆粒大小的金属钠放入水中,观察现象。
讨论:由观察到的现象,你了解到金属钠的哪些物理和化学性质?
现象: 钠块浮在水面上,迅速熔化成闪亮的小球,在水面上四处游动,并发出“嘶嘶”的响声,最后消失,溶液变成红色。
浮、熔、游、响、红
【观察内容】
【观察记录】
现象 结论
钠浮在水面上
钠熔化成小球
钠在水面上游动
有嘶嘶的响声
滴有酚酞的液体变成了红色
钠的密度比水小
钠熔点低,反应放热
反应产生的气体推动小球运动
有碱性物质生成
反应剧烈,产生气体
浮
熔
游
响
红
金属钠与水反应
2 Na + 2 H2O = 2 NaOH + H2 ↑
本质上为Na与H2O中H+反应
【迁移与转化】
1、如果将H2O换成稀硫酸,现象有何不同?为什么?
2、如将H2O换成CuSO4溶液,现象有何不同?写出该反应的化学方程式。
规律总结:遇水记四点,浮熔游响全,遇酸酸优先,遇盐水在前
Na与稀硫酸反应更剧烈,因为稀硫酸中H+浓度比水中大得多。
CuSO4溶液中有气泡冒出,产生蓝色沉淀。
2Na+2H2O===2NaOH+H2↑ 2NaOH+CuSO4===Cu(OH)2↓+Na2SO4
2Na+2H2O+CuSO4===Na2SO4+Cu(OH)2+H2↑
总反应:
【思考与交流】
1、可以用手直接拿取或接触钠块吗?为什么?
不能。手上含有少量水,钠与水反应放出的热会灼烧皮肤,且反应生成的NaOH会腐蚀皮肤。
2、金属钠着火如何救火?可以用水吗?
金属钠等活泼金属失火必须用干燥的泥沙盖灭, 不能用水扑灭。
3、金属钠投入饱和食盐水中会有什么现象?放入饱和石灰水中呢?
有NaCl晶体析出并放出气体
溶液变浑浊并放出气体
金属钠的保存、制备和应用
一、金属钠的保存
二、金属钠的制备方法:电解熔融的氯化钠
2 NaCl(熔融) === 2 Na+Cl2 ↑
通电
少量钠应保存在煤油中,大量的钠用石蜡密封保存。
三、金属钠的应用
① 钠和钾的合金可用作原子反应堆的导热剂。
② 高压钠灯发出的黄光射程远、透雾能力强,常用作路灯。
③ 金属钠还可用于钛、锆、铌、钽等金属的冶炼(置换反应)。
牛刀小试
A.金属钠只在水层中游动,金属钠熔化,水层变红
B.金属钠只在煤油层中游动,并放出气体
C.金属钠在CCl4层和水层界面处游动并上下跳动,钠块熔化,水层变红
D.金属钠在水层和煤油层界面处游动并上下跳动,钠块熔化,水层变红
1、将绿豆粒大小的金属钠投入如图所示的烧杯中,可能出现的现象是
D
钠的密度是 0.97 g.cm-3
一、研究物质的基本方法
观察、实验、分类、比较……
2、实验法:验证预测或探究物质未知的性质。
实验前
实验中
实验后
明确实验目的、实验用品和实验方案等
仔细观察实验现象,并做好实验记录
对实验结果进行分析,并写好实验报告
要注意控制温度、压强、溶液的浓度等条件
条件不同
结论不同
注意:
如:碳与氧气的反应
运用实验法来研究金属钠的性质
金属钠与氧气的反应
【实验目的】
1、探究金属钠与氧气的反应。
2、认识条件控制对实验研究的意义。
【实验用品】
金属钠;
酒精灯,坩埚,三脚架,泥三角,坩埚钳,镊子,小刀,玻璃片,滤纸,火柴。
1、将切好的金属钠放置在空气中,观察现象。
2、将一小块金属放入坩埚中加热,观察现象。
金属钠的切面在空气中的变化
在空气中加热金属钠发生的变化
【实验方案】
实验内容 实验现象 实验结论
金属钠在空气中放置
金属钠在空气中加热
【实验方案实施】
钠表面银白色变为白色,失去金属光泽
常温下,金属钠与氧气发生反应生成氧化钠
加热条件下,金属钠与氧气发生反应生成过氧化钠
金属钠先熔化为光亮的小球,然后剧烈燃烧,火焰呈黄色,生成淡黄色固体
4 Na + O2 === 2 Na2O
2 Na + O2 === Na2O2
△
钠的氧化物---氧化钠和过氧化钠
氧化钠(Na2O)是白色的固体;过氧化钠(Na2O2)是淡黄色的固体
一、物理性质
二、化学性质
1、与H2O反应:
2、与CO2反应:
O2-
氧离子
O22-
过氧根离子
2 Na2O + 2 H2O = 4 NaOH
2 Na2O2 + 2 H2O = 4 NaOH + O2 ↑
Na2O2是过氧化物
2 Na2O + 2 CO2 = 2 Na2CO3
2 Na2O2 + 2 CO2 = 2 Na2CO3 + O2
氧元素呈-1价
碱性氧化物
3、与盐酸反应
2 Na2O2 + 4 HCl = 4 NaCl+ 2 H2O + O2 ↑
钠的氧化物---氧化钠和过氧化钠
三、用途(性质决定用途)
Na2O可用于实验室制少量的NaOH;Na2O2常用做供氧剂和漂白剂
Na2O2 + 2 H2O = 2 NaOH + H2O2
2 H2O2 = 2H2O + O2 ↑
总反应: 2 Na2O2 + 2 H2O = 4 NaOH + O2 ↑
CaO2 的化学名称是什么?
过氧化钙
Na2O和Na2O2的性质及其用途比较
名称 氧化钠 过氧化钠
化学式
组成结构
氧的化合价
生成条件
颜色、状态
与H2O的反应
Na2O
Na2O2
-2
-1
常温
加热或点燃
白色固体
淡黄色固体
2Na2O2+2H2O=4NaOH+O2↑
Na2O+H2O=2NaOH
N(Na+) : N(O2-)=2 : 1
N(Na+) : N(O22- ) = 2 : 1
与CO2的反应
与盐酸的反应
稳定性
用途
Na2O+CO2 =Na2CO3
2Na2O2+2CO2=2Na2CO3+O2
Na2O+2HCl=2NaCl+H2O
2Na2O2+4HCl=4NaCl+2H2O+O2↑
不稳定,易被氧化
2Na2O+O2 2Na2O2
较稳定
作漂白剂、供氧剂
制NaOH
Na2O和Na2O2的性质及其用途比较
四、拓展与交流
1、如将Na2O2放入滴有酚酞的水溶液中,有何现象?能用pH试纸检验该溶液是否呈碱性吗?
Na
Na2O
NaOH
Na2CO3 10H2O
Na2CO3
2、请思考如果将金属钠长期放置在空气中最终会转化为什么物质?
3、金属钠着火是否可以用二氧化碳灭火器或者干粉灭火器灭火?
不能,金属钠燃烧生成的Na2O2会与CO2反应生成O2,燃烧更加剧烈
溶液先变红后褪色;不能检测
钠
的
性
质
研究物质性质的方法
分类法
实验法
比较法
观察法
指导
应用
物理性质
化学性质
与水、氧气反应
决定
反映
取用
保存
用途
重点:化学方程式、实验现象及解释
课堂小结
银白色金属光泽、固体、密度小、熔点低、硬度小
钠的氧化物
1、在一定温度下,向饱和烧碱溶液中加入一定量的过氧化钠,充分反应后恢复到原温度,下列说法正确的是
课堂练习
A.溶液中有晶体析出,Na+数目不变
B. 溶液中有气体溢出,Na+数目增加
C. 溶质的质量分数增大
D. 溶液中Na+数目减少,溶质质量分数未变
2 Na2O2 + 2 H2O = 4 NaOH + O2 ↑
注意:Na+数目与Na+浓度的区别
D
溶剂减少
