鲁科版高中化学必修一第一章第二节研究物质的方法和程序第一课时作业设计
文档属性
| 名称 | 鲁科版高中化学必修一第一章第二节研究物质的方法和程序第一课时作业设计 |

|
|
| 格式 | docx | ||
| 文件大小 | 504.5KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-18 00:00:00 | ||
图片预览



文档简介
研究物质的方法和程序第一课时作业设计
【夯实基础】
知识点1 研究物质性质的基本方法
1.下列关于研究物质性质的方法的描述正确的是( )
A.观察法只能通过视觉来完成
B.将NaCl固体放入水中,从而获取NaCl的某些性质,这只涉及实验法
C.银、铁、铜、锌等均为金属,具有金属光泽和导电性,涉及的是比较法
D.研究物质的性质时,往往同时采用观察、实验、分类、比较等方法中的多种方法
2.金属钠不仅能与氧气和水反应,还能与酒精在常温下反应,要研究金属钠与酒精反应的性质以及金属钠与酒精反应和金属钠与水反应的异同点,下列研究方法没有用到的是( )
A.分类法 B.实验法 C.观察法 D.比较法
知识点2观察金属钠及金属钠与水反应
3.下列有关钠的物理性质的叙述正确的是( )
①银白色金属;②质软,可以用小刀切;③熔点低于100 ℃;④密度比水的小;⑤热和电的良导体
A.仅①②④⑤ B.仅①②③④ C.仅①③④⑤ D.①②③④⑤
4.钠是一种很活泼的金属。已知:水的密度小于四氯化碳的密度。下列有关钠的说法正确的是( )
A.可将钠保存在四氯化碳中
B.实验中剩余的钠应放进废液桶中
C.实验室取用并切割金属钠只需要3种用品
D.钠通常保存在煤油或石蜡油中
5.钠与水反应的实验过程如图所示,下列有关说法不正确的是( )
A.图②中钠熔成小球,说明钠与水反应放热且钠的熔点低
B.图②中钠球四处游动,说明钠的密度比水的小
C.图③中滴加酚酞溶液后溶液变红,说明钠与水反应有碱性物质生成
D.钠与水反应的化学方程式是
知识点3金属钠与氧气的反应
6.观察法是研究物质性质的基本方法之一。某同学将一小块金属钠放置于空气中,观察到下列现象:银白色变灰暗变白色表面潮湿白色晶体白色粉末,下列说法错误的是( )
A.①中钠发生了氧化反应 B.②变白色是因为生成了氢氧化钠
C.③发生的是物理变化 D.④生成了碳酸氢钠
7.某化学兴趣小组在学校科技节活动中表演了“吹气生火”和“滴水生火”的小魔术。如图所示,先在蒸发皿中分别放两小团脱脂棉,然后裹入一种淡黄色的化合物,再对着脱脂棉吹气或者用胶头滴管滴几滴水,一会儿脱脂棉就会燃烧起来。下列说法正确的是( )
A.淡黄色化合物为
B.“吹气生火”的小魔术可以得出钠着火时不能用泡沫灭火器灭火
C.由“滴水生火”的小魔术可以得出有氢气生成
D.在活动中为了更清楚地观察现象,需要近距离俯视蒸发皿
8.已知:是潜水艇中常用的供氧剂。下列叙述错误的是( )
A.、与水反应都能生成NaOH
B.火灾现场若有大量,可用干燥的沙土来灭火
C.作供氧剂时既生成了,又“固定”了
D.向硫酸铜溶液中加入足量固体,静置后溶液由蓝色变为无色,说明过氧化钠具有漂白性
9.用一团棉花包裹少量过氧化钠置于坩埚中,将气体缓缓通入棉花中,棉花很快燃烧起来。下列说法错误的是( )
A.与反应生成,有利于棉花燃烧
B.与发生反应的化学方程式为
C.着火时可用灭火
D.若有78g与足量完全反应,固体的质量增加28g
【提升能力】
10.下列钠的用途与其物理性质相关的是( )
①与钾形成的合金可作原子反应堆的导热剂;②制取;③冶炼金属钛;④制造高压钠灯;⑤作强除水剂
A.①④ B.②③ C.⑤ D.全部
11.在坩埚中加热一小块钠,钠很快熔成小球,停止加热,立即用玻璃棒蘸取少量无水粉末与熔化的钠接触,产生耀眼的火花,并有轻微爆鸣声,同时有红色固体生成,经检验该红色固体与稀硫酸不反应。下列说法错误的是( )
A.钠受热易熔成小球说明其熔点低
B.钠与粉末反应时放出大量热
C.将无水粉末改为溶液,反应现象相同
D.一定条件下,Na可以与CuSOa反应生成Cu
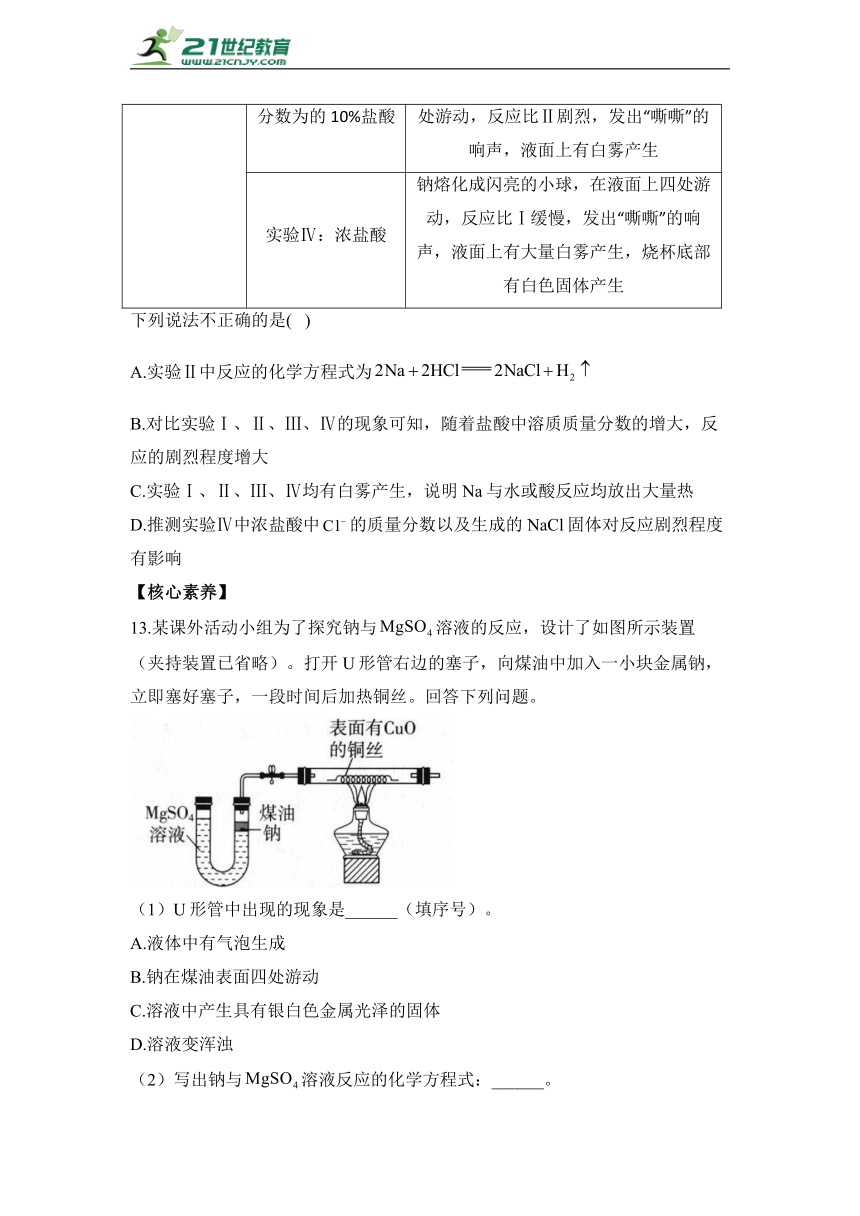
12.某实验小组为研究金属钠的性质,做了如下实验:
实验装置 实验方案
液体a 现象
实验Ⅰ:蒸馏水 钠迅速熔化成闪亮的小球,在水面上四处游动,剧烈反应,发出“嘶嘶”的响声,水面上有少量白雾产生
实验Ⅱ:溶质质量分数为5%的盐酸 钠迅速熔化成闪亮的小 球,在液面上四处游动,反应比剧烈,发出“嘶嘶”的响声,液面上有白雾产生
实验Ⅲ:溶质质量分数为的10%盐酸 钠迅速熔化成闪亮的小球,在液面上四处游动,反应比Ⅱ剧烈,发出“嘶嘶”的响声,液面上有白雾产生
实验Ⅳ:浓盐酸 钠熔化成闪亮的小球,在液面上四处游动,反应比Ⅰ缓慢,发出“嘶嘶”的响声,液面上有大量白雾产生,烧杯底部有白色固体产生
下列说法不正确的是( )
A.实验Ⅱ中反应的化学方程式为
B.对比实验Ⅰ、Ⅱ、Ⅲ、Ⅳ的现象可知,随着盐酸中溶质质量分数的增大,反应的剧烈程度增大
C.实验Ⅰ、Ⅱ、Ⅲ、Ⅳ均有白雾产生,说明Na与水或酸反应均放出大量热
D.推测实验Ⅳ中浓盐酸中的质量分数以及生成的NaCl固体对反应剧烈程度有影响
【核心素养】
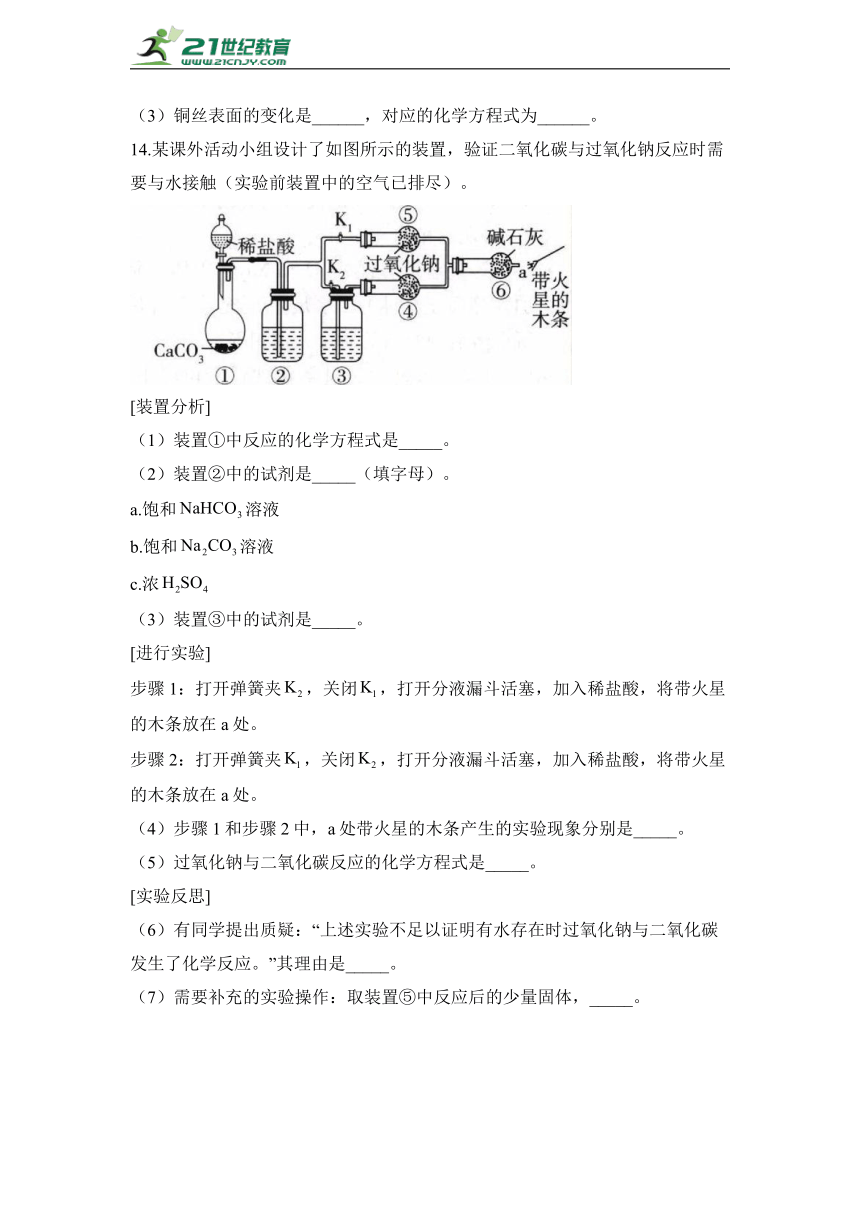
13.某课外活动小组为了探究钠与溶液的反应,设计了如图所示装置(夹持装置已省略)。打开U形管右边的塞子,向煤油中加入一小块金属钠,立即塞好塞子,一段时间后加热铜丝。回答下列问题。
(1)U形管中出现的现象是______(填序号)。
A.液体中有气泡生成
B.钠在煤油表面四处游动
C.溶液中产生具有银白色金属光泽的固体
D.溶液变浑浊
(2)写出钠与溶液反应的化学方程式:______。
(3)铜丝表面的变化是______,对应的化学方程式为______。
14.某课外活动小组设计了如图所示的装置,验证二氧化碳与过氧化钠反应时需要与水接触(实验前装置中的空气已排尽)。
[装置分析]
(1)装置①中反应的化学方程式是_____。
(2)装置②中的试剂是_____(填字母)。
a.饱和溶液
b.饱和溶液
c.浓
(3)装置③中的试剂是_____。
[进行实验]
步骤1:打开弹簧夹,关闭,打开分液漏斗活塞,加入稀盐酸,将带火星的木条放在a处。
步骤2:打开弹簧夹,关闭,打开分液漏斗活塞,加入稀盐酸,将带火星的木条放在a处。
(4)步骤1和步骤2中,a处带火星的木条产生的实验现象分别是_____。
(5)过氧化钠与二氧化碳反应的化学方程式是_____。
[实验反思]
(6)有同学提出质疑:“上述实验不足以证明有水存在时过氧化钠与二氧化碳发生了化学反应。”其理由是_____。
(7)需要补充的实验操作:取装置⑤中反应后的少量固体,_____。
答案
1.答案:D
解析:观察法可以通过视觉、嗅觉、触觉或实验仪器来完成,A项错误;将NaCl固体放入水中是实验法,还需通过观察才能获取实验现象,B项错误;C项涉及的是分类法,C项错误;研究物质的性质时,往往不单独采用一种方法,而是多种方法综合使用,D项正确。
2.答案:A
解析:金属钠与酒精反应、金属钠与水反应两个实验用到了实验法,研究二者的异同用到了观察法与比较法,没有用到分类法。
3.答案:D
解析:钠是一种银白色金属,质软,熔点低,密度比水的小,是热和电的良导体。
4.答案:D
解析:钠的密度比四氯化碳的密度小,会浮在四氯化碳上面,故钠不能保存在四氯化碳中,应将钠保存在煤油或石蜡油中,A项错误、D项正确;实验中剩余的钠应放回原试剂瓶中,B项错误;实验室取用并切割金属钠时,需要用镊子夹取钠,用滤纸吸干钠表面的煤油或石蜡油,用小刀在玻璃片上切割,C项错误。
5.答案:B
解析:图②中钠熔成小球所需热量是由钠与水反应放出的,说明钠的熔点低,A项正确;图②中钠球四处游动是因为钠与水反应产生了气体,气体推动钠球运动,B项错误;图③中滴加酚酞溶液后溶液变红,说明钠与水反应有碱性物质生成,C项正确;钠与水反应的化学方程式是,D项正确。
6.答案:D
解析:①中Na和空气中的发生反应生成了,钠得到氧元素,发生了氧化反应,A项正确;NaOH是白色固体,②变白色是因为和空气中的水发生反应生成了NaOH,B项正确;NaOH易潮解,③是NaOH吸收空气中的水蒸气而潮解的过程,发生的是物理变化,C项正确;④中NaOH与空气中的发生反应生成了,D项错误。
7.答案:B
解析:
A项 为白色固体,题述的淡黄色化合物应为 错误
B项 既能与人吹出的气体中的反应生成和,又能与人吹出的气体中的水蒸气反应生成NaOH和,因此钠着火时不能用泡沫灭火器灭火 正确
C项 与反应生成NaOH和 错误
D项 实验过程中有明火,近距离俯视蒸发皿存在安全隐患 错误
8.答案:D
解析:,A项正确;因为与H2O、CO2反应均能生成O2,所以火灾现场有大量时,不能用水或二氧化碳灭火器来灭火,可用干燥的沙土来灭火,B项正确;由反应可知,作供氧剂时既生成了,又“固定”了,C项正确;与溶液反应生成沉淀、和,溶液由蓝色变为无色是因为转化为,而不是因为的漂白性,D项错误。
9.答案:C
解析:与反应的化学方程式为,反应生成的具有助燃性,有利于棉花燃烧,A、B项正确,C项错误;由化学方程式可知,78g吸收44g,生成16g,固体的质量增加44g-16g=28g,D项正确。
10.答案:A
解析:①因为钠与钾形成的合金在常温下呈液态,导热性强,故可作原子反应堆的导热剂,与钠的物理性质有关;②制取与钠的化学性质有关;③利用钠冶炼金属钛,发生置换反应,与钠的化学性质有关;④制造高压钠灯利用的是钠的物理性质;⑤Na作强除水剂与钠的化学性质有关。综上所述,A项正确。
11.答案:C
解析:钠在坩埚中受热,很快熔成小球,说明其熔点低,A项正确;钠与粉末反应时,产生耀眼的火花,并有轻微爆鸣声,表明反应放出大量热,B项正确;若将无水粉末改为溶液,则钠将先与水反应生成NaOH和,生成的NaOH再与反应生成沉淀,没有铜生成,C项错误;在无水条件下,熔融的Na可以与发生置换反应生成Cu,D项正确。
12.答案:B
解析:实验Ⅱ中金属钠与稀盐酸反应生成氯化钠和氢气,化学方程式为,A项正确;从Ⅰ、Ⅱ、Ⅲ、Ⅳ的实验现象可以看出,随着盐酸中溶质质量分数的增大,反应的剧烈程度有所提高,但当盐酸中溶质质量分数增大到某一程度时,反应的剧烈程度会随之减弱,B项错误;Na与水反应放热,可以将溶液中的水分子或氯化氢分子蒸出到空气中,空气温度较低又使水蒸气在空气中凝结形成白雾或HCl溶在空气中的水蒸气中形成白雾,C项正确;反应Ⅳ中盐酸中溶质质量分数较高,反应一段时间后烧杯底部有白色固体生成,该白色固体为NaCl,对比Ⅰ、Ⅱ、Ⅲ、Ⅳ的实验现象,推测浓盐酸中的质量分数以及生成的NaCl固体都会对反应的剧烈程度有一定的影响,D项正确。
13.答案:(1)AD
(2)
(3)由黑色变为红色;
解析:(1)密度:硫酸镁溶液>钠>煤油,钠与硫酸镁溶液接触时发生反应生成氢氧化镁白色沉淀、氢气和硫酸钠,现象是钠在煤油中上下跳动,有气泡生成,溶液变浑浊,故选AD。
(2)钠与硫酸镁溶液反应的化学方程式为。
(3)与CuO反应生成Cu和,化学方程式为。
14.答案:(1)
(2)a
(3)浓硫酸
(4)步骤1中带火星的木条不复燃,步骤2中带火星的木条复燃
(5)
(6)经过⑤处的气体中有水,水也可与反应产生使带火星的木条复燃
(7)加入稀盐酸,将产生的气体通入澄清石灰水中
解析:装置①为与稀盐酸反应制备二氧化碳的装置,装置②的作用是除去二氧化碳中的氯化氢气体,装置③的作用是除去二氧化碳中的水蒸气。装置④和⑤用来验证二氧化碳与过氧化钠反应时需要与水接触。带火星的木条能检验氧气,二氧化碳不支持燃烧,也不能燃烧,当二氧化碳通过过氧化钠时,不可能全部反应,所以应该除去未反应的二氧化碳,再用带火星的木条来检验是否产生了氧气,否则氧气浓度过低会导致带火星的木条不复燃,则装置⑥的作用是吸收过量的二氧化碳,防止干扰氧气的检验。
(4)步骤1中,通过过氧化钠的二氧化碳中不含有水蒸气,干燥的二氧化碳不能和过氧化钠反应,没有氧气生成,a处带火星的木条不复燃;步骤2中,通过过氧化钠的二氧化碳中含有水蒸气,含有水蒸气的二氧化碳能和过氧化钠反应,有氧气生成,a处带火星的木条复燃。
(5)过氧化钠与二氧化碳反应生成碳酸钠和氧气,反应的化学方程式为。
(6)因水也能和过氧化钠反应生成氧气,所以不能证明是二氧化碳和过氧化钠发生反应产生了氧气。
(7)二氧化碳和过氧化钠反应有碳酸钠生成,装置⑤中反应后的固体有碳酸钠,稀盐酸和碳酸钠反应可生成二氧化碳,二氧化碳能使澄清石灰水变浑浊。
【夯实基础】
知识点1 研究物质性质的基本方法
1.下列关于研究物质性质的方法的描述正确的是( )
A.观察法只能通过视觉来完成
B.将NaCl固体放入水中,从而获取NaCl的某些性质,这只涉及实验法
C.银、铁、铜、锌等均为金属,具有金属光泽和导电性,涉及的是比较法
D.研究物质的性质时,往往同时采用观察、实验、分类、比较等方法中的多种方法
2.金属钠不仅能与氧气和水反应,还能与酒精在常温下反应,要研究金属钠与酒精反应的性质以及金属钠与酒精反应和金属钠与水反应的异同点,下列研究方法没有用到的是( )
A.分类法 B.实验法 C.观察法 D.比较法
知识点2观察金属钠及金属钠与水反应
3.下列有关钠的物理性质的叙述正确的是( )
①银白色金属;②质软,可以用小刀切;③熔点低于100 ℃;④密度比水的小;⑤热和电的良导体
A.仅①②④⑤ B.仅①②③④ C.仅①③④⑤ D.①②③④⑤
4.钠是一种很活泼的金属。已知:水的密度小于四氯化碳的密度。下列有关钠的说法正确的是( )
A.可将钠保存在四氯化碳中
B.实验中剩余的钠应放进废液桶中
C.实验室取用并切割金属钠只需要3种用品
D.钠通常保存在煤油或石蜡油中
5.钠与水反应的实验过程如图所示,下列有关说法不正确的是( )
A.图②中钠熔成小球,说明钠与水反应放热且钠的熔点低
B.图②中钠球四处游动,说明钠的密度比水的小
C.图③中滴加酚酞溶液后溶液变红,说明钠与水反应有碱性物质生成
D.钠与水反应的化学方程式是
知识点3金属钠与氧气的反应
6.观察法是研究物质性质的基本方法之一。某同学将一小块金属钠放置于空气中,观察到下列现象:银白色变灰暗变白色表面潮湿白色晶体白色粉末,下列说法错误的是( )
A.①中钠发生了氧化反应 B.②变白色是因为生成了氢氧化钠
C.③发生的是物理变化 D.④生成了碳酸氢钠
7.某化学兴趣小组在学校科技节活动中表演了“吹气生火”和“滴水生火”的小魔术。如图所示,先在蒸发皿中分别放两小团脱脂棉,然后裹入一种淡黄色的化合物,再对着脱脂棉吹气或者用胶头滴管滴几滴水,一会儿脱脂棉就会燃烧起来。下列说法正确的是( )
A.淡黄色化合物为
B.“吹气生火”的小魔术可以得出钠着火时不能用泡沫灭火器灭火
C.由“滴水生火”的小魔术可以得出有氢气生成
D.在活动中为了更清楚地观察现象,需要近距离俯视蒸发皿
8.已知:是潜水艇中常用的供氧剂。下列叙述错误的是( )
A.、与水反应都能生成NaOH
B.火灾现场若有大量,可用干燥的沙土来灭火
C.作供氧剂时既生成了,又“固定”了
D.向硫酸铜溶液中加入足量固体,静置后溶液由蓝色变为无色,说明过氧化钠具有漂白性
9.用一团棉花包裹少量过氧化钠置于坩埚中,将气体缓缓通入棉花中,棉花很快燃烧起来。下列说法错误的是( )
A.与反应生成,有利于棉花燃烧
B.与发生反应的化学方程式为
C.着火时可用灭火
D.若有78g与足量完全反应,固体的质量增加28g
【提升能力】
10.下列钠的用途与其物理性质相关的是( )
①与钾形成的合金可作原子反应堆的导热剂;②制取;③冶炼金属钛;④制造高压钠灯;⑤作强除水剂
A.①④ B.②③ C.⑤ D.全部
11.在坩埚中加热一小块钠,钠很快熔成小球,停止加热,立即用玻璃棒蘸取少量无水粉末与熔化的钠接触,产生耀眼的火花,并有轻微爆鸣声,同时有红色固体生成,经检验该红色固体与稀硫酸不反应。下列说法错误的是( )
A.钠受热易熔成小球说明其熔点低
B.钠与粉末反应时放出大量热
C.将无水粉末改为溶液,反应现象相同
D.一定条件下,Na可以与CuSOa反应生成Cu
12.某实验小组为研究金属钠的性质,做了如下实验:
实验装置 实验方案
液体a 现象
实验Ⅰ:蒸馏水 钠迅速熔化成闪亮的小球,在水面上四处游动,剧烈反应,发出“嘶嘶”的响声,水面上有少量白雾产生
实验Ⅱ:溶质质量分数为5%的盐酸 钠迅速熔化成闪亮的小 球,在液面上四处游动,反应比剧烈,发出“嘶嘶”的响声,液面上有白雾产生
实验Ⅲ:溶质质量分数为的10%盐酸 钠迅速熔化成闪亮的小球,在液面上四处游动,反应比Ⅱ剧烈,发出“嘶嘶”的响声,液面上有白雾产生
实验Ⅳ:浓盐酸 钠熔化成闪亮的小球,在液面上四处游动,反应比Ⅰ缓慢,发出“嘶嘶”的响声,液面上有大量白雾产生,烧杯底部有白色固体产生
下列说法不正确的是( )
A.实验Ⅱ中反应的化学方程式为
B.对比实验Ⅰ、Ⅱ、Ⅲ、Ⅳ的现象可知,随着盐酸中溶质质量分数的增大,反应的剧烈程度增大
C.实验Ⅰ、Ⅱ、Ⅲ、Ⅳ均有白雾产生,说明Na与水或酸反应均放出大量热
D.推测实验Ⅳ中浓盐酸中的质量分数以及生成的NaCl固体对反应剧烈程度有影响
【核心素养】
13.某课外活动小组为了探究钠与溶液的反应,设计了如图所示装置(夹持装置已省略)。打开U形管右边的塞子,向煤油中加入一小块金属钠,立即塞好塞子,一段时间后加热铜丝。回答下列问题。
(1)U形管中出现的现象是______(填序号)。
A.液体中有气泡生成
B.钠在煤油表面四处游动
C.溶液中产生具有银白色金属光泽的固体
D.溶液变浑浊
(2)写出钠与溶液反应的化学方程式:______。
(3)铜丝表面的变化是______,对应的化学方程式为______。
14.某课外活动小组设计了如图所示的装置,验证二氧化碳与过氧化钠反应时需要与水接触(实验前装置中的空气已排尽)。
[装置分析]
(1)装置①中反应的化学方程式是_____。
(2)装置②中的试剂是_____(填字母)。
a.饱和溶液
b.饱和溶液
c.浓
(3)装置③中的试剂是_____。
[进行实验]
步骤1:打开弹簧夹,关闭,打开分液漏斗活塞,加入稀盐酸,将带火星的木条放在a处。
步骤2:打开弹簧夹,关闭,打开分液漏斗活塞,加入稀盐酸,将带火星的木条放在a处。
(4)步骤1和步骤2中,a处带火星的木条产生的实验现象分别是_____。
(5)过氧化钠与二氧化碳反应的化学方程式是_____。
[实验反思]
(6)有同学提出质疑:“上述实验不足以证明有水存在时过氧化钠与二氧化碳发生了化学反应。”其理由是_____。
(7)需要补充的实验操作:取装置⑤中反应后的少量固体,_____。
答案
1.答案:D
解析:观察法可以通过视觉、嗅觉、触觉或实验仪器来完成,A项错误;将NaCl固体放入水中是实验法,还需通过观察才能获取实验现象,B项错误;C项涉及的是分类法,C项错误;研究物质的性质时,往往不单独采用一种方法,而是多种方法综合使用,D项正确。
2.答案:A
解析:金属钠与酒精反应、金属钠与水反应两个实验用到了实验法,研究二者的异同用到了观察法与比较法,没有用到分类法。
3.答案:D
解析:钠是一种银白色金属,质软,熔点低,密度比水的小,是热和电的良导体。
4.答案:D
解析:钠的密度比四氯化碳的密度小,会浮在四氯化碳上面,故钠不能保存在四氯化碳中,应将钠保存在煤油或石蜡油中,A项错误、D项正确;实验中剩余的钠应放回原试剂瓶中,B项错误;实验室取用并切割金属钠时,需要用镊子夹取钠,用滤纸吸干钠表面的煤油或石蜡油,用小刀在玻璃片上切割,C项错误。
5.答案:B
解析:图②中钠熔成小球所需热量是由钠与水反应放出的,说明钠的熔点低,A项正确;图②中钠球四处游动是因为钠与水反应产生了气体,气体推动钠球运动,B项错误;图③中滴加酚酞溶液后溶液变红,说明钠与水反应有碱性物质生成,C项正确;钠与水反应的化学方程式是,D项正确。
6.答案:D
解析:①中Na和空气中的发生反应生成了,钠得到氧元素,发生了氧化反应,A项正确;NaOH是白色固体,②变白色是因为和空气中的水发生反应生成了NaOH,B项正确;NaOH易潮解,③是NaOH吸收空气中的水蒸气而潮解的过程,发生的是物理变化,C项正确;④中NaOH与空气中的发生反应生成了,D项错误。
7.答案:B
解析:
A项 为白色固体,题述的淡黄色化合物应为 错误
B项 既能与人吹出的气体中的反应生成和,又能与人吹出的气体中的水蒸气反应生成NaOH和,因此钠着火时不能用泡沫灭火器灭火 正确
C项 与反应生成NaOH和 错误
D项 实验过程中有明火,近距离俯视蒸发皿存在安全隐患 错误
8.答案:D
解析:,A项正确;因为与H2O、CO2反应均能生成O2,所以火灾现场有大量时,不能用水或二氧化碳灭火器来灭火,可用干燥的沙土来灭火,B项正确;由反应可知,作供氧剂时既生成了,又“固定”了,C项正确;与溶液反应生成沉淀、和,溶液由蓝色变为无色是因为转化为,而不是因为的漂白性,D项错误。
9.答案:C
解析:与反应的化学方程式为,反应生成的具有助燃性,有利于棉花燃烧,A、B项正确,C项错误;由化学方程式可知,78g吸收44g,生成16g,固体的质量增加44g-16g=28g,D项正确。
10.答案:A
解析:①因为钠与钾形成的合金在常温下呈液态,导热性强,故可作原子反应堆的导热剂,与钠的物理性质有关;②制取与钠的化学性质有关;③利用钠冶炼金属钛,发生置换反应,与钠的化学性质有关;④制造高压钠灯利用的是钠的物理性质;⑤Na作强除水剂与钠的化学性质有关。综上所述,A项正确。
11.答案:C
解析:钠在坩埚中受热,很快熔成小球,说明其熔点低,A项正确;钠与粉末反应时,产生耀眼的火花,并有轻微爆鸣声,表明反应放出大量热,B项正确;若将无水粉末改为溶液,则钠将先与水反应生成NaOH和,生成的NaOH再与反应生成沉淀,没有铜生成,C项错误;在无水条件下,熔融的Na可以与发生置换反应生成Cu,D项正确。
12.答案:B
解析:实验Ⅱ中金属钠与稀盐酸反应生成氯化钠和氢气,化学方程式为,A项正确;从Ⅰ、Ⅱ、Ⅲ、Ⅳ的实验现象可以看出,随着盐酸中溶质质量分数的增大,反应的剧烈程度有所提高,但当盐酸中溶质质量分数增大到某一程度时,反应的剧烈程度会随之减弱,B项错误;Na与水反应放热,可以将溶液中的水分子或氯化氢分子蒸出到空气中,空气温度较低又使水蒸气在空气中凝结形成白雾或HCl溶在空气中的水蒸气中形成白雾,C项正确;反应Ⅳ中盐酸中溶质质量分数较高,反应一段时间后烧杯底部有白色固体生成,该白色固体为NaCl,对比Ⅰ、Ⅱ、Ⅲ、Ⅳ的实验现象,推测浓盐酸中的质量分数以及生成的NaCl固体都会对反应的剧烈程度有一定的影响,D项正确。
13.答案:(1)AD
(2)
(3)由黑色变为红色;
解析:(1)密度:硫酸镁溶液>钠>煤油,钠与硫酸镁溶液接触时发生反应生成氢氧化镁白色沉淀、氢气和硫酸钠,现象是钠在煤油中上下跳动,有气泡生成,溶液变浑浊,故选AD。
(2)钠与硫酸镁溶液反应的化学方程式为。
(3)与CuO反应生成Cu和,化学方程式为。
14.答案:(1)
(2)a
(3)浓硫酸
(4)步骤1中带火星的木条不复燃,步骤2中带火星的木条复燃
(5)
(6)经过⑤处的气体中有水,水也可与反应产生使带火星的木条复燃
(7)加入稀盐酸,将产生的气体通入澄清石灰水中
解析:装置①为与稀盐酸反应制备二氧化碳的装置,装置②的作用是除去二氧化碳中的氯化氢气体,装置③的作用是除去二氧化碳中的水蒸气。装置④和⑤用来验证二氧化碳与过氧化钠反应时需要与水接触。带火星的木条能检验氧气,二氧化碳不支持燃烧,也不能燃烧,当二氧化碳通过过氧化钠时,不可能全部反应,所以应该除去未反应的二氧化碳,再用带火星的木条来检验是否产生了氧气,否则氧气浓度过低会导致带火星的木条不复燃,则装置⑥的作用是吸收过量的二氧化碳,防止干扰氧气的检验。
(4)步骤1中,通过过氧化钠的二氧化碳中不含有水蒸气,干燥的二氧化碳不能和过氧化钠反应,没有氧气生成,a处带火星的木条不复燃;步骤2中,通过过氧化钠的二氧化碳中含有水蒸气,含有水蒸气的二氧化碳能和过氧化钠反应,有氧气生成,a处带火星的木条复燃。
(5)过氧化钠与二氧化碳反应生成碳酸钠和氧气,反应的化学方程式为。
(6)因水也能和过氧化钠反应生成氧气,所以不能证明是二氧化碳和过氧化钠发生反应产生了氧气。
(7)二氧化碳和过氧化钠反应有碳酸钠生成,装置⑤中反应后的固体有碳酸钠,稀盐酸和碳酸钠反应可生成二氧化碳,二氧化碳能使澄清石灰水变浑浊。
