1.4 常见的碱 第1课时(课件 21张PPT)
文档属性
| 名称 | 1.4 常见的碱 第1课时(课件 21张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 5.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2025-08-17 09:48:46 | ||
图片预览







文档简介
(共21张PPT)
洗澡时不小心有肥皂泡溅到嘴里有涩味;食用未成熟的柿子也有涩味。
碱性物质有涩味。
1.4.1 常见的碱
【核心概念】
1.物质的结构与性质 结构与功能
【学习内容与要求】
1.4 常见的化合物
认识盐酸的主要性质和在日常生活生产中的用途。会描述氢氧化钠、氢氧化钙常见化学反应的现象,寻找化学变化的证据。能通过观察和实验,归纳碱的化学性质;碱有相似的化学性质,由溶液中的氢氧根离子决定。
【教学目标】
1.科学观念:知道碱的四条通性;会熟练书写酸、非金属氧化物、盐与碱反应的化学方程式。
2.科学思维:归纳碱的化学性质,并会应用这些性质解释相关现象。
3.探究实践:能用实验研究碱的化学性质,正确进行实验操作。
4.态度责任:养成良好的观察实验和分析现象的习惯,体会学习科学的快乐。
知道碱的四条通性
学习酸的性质后,你认为我们可以用什么方法认识碱?
对一类物质中的典型物质进行分析,归纳共性。
用对比实验的方法寻找物质的特性,得出个性。
例如:研究酸的性质时,分析盐酸、硫酸得出。
例如:盐酸中的氯离子、硫酸中硫酸根离子。
物质的变 化
物质的
性 质
归纳
物质的
用 途
推测
1.1 与指示剂反应
酚酞试液 紫色石蕊试液 pH试纸
氢氧化钠溶液
实验中的现象说明氢氧化钠具有什么性质?
氢氧化钠溶液能使无色酚酞试液变红、紫色石蕊试液变蓝、pH试纸变蓝。
变红
变蓝
变蓝
酚酞试液 紫色石蕊试液 pH试纸
氢氧化钙溶液
实验中的现象说明氢氧化钙具有什么性质?
氢氧化钙溶液能使无色酚酞试液变红、紫色石蕊试液变蓝、pH试纸变蓝。
变红
变蓝
变蓝
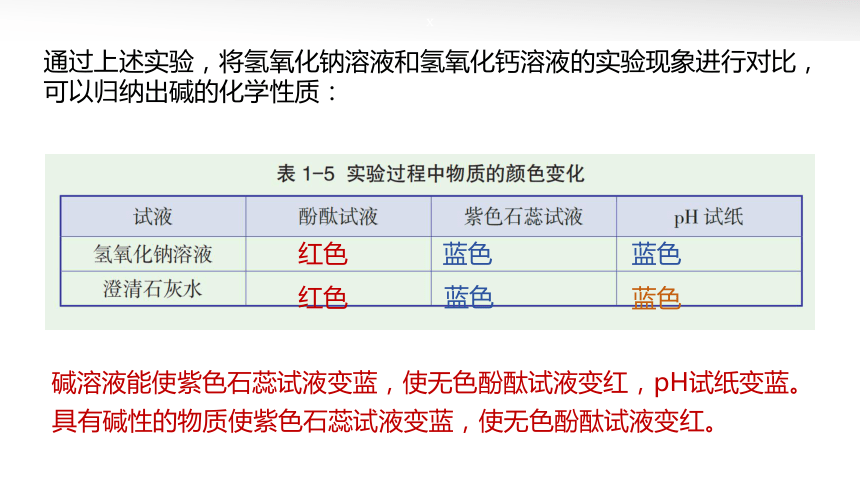
通过上述实验,将氢氧化钠溶液和氢氧化钙溶液的实验现象进行对比,可以归纳出碱的化学性质:
红色
蓝色
红色
蓝色
蓝色
蓝色
碱溶液能使紫色石蕊试液变蓝,使无色酚酞试液变红,pH试纸变蓝。
具有碱性的物质使紫色石蕊试液变蓝,使无色酚酞试液变红。
思考:这里为什么要说成“碱溶液”,而不直接说成“碱”?
有些碱不能溶于水,如氢氧化铜、氢氧化铁,由于不溶于水、难电离,它们不能使紫色石蕊试液、无色酚酞试液变色。
碱中只有氨水(NH3·H2O)、NaOH、KOH、Ca(OH)2、Ba(OH)2能溶于水、电离产生氢氧根离子,其它均不溶。
使紫色石蕊试液、无色酚酞试液变色的是氢氧根离子。
1.2 与非金属氧化物反应
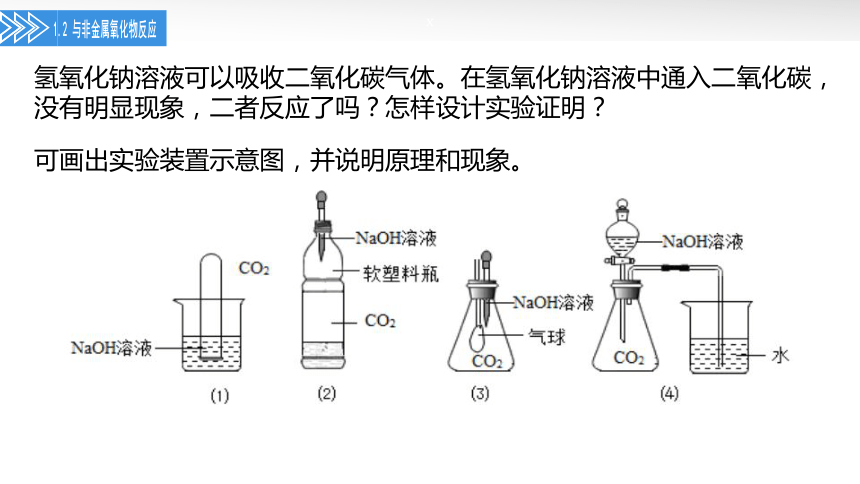
氢氧化钠溶液可以吸收二氧化碳气体。在氢氧化钠溶液中通入二氧化碳,没有明显现象,二者反应了吗?怎样设计实验证明?
可画出实验装置示意图,并说明原理和现象。
(1)实验装置示意图,并说明原理和现象。
(4)烧杯中的水进入导管。
氢氧化钠能与二氧化碳反应,2NaOH+CO2=Na2CO3+H2O,使装置内外产生压强差。
原理:
现象:
(1)试管内液面上升;
(2)软塑料瓶变瘪;
(3)锥形瓶中气球胀大;
(2)有同学认为根据上述现象得出“二氧化碳被氢氧化钠溶液吸收”的结论是不严谨,请你说明理由并提出改进方案
(2)有同学认为根据上述现象得出“二氧化碳被氢氧化钠溶液吸收”的结论是不严谨,请你说明理由并提出改进方案
氢氧化钠溶液中含有水,CO2能溶于水,应排除水的干扰。
还需把上述实验中的氢氧化钠溶液换成等体积的水,做对比实验。
验证CO2与氢氧化钠反应,你可能还有实验方案,课后与同学交流。
用NaOH溶液吸收。
SO2 + 2NaOH = Na2SO3 +H2O
二氧化硫排入大气有何危害?如何除去二氧化硫气体呢?请写出化学方程式。
工业上常用碱溶液来吸收有毒的酸性气体,如:H2S、SO2、HCl。
请写出检验二氧化碳的化学方程式:
CO2 + Ca(OH)2 = CaCO3 ↓+ H2O
CO2、SO2是非金属氧化物, 根据以上反应,归纳出碱的化学性质:
碱+非金属氧化物 → 盐+水
H2S、SO2、HCl
2.氢氧化钠或氢氧化钠溶液不能敞口放置,为什么?
CO2+2NaOH=Na2CO3+H2O
1.盛放氢氧化钠溶液的试剂瓶为什么不能用玻璃塞而是用橡皮塞?
SiO2+2NaOH=Na2SiO3+ H2O
Na2SiO3是一种粘合剂
思考
3.用石灰乳刷墙,并在室内烧一个炭盆,开始墙面变得潮湿,过几天墙壁就变得又硬又白了。为什么?
CO2 + Ca(OH)2 = CaCO3 ↓+ H2O
硅酸钠
4.检验CO2为什么不用氢氧化钠而用澄清石灰水?
CO2与NaOH反应没有明显现象,而与Ca(OH)2 反应产生白色沉淀。
思考
5.氢氧化钠与稀盐酸反应没有明显的现象,实验时有的氢氧化钠溶液中加入过量的稀盐酸,会发现产生气泡,这是为什么?
氢氧化钠吸收了空气中的CO2而变质成了Na2CO3,Na2CO3与盐酸反应产生了CO2。
CO2+2NaOH=Na2CO3+H2O
Na2CO3+2HCl=2NaCl+CO2↑+H2O
1.3 与盐反应
氯化铁溶液
氯化铜溶液
蓝色
氢氧化钠溶液
蓝色絮状沉淀
红褐色絮状沉淀
黄色
氢氧化钠溶液
盐溶液 颜色 加入氢氧化钠溶液后的现象 有关化学方程式
氯化铜溶液
氯化铁溶液
蓝色
黄色
产生蓝色絮状沉淀
产生红褐色絮状沉淀
碱 +盐 = 另一种碱 + 另一种盐
CuCl2+2NaOH=Cu(OH)2↓+2NaCl
FeCl3 +3NaOH=Fe(OH)3↓+3NaCl
反应物可溶,生成物有沉淀生成。
2.在另2支试管中各加入3 mL氢氧化钙溶液,然后分别滴加数滴碳酸钠溶液和氯化铁溶液,如图1-24所示,观察有什么变
化发生,写出化学方程式。
碱+盐 →另一种碱 + 另一种盐
实验现象 有关化学方程式
碳酸钠溶液
氯化铁溶液
产生白色沉淀
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
产生红褐色沉淀
3Ca(OH)2+2FeCl3=2Fe(OH)3↓+3CaCl2
Na2CO3、FeCl3属于盐。
氢氧化钙能与盐反应。
反应物可溶,生成物有沉淀生成。
1.4 与酸反应
活动
1.在2支试管中各加入3 mL氢氧化钙溶液,然后分别滴加盐酸和硫酸,如图1-24所示,观察有什么变化发生,写出化学方程式。
实验现象 有关化学方程式
盐酸
硫酸
无明显现象
无明显现象
Ca(OH)2+2HCl=CaCl2+2H2O
Ca(OH)2+H2SO4=CaSO4+2H2O
氢氧化钙能与酸反应。
实验无明显现象,氢氧化钙与酸反应了吗?
加入紫色石蕊试液,观察溶液颜色变化。
碱+酸 →盐 + 水
洗澡时不小心有肥皂泡溅到嘴里有涩味;食用未成熟的柿子也有涩味。
碱性物质有涩味。
1.4.1 常见的碱
【核心概念】
1.物质的结构与性质 结构与功能
【学习内容与要求】
1.4 常见的化合物
认识盐酸的主要性质和在日常生活生产中的用途。会描述氢氧化钠、氢氧化钙常见化学反应的现象,寻找化学变化的证据。能通过观察和实验,归纳碱的化学性质;碱有相似的化学性质,由溶液中的氢氧根离子决定。
【教学目标】
1.科学观念:知道碱的四条通性;会熟练书写酸、非金属氧化物、盐与碱反应的化学方程式。
2.科学思维:归纳碱的化学性质,并会应用这些性质解释相关现象。
3.探究实践:能用实验研究碱的化学性质,正确进行实验操作。
4.态度责任:养成良好的观察实验和分析现象的习惯,体会学习科学的快乐。
知道碱的四条通性
学习酸的性质后,你认为我们可以用什么方法认识碱?
对一类物质中的典型物质进行分析,归纳共性。
用对比实验的方法寻找物质的特性,得出个性。
例如:研究酸的性质时,分析盐酸、硫酸得出。
例如:盐酸中的氯离子、硫酸中硫酸根离子。
物质的变 化
物质的
性 质
归纳
物质的
用 途
推测
1.1 与指示剂反应
酚酞试液 紫色石蕊试液 pH试纸
氢氧化钠溶液
实验中的现象说明氢氧化钠具有什么性质?
氢氧化钠溶液能使无色酚酞试液变红、紫色石蕊试液变蓝、pH试纸变蓝。
变红
变蓝
变蓝
酚酞试液 紫色石蕊试液 pH试纸
氢氧化钙溶液
实验中的现象说明氢氧化钙具有什么性质?
氢氧化钙溶液能使无色酚酞试液变红、紫色石蕊试液变蓝、pH试纸变蓝。
变红
变蓝
变蓝
通过上述实验,将氢氧化钠溶液和氢氧化钙溶液的实验现象进行对比,可以归纳出碱的化学性质:
红色
蓝色
红色
蓝色
蓝色
蓝色
碱溶液能使紫色石蕊试液变蓝,使无色酚酞试液变红,pH试纸变蓝。
具有碱性的物质使紫色石蕊试液变蓝,使无色酚酞试液变红。
思考:这里为什么要说成“碱溶液”,而不直接说成“碱”?
有些碱不能溶于水,如氢氧化铜、氢氧化铁,由于不溶于水、难电离,它们不能使紫色石蕊试液、无色酚酞试液变色。
碱中只有氨水(NH3·H2O)、NaOH、KOH、Ca(OH)2、Ba(OH)2能溶于水、电离产生氢氧根离子,其它均不溶。
使紫色石蕊试液、无色酚酞试液变色的是氢氧根离子。
1.2 与非金属氧化物反应
氢氧化钠溶液可以吸收二氧化碳气体。在氢氧化钠溶液中通入二氧化碳,没有明显现象,二者反应了吗?怎样设计实验证明?
可画出实验装置示意图,并说明原理和现象。
(1)实验装置示意图,并说明原理和现象。
(4)烧杯中的水进入导管。
氢氧化钠能与二氧化碳反应,2NaOH+CO2=Na2CO3+H2O,使装置内外产生压强差。
原理:
现象:
(1)试管内液面上升;
(2)软塑料瓶变瘪;
(3)锥形瓶中气球胀大;
(2)有同学认为根据上述现象得出“二氧化碳被氢氧化钠溶液吸收”的结论是不严谨,请你说明理由并提出改进方案
(2)有同学认为根据上述现象得出“二氧化碳被氢氧化钠溶液吸收”的结论是不严谨,请你说明理由并提出改进方案
氢氧化钠溶液中含有水,CO2能溶于水,应排除水的干扰。
还需把上述实验中的氢氧化钠溶液换成等体积的水,做对比实验。
验证CO2与氢氧化钠反应,你可能还有实验方案,课后与同学交流。
用NaOH溶液吸收。
SO2 + 2NaOH = Na2SO3 +H2O
二氧化硫排入大气有何危害?如何除去二氧化硫气体呢?请写出化学方程式。
工业上常用碱溶液来吸收有毒的酸性气体,如:H2S、SO2、HCl。
请写出检验二氧化碳的化学方程式:
CO2 + Ca(OH)2 = CaCO3 ↓+ H2O
CO2、SO2是非金属氧化物, 根据以上反应,归纳出碱的化学性质:
碱+非金属氧化物 → 盐+水
H2S、SO2、HCl
2.氢氧化钠或氢氧化钠溶液不能敞口放置,为什么?
CO2+2NaOH=Na2CO3+H2O
1.盛放氢氧化钠溶液的试剂瓶为什么不能用玻璃塞而是用橡皮塞?
SiO2+2NaOH=Na2SiO3+ H2O
Na2SiO3是一种粘合剂
思考
3.用石灰乳刷墙,并在室内烧一个炭盆,开始墙面变得潮湿,过几天墙壁就变得又硬又白了。为什么?
CO2 + Ca(OH)2 = CaCO3 ↓+ H2O
硅酸钠
4.检验CO2为什么不用氢氧化钠而用澄清石灰水?
CO2与NaOH反应没有明显现象,而与Ca(OH)2 反应产生白色沉淀。
思考
5.氢氧化钠与稀盐酸反应没有明显的现象,实验时有的氢氧化钠溶液中加入过量的稀盐酸,会发现产生气泡,这是为什么?
氢氧化钠吸收了空气中的CO2而变质成了Na2CO3,Na2CO3与盐酸反应产生了CO2。
CO2+2NaOH=Na2CO3+H2O
Na2CO3+2HCl=2NaCl+CO2↑+H2O
1.3 与盐反应
氯化铁溶液
氯化铜溶液
蓝色
氢氧化钠溶液
蓝色絮状沉淀
红褐色絮状沉淀
黄色
氢氧化钠溶液
盐溶液 颜色 加入氢氧化钠溶液后的现象 有关化学方程式
氯化铜溶液
氯化铁溶液
蓝色
黄色
产生蓝色絮状沉淀
产生红褐色絮状沉淀
碱 +盐 = 另一种碱 + 另一种盐
CuCl2+2NaOH=Cu(OH)2↓+2NaCl
FeCl3 +3NaOH=Fe(OH)3↓+3NaCl
反应物可溶,生成物有沉淀生成。
2.在另2支试管中各加入3 mL氢氧化钙溶液,然后分别滴加数滴碳酸钠溶液和氯化铁溶液,如图1-24所示,观察有什么变
化发生,写出化学方程式。
碱+盐 →另一种碱 + 另一种盐
实验现象 有关化学方程式
碳酸钠溶液
氯化铁溶液
产生白色沉淀
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
产生红褐色沉淀
3Ca(OH)2+2FeCl3=2Fe(OH)3↓+3CaCl2
Na2CO3、FeCl3属于盐。
氢氧化钙能与盐反应。
反应物可溶,生成物有沉淀生成。
1.4 与酸反应
活动
1.在2支试管中各加入3 mL氢氧化钙溶液,然后分别滴加盐酸和硫酸,如图1-24所示,观察有什么变化发生,写出化学方程式。
实验现象 有关化学方程式
盐酸
硫酸
无明显现象
无明显现象
Ca(OH)2+2HCl=CaCl2+2H2O
Ca(OH)2+H2SO4=CaSO4+2H2O
氢氧化钙能与酸反应。
实验无明显现象,氢氧化钙与酸反应了吗?
加入紫色石蕊试液,观察溶液颜色变化。
碱+酸 →盐 + 水
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
