鲁科版高中化学必修一第一章第二节研究物质的方法和程序第二课时课件
文档属性
| 名称 | 鲁科版高中化学必修一第一章第二节研究物质的方法和程序第二课时课件 |

|
|
| 格式 | pptx | ||
| 文件大小 | 21.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-19 21:46:51 | ||
图片预览







文档简介
(共23张PPT)
第二节 研究物质性质的方法和程序
第2课时 研究物质性质的方法
鲁科版2019必修第一册
第一章 认识化学科学
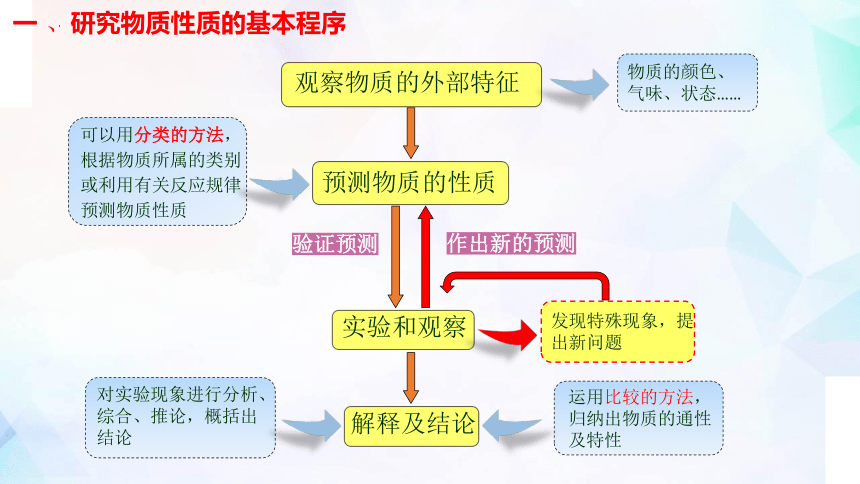
一 、研究物质性质的基本程序
观察物质的外部特征
预测物质的性质
实验和观察
解释及结论
发现特殊现象,提
出新问题
可以用分类的方法,
根据物质所属的类别
或利用有关反应规律
预测物质性质
对实验现象进行分析、综合、推论,概括出结论
运用比较的方法,归纳出物质的通性及特性
物质的颜色、
气味、状态……
验证预测
作出新的预测
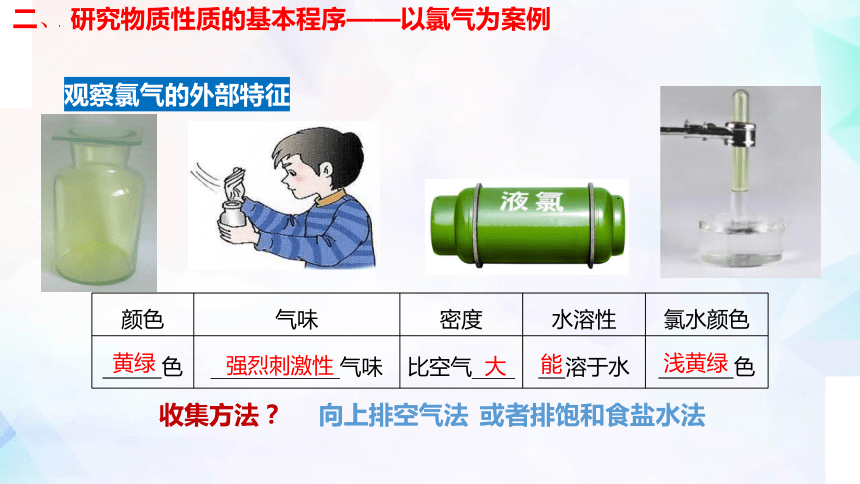
二、 研究物质性质的基本程序——以氯气为案例
观察氯气的外部特征
收集方法?
向上排空气法
或者排饱和食盐水法
颜色 气味 密度 水溶性 氯水颜色
色 ____________气味 比空气____ 溶于水 色
强烈刺激性
大
浅黄绿
黄绿
能
二、 研究物质性质的基本程序——以氯气为案例
预测氯气的化学性质
想一想:
你认为氯气可能具有哪些化学性质?
分类法
氯气可以与钠、铁、铜、氢气反应得到氯化物
实验注意事项
氯气有毒,实验应在通风厨中进行,并做好自身防护。
氢气点燃前应该验纯。
二、 研究物质性质的基本程序——以氯气为案例
现象:
剧烈燃烧,发出黄光,放出大量热,产生白烟
生成氯化钠
实验1:将盛有氯气的集气瓶迅速倒扣在受热熔化的钠球上方
结论:
实验验证
二、 研究物质性质的基本程序——以氯气为案例
实验验证
剧烈燃烧,产生红棕色烟;底部溶液呈棕黄色
生成氯化铁
现象:
结论:
实验2:用坩埚钳夹住烧得红热的细铁丝伸入充满氯气的集气瓶中,瓶内保留少量水,观察现象 。
二、 研究物质性质的基本程序——以氯气为案例
剧烈燃烧,产生棕黄色烟;底部溶液呈蓝色
生成氯化铜
实验3:用坩埚钳夹住烧得红热的细铜丝伸入充满氯气的集气瓶中,瓶内保留少量水 ,观察现象 。
现象:
结论:
实验验证
二、 研究物质性质的基本程序——以氯气为案例
安静地燃烧,产生苍白色火焰,瓶口上方产生白雾
生成氯化氢
实验4:氢气验纯后点燃,然后把通氢气的导管伸入盛氯气的集气瓶中。
现象:
结论:
实验验证
二、 研究物质性质的基本程序——以氯气为案例
发生的化学方程式:
Cl2 + H2 === 2HCl
点燃
2Fe + 3Cl2 ===2FeCl3
点燃
Cu + Cl2 ===CuCl2
点燃
2Na + Cl2 ===2NaCl
点燃
(工业制盐酸的方法)
变价金属与 Cl2 反应时一般显高价,得到高价金属氯化物
Cl2 + H2 === 2HCl
光照
(爆炸)
二、 研究物质性质的基本程序——以氯气为案例
结合以上几个反应,燃烧必须需要氧气参与吗?
不是。
我们在初中学过的燃烧定义是狭义的,可以说,任何发光、发热的剧烈化学反应都是燃烧。(广义的燃烧)
二、 研究物质性质的基本程序——以氯气为案例
发现新问题,进一步研究
研究氯气溶解性时,发现一段时间后,密闭容器中氯水的颜色变浅了
预测
氯气与水发生了化学反应
依据
Cl2呈黄绿色,氯水颜色变浅了
结论:干燥的Cl2无漂白性,氯气能与水反应,且产生具有漂白性的物质
二、 研究物质性质的基本程序——以氯气为案例
新知学习 02 研究物质性质的基本程序——以氯气为案例
实验探究
实验一:氯水中有无Cl-
氯水
AgNO3溶液
(硝酸酸化)
白色沉淀
现象
结论
有Cl-
实验探究
实验二:氯水中有无H+
蓝色石蕊试纸
盐酸↓
变红
氯水↓
先变红后褪色
Cl2 + H2O ==HCl + HClO
次氯酸
+1
氯水中的溶质?
有气泡产生
现象
结论
镁条
氯水
有H+
方法1
方法2
二、 研究物质性质的基本程序——以氯气为案例
HClO(次氯酸)性质介绍:
1、弱酸性 HCl > H2CO3 > HClO
2、不稳定性
氯水现用现配,保存在棕色细口玻璃瓶中,置于冷暗处
2HClO ===== 2HCl +O2↑
光照或
3、强氧化性 杀菌 消毒 漂白(可使有机色质永久褪色)
三、含氯化合物的性质及用途
液氯 新制氯水 久置氯水
分类
所含物质
颜色
性质
保存
纯净物
只有Cl2分子
Cl2、HCl、HClO、H2O
混合物
混合物
HCl、H2O
黄绿色
浅黄绿色
无色
氧化性
强氧化性、酸性、不稳定性
酸性
特制钢瓶
棕色试剂瓶、密封避光,现用现配
带塞子试剂瓶
三、含氯化合物的性质及用途
〖漂白剂(84消毒液)〗
氯气通入氢氧化钠溶液中
Cl2+2NaOH=NaCl+NaClO+H2O
次氯酸钠
2Cl2+2Ca(OH)2=CaCl2 + Ca(ClO)2 +2H2O
〖漂白粉〗
氯气通入石灰乳中
次氯酸钙
Cl2尾气处理的方法
三、含氯化合物的性质及用途
漂白剂 漂白粉
制备原理
存在状态
主要成分
有效成分
漂白原理
失效原理
氯气通入到氢氧化钠溶液中
Cl2+2NaOH=NaCl+NaClO+H2O
氯气通入到石灰乳中
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
NaClO+CO2+H2O= HClO+NaHCO3
Ca(ClO)2+CO2+H2O= 2HClO+CaCO3
NaClO+CO2+H2O= HClO+NaHCO3
2HClO == 2HCl+O2↑
光照
2HClO == 2HCl+O2↑
光照
Ca(ClO)2+CO2+H2O= 2HClO+CaCO3
保存方式?
避光、密封保存
液体
固体
NaClO
CaCl2和Ca(ClO)2
NaClO
Ca(ClO)2
三、含氯化合物的性质及用途
我们身边的氯气及其化合物……
工农业中的氯气及其化合物……
杀菌消毒的作用
制盐酸
制农药
制含氯溶剂
三、含氯化合物的性质及用途
学习评价
1.可以用氯气灌洞的方法来消灭田鼠,这是利用了氯气的( )
A.密度比空气大 B.易液化 C.能溶于水 D.有毒
2.用氯气跟单质化合不能制取的物质是( )
A.KCl B.FeCl2 C.FeCl3 D.CuCl2
3.某学生用氯气消毒过的自来水配制下列物质的溶液,不会产生明显药品变质的是( )
A.石蕊 B.AgNO3 C.NaOH D.AlCl3
AD
B
D
4.下列化学反应的实验现象结论描述错误的是( )
A.钠在空气中燃烧发出黄色火焰,生成氧化钠
B.铜粉在氯气中燃烧生成棕色的烟
C.铁在氯气中燃烧产生红棕色烟
D.氢气在氯气中燃烧产生淡蓝色火焰
5.将适量的物质分别加到干燥的红色布条上,不能使其褪色的是( )
A.新制的氯水 B.氯化钙溶液 C.液氯 D.次氯酸溶液
6.把石蕊试液滴加到新制的氯水中,出现的现象是()
A.溶液变红色 B.溶液变蓝色
C.溶液变紫色 D.溶液颜色先变红,后立即消失
AD
BC
D
观察物质的外部特征
预测物质的性质
实验和观察
解释及结论
发现长时间放置的
氯水颜色变浅
可以用分类的方法,
将氯气与氧气类比,
进行性质预测
对实验现象进行分析、综合、推论,概括出结论
运用比较的方法,归纳出物质的通性及特性
氯气的物理性质
验证预测
作出新的预测
归纳提升
归纳提升
第二节 研究物质性质的方法和程序
第2课时 研究物质性质的方法
鲁科版2019必修第一册
第一章 认识化学科学
一 、研究物质性质的基本程序
观察物质的外部特征
预测物质的性质
实验和观察
解释及结论
发现特殊现象,提
出新问题
可以用分类的方法,
根据物质所属的类别
或利用有关反应规律
预测物质性质
对实验现象进行分析、综合、推论,概括出结论
运用比较的方法,归纳出物质的通性及特性
物质的颜色、
气味、状态……
验证预测
作出新的预测
二、 研究物质性质的基本程序——以氯气为案例
观察氯气的外部特征
收集方法?
向上排空气法
或者排饱和食盐水法
颜色 气味 密度 水溶性 氯水颜色
色 ____________气味 比空气____ 溶于水 色
强烈刺激性
大
浅黄绿
黄绿
能
二、 研究物质性质的基本程序——以氯气为案例
预测氯气的化学性质
想一想:
你认为氯气可能具有哪些化学性质?
分类法
氯气可以与钠、铁、铜、氢气反应得到氯化物
实验注意事项
氯气有毒,实验应在通风厨中进行,并做好自身防护。
氢气点燃前应该验纯。
二、 研究物质性质的基本程序——以氯气为案例
现象:
剧烈燃烧,发出黄光,放出大量热,产生白烟
生成氯化钠
实验1:将盛有氯气的集气瓶迅速倒扣在受热熔化的钠球上方
结论:
实验验证
二、 研究物质性质的基本程序——以氯气为案例
实验验证
剧烈燃烧,产生红棕色烟;底部溶液呈棕黄色
生成氯化铁
现象:
结论:
实验2:用坩埚钳夹住烧得红热的细铁丝伸入充满氯气的集气瓶中,瓶内保留少量水,观察现象 。
二、 研究物质性质的基本程序——以氯气为案例
剧烈燃烧,产生棕黄色烟;底部溶液呈蓝色
生成氯化铜
实验3:用坩埚钳夹住烧得红热的细铜丝伸入充满氯气的集气瓶中,瓶内保留少量水 ,观察现象 。
现象:
结论:
实验验证
二、 研究物质性质的基本程序——以氯气为案例
安静地燃烧,产生苍白色火焰,瓶口上方产生白雾
生成氯化氢
实验4:氢气验纯后点燃,然后把通氢气的导管伸入盛氯气的集气瓶中。
现象:
结论:
实验验证
二、 研究物质性质的基本程序——以氯气为案例
发生的化学方程式:
Cl2 + H2 === 2HCl
点燃
2Fe + 3Cl2 ===2FeCl3
点燃
Cu + Cl2 ===CuCl2
点燃
2Na + Cl2 ===2NaCl
点燃
(工业制盐酸的方法)
变价金属与 Cl2 反应时一般显高价,得到高价金属氯化物
Cl2 + H2 === 2HCl
光照
(爆炸)
二、 研究物质性质的基本程序——以氯气为案例
结合以上几个反应,燃烧必须需要氧气参与吗?
不是。
我们在初中学过的燃烧定义是狭义的,可以说,任何发光、发热的剧烈化学反应都是燃烧。(广义的燃烧)
二、 研究物质性质的基本程序——以氯气为案例
发现新问题,进一步研究
研究氯气溶解性时,发现一段时间后,密闭容器中氯水的颜色变浅了
预测
氯气与水发生了化学反应
依据
Cl2呈黄绿色,氯水颜色变浅了
结论:干燥的Cl2无漂白性,氯气能与水反应,且产生具有漂白性的物质
二、 研究物质性质的基本程序——以氯气为案例
新知学习 02 研究物质性质的基本程序——以氯气为案例
实验探究
实验一:氯水中有无Cl-
氯水
AgNO3溶液
(硝酸酸化)
白色沉淀
现象
结论
有Cl-
实验探究
实验二:氯水中有无H+
蓝色石蕊试纸
盐酸↓
变红
氯水↓
先变红后褪色
Cl2 + H2O ==HCl + HClO
次氯酸
+1
氯水中的溶质?
有气泡产生
现象
结论
镁条
氯水
有H+
方法1
方法2
二、 研究物质性质的基本程序——以氯气为案例
HClO(次氯酸)性质介绍:
1、弱酸性 HCl > H2CO3 > HClO
2、不稳定性
氯水现用现配,保存在棕色细口玻璃瓶中,置于冷暗处
2HClO ===== 2HCl +O2↑
光照或
3、强氧化性 杀菌 消毒 漂白(可使有机色质永久褪色)
三、含氯化合物的性质及用途
液氯 新制氯水 久置氯水
分类
所含物质
颜色
性质
保存
纯净物
只有Cl2分子
Cl2、HCl、HClO、H2O
混合物
混合物
HCl、H2O
黄绿色
浅黄绿色
无色
氧化性
强氧化性、酸性、不稳定性
酸性
特制钢瓶
棕色试剂瓶、密封避光,现用现配
带塞子试剂瓶
三、含氯化合物的性质及用途
〖漂白剂(84消毒液)〗
氯气通入氢氧化钠溶液中
Cl2+2NaOH=NaCl+NaClO+H2O
次氯酸钠
2Cl2+2Ca(OH)2=CaCl2 + Ca(ClO)2 +2H2O
〖漂白粉〗
氯气通入石灰乳中
次氯酸钙
Cl2尾气处理的方法
三、含氯化合物的性质及用途
漂白剂 漂白粉
制备原理
存在状态
主要成分
有效成分
漂白原理
失效原理
氯气通入到氢氧化钠溶液中
Cl2+2NaOH=NaCl+NaClO+H2O
氯气通入到石灰乳中
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
NaClO+CO2+H2O= HClO+NaHCO3
Ca(ClO)2+CO2+H2O= 2HClO+CaCO3
NaClO+CO2+H2O= HClO+NaHCO3
2HClO == 2HCl+O2↑
光照
2HClO == 2HCl+O2↑
光照
Ca(ClO)2+CO2+H2O= 2HClO+CaCO3
保存方式?
避光、密封保存
液体
固体
NaClO
CaCl2和Ca(ClO)2
NaClO
Ca(ClO)2
三、含氯化合物的性质及用途
我们身边的氯气及其化合物……
工农业中的氯气及其化合物……
杀菌消毒的作用
制盐酸
制农药
制含氯溶剂
三、含氯化合物的性质及用途
学习评价
1.可以用氯气灌洞的方法来消灭田鼠,这是利用了氯气的( )
A.密度比空气大 B.易液化 C.能溶于水 D.有毒
2.用氯气跟单质化合不能制取的物质是( )
A.KCl B.FeCl2 C.FeCl3 D.CuCl2
3.某学生用氯气消毒过的自来水配制下列物质的溶液,不会产生明显药品变质的是( )
A.石蕊 B.AgNO3 C.NaOH D.AlCl3
AD
B
D
4.下列化学反应的实验现象结论描述错误的是( )
A.钠在空气中燃烧发出黄色火焰,生成氧化钠
B.铜粉在氯气中燃烧生成棕色的烟
C.铁在氯气中燃烧产生红棕色烟
D.氢气在氯气中燃烧产生淡蓝色火焰
5.将适量的物质分别加到干燥的红色布条上,不能使其褪色的是( )
A.新制的氯水 B.氯化钙溶液 C.液氯 D.次氯酸溶液
6.把石蕊试液滴加到新制的氯水中,出现的现象是()
A.溶液变红色 B.溶液变蓝色
C.溶液变紫色 D.溶液颜色先变红,后立即消失
AD
BC
D
观察物质的外部特征
预测物质的性质
实验和观察
解释及结论
发现长时间放置的
氯水颜色变浅
可以用分类的方法,
将氯气与氧气类比,
进行性质预测
对实验现象进行分析、综合、推论,概括出结论
运用比较的方法,归纳出物质的通性及特性
氯气的物理性质
验证预测
作出新的预测
归纳提升
归纳提升
